WikiDer > Асимметричное деление клеток
An асимметричное деление клеток производит двух дочерей клетки с разными клеточными судьбами. В отличие от симметричного деления клеток дающие начало дочерним клеткам эквивалентной судьбы. В частности, стволовые клетки делятся асимметрично, давая начало двум отдельным дочерним клеткам: одной копии исходной стволовой клетки, а также второй дочерней клетке, запрограммированной на дифференцировку в судьбу не стволовых клеток. (Во время роста или регенерации стволовые клетки также могут делиться симметрично, чтобы произвести две идентичные копии исходной клетки.[1])
В принципе, существует два механизма, посредством которых различные свойства могут быть переданы дочерям делящейся клетки. В одном из них дочерние клетки изначально эквивалентны, но разница вызвана сигнализация между клетками, из окружающих клеток или из клетки-предшественника. Этот механизм известен как внешнее асимметричное деление клеток. Во втором механизме предполагаемые дочерние клетки по своей сути различаются во время деления материнской клетки. Поскольку этот последний механизм не зависит от взаимодействия клеток друг с другом или с их средой, он должен полагаться на внутренний асимметрия. Термин «асимметричное деление клетки» обычно относится к таким внутренним асимметричным делениям.[2]
Внутренняя асимметрия
Для асимметричного деления материнская клетка должна быть поляризованный, а митотическое веретено должен быть совмещен с осью полярности. В клеточная биология из этих событий наиболее изучены в трех животные модели: the мышь, то нематода Caenorhabditis elegans, и плодовая муха Drosophila melanogaster. Позднее основное внимание было уделено развитию в спиралия.
В C. elegans разработка
В C. elegans, серия асимметричных клеточных делений у ранних эмбрионов критична в настройке передней / задней, дорсальной / вентральной и левой / правой осей плана тела.[3] После оплодотворение, события уже происходят в зигота чтобы учесть первое асимметричное деление клеток. Это первое деление дает два совершенно разных бластомеры, обозначаемые AB и P1. Когда сперматозоид удобряет яйцеклетка, сперма пронуклеус и центросомы откладываются внутри яйца, что вызывает цитоплазматический поток, приводящий к перемещению пронуклеуса и центросом к одному полюсу.[4] Центросомы, откладываемые спермой, ответственны за формирование заднего полюса зиготы.[5] Сперма с мутантными или отсутствующими центросомами не может установить задний полюс.[6][7][8] Установление этой полярности инициирует поляризованное распределение группы белков, присутствующих в зиготе, называемой PARD белки (дефект разделения), которые представляют собой консервативную группу белков, которые функционируют в установлении клеточной полярности во время развития.[9] Эти белки сначала равномерно распределяются по зиготе, а затем становятся поляризованными с образованием заднего полюса. Эта серия событий позволяет одноклеточной зиготе приобретать полярность за счет неравномерного распределения множества факторов.
Одиночная клетка теперь настроена на асимметричное клеточное деление, однако ориентация, в которой происходит деление, также является важным фактором. Митотическое веретено должно быть правильно ориентировано, чтобы гарантировать, что правильные детерминанты клеточной судьбы распределены соответствующим образом в дочерних клетках. Выравнивание веретена опосредуется белками PARD, которые регулируют расположение центросом вдоль оси A / P, а также движение митотического веретена вдоль оси A / P.[10] После этого первого асимметричного деления дочерняя клетка AB делится симметрично, давая начало ABa и ABp, тогда как дочерняя клетка P1 претерпевает другое асимметричное деление клетки с образованием P2 и EMS. Это деление также зависит от распределения белков PAR.[11]
В Дрозофила нейронное развитие

В Drosophila melanogaster, асимметричное деление клеток играет важную роль в нервном развитии. Нейробласты - это клетки-предшественники, которые асимметрично делятся, давая начало другому нейробласту и материнской клетке ганглия (GMC). Нейробласт неоднократно подвергается этому асимметричному клеточному делению, в то время как GMC продолжает производить пару нейронов. Два белка играют важную роль в создании этой асимметрии в нейробласте, Prospero и Numb. Эти белки синтезируются в нейробласте и во время деления разделяются только на GMC.[12] Numb является супрессором Notch, поэтому асимметричное разделение Numb на базальную кору смещает ответ дочерних клеток на передачу сигналов Notch, приводя к двум различным клеточным судьбам.[13] Просперо необходим для регуляции генов в GMC. Он равномерно распределен по цитоплазме нейробласта, но локализуется в базальной коре, когда нейробласт начинает подвергаться митозу. Как только GMC отделяется от базальной коры, Просперо перемещается в ядро GMC, чтобы действовать как фактор транскрипции.[12]
Другие белки, присутствующие в нейробласте, опосредуют асимметричную локализацию Numb и Prospero. Миранда - это закрепляющий белок, который связывается с Просперо и удерживает его в базальной коре. Вслед за поколением GMC Миранда выпускает Просперо, а затем деградирует.[12][14] Сегрегация Numb опосредуется Pon (партнером белка Numb). Pon связывается с Numb и колокализуется с ним во время деления клеток нейробласта.[12]
Митотическое веретено д. Также выстраиваться параллельно асимметрично распределенным детерминантам клеточной судьбы, чтобы позволить им стать сегрегированными в одну дочернюю клетку, а не в другую. Ориентация митотического веретена опосредуется Inscuteable, который отделен от апикальной коры нейробласта. Без присутствия Inscuteable расположение митотического веретена и детерминант клеточной судьбы по отношению друг к другу становится случайным. Inscuteable мутанты демонстрируют равномерное распределение Miranda и Numb в коре головного мозга, и полученные дочерние клетки демонстрируют идентичные судьбы нейронов.[12]
В спиральном развитии
Спиралия (обычно синоним лофотрохозоа) представляют собой разнообразную кладу животных, виды которых составляют большую часть современных двустворчатых животных. Примеры включают моллюски, кольчатые черви, а энтопрокта. Хотя на клеточном и молекулярном уровне многое известно о других билатеральных кладах (экдизозоа и дейтеростомия) исследования процессов, управляющих спиральным развитием, сравнительно отсутствуют. Тем не менее, одна объединяющая черта, присущая спиралям, - это характер дробления в раннем эмбрионе, известный как спиральный разрез.[15]
Механизмы асимметричного деления (См. Рисунок, правая панель):
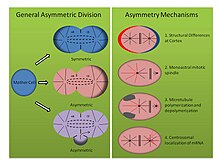
- Tubifex tubifex: иловой червь Тубифекс тубифекс было показано, что демонстрирует интересное асимметричное деление клеток в точке первого эмбрионального дробления. В отличие от классического представления о корковых различиях в зиготической мембране, которые определяют асимметрию веретена в C. elegans эмбриона, первое дробление трубочки зависит от количества центросомы.[16] Эмбрионы наследуют одну центросому, которая локализуется в предполагаемой более крупной цитоплазме CD-клеток и испускает радиальные микротрубочки во время анафазы, которые вносят вклад как в митотическое веретено, так и в кортикальные звездочки. Однако центр организации микротрубочек предполагаемых меньших AB клеток испускает только микротрубочки, которые фиксируются на митотическом веретене, а не связанные с кортикальным слоем звездочки. Когда эмбрионы сжимаются или деформируются, асимметричные веретена все еще образуются, и окрашивание на гамма-тубулин показывает, что второй центр организации микротрубочек лишен молекулярной сигнатуры центросомы. Кроме того, когда число центросом удваивается, трубочник эмбрионы расщепляются симметрично, указывая тем самым, что этот моноастральный механизм асимметричного деления клеток зависит от центросомы.[16]
- Helobdella robusta: пиявка Helobdella robusta демонстрирует такую же асимметрию в первом эмбриональном делении, как C. elegans и трубочник, но полагается на модифицированный механизм. Эксперименты по сжатию эмбриона робусты не влияют на асимметричное деление, предполагая, что механизм, подобный тубифексу, использует корковый независимый молекулярный путь. У робусты окрашивание антителом показывает, что митотическое веретено формируется симметрично до метафазы и происходит от двух биастральных центросом.[17] В начале метафазы асимметрия становится очевидной, поскольку центросома предполагаемой более крупной CD-клетки удлиняет корковые звездочки, в то время как звездочки предполагаемой меньшей AB-клетки становятся подавляющими. Эксперименты с использованием нокодазол и таксол поддерживают это наблюдение. Таксол, который стабилизировал микротрубочки, заставлял значительное количество эмбрионов симметрично расщепляться при использовании в умеренной концентрации. Более того, эмбрионы, обработанные нокодазолом, который секвестрирует димеры тубулина и способствует деполимеризации микротрубочек, аналогичным образом вызывают симметричное деление у значительного числа эмбрионов. Обработка любым из препаратов в этих концентрациях не нарушает нормальную динамику центросом, это указывает на то, что баланс полимеризации и деполимеризации микротрубочек представляет собой другой механизм установления асимметричного деления клеток в развитии спилярии.[17]
- Ilyanasa obsoleta: Третий, менее традиционный механизм, способствующий асимметричному делению клеток в спиральном развитии, был обнаружен у моллюска. Ильянаса обсолета. Гибридизация in situ и иммунофлуоресценция эксперименты показывают, что транскрипты мРНК локализуются совместно с центросомами во время раннего расщепления.[18] Следовательно, эти транскрипты стереотипно наследуются разным клеткам. Все отслеживаемые транскрипты мРНК участвуют в формировании паттерна оси тела, и гибридизация in situ для транскриптов, связанных с другими функциями, не демонстрирует такой локализации. Более того, нарушение полимеризации микротрубочек с помощью нокодазола и полимеризации актина с цитохализином B показывает, что цитоскелет также важен в этой асимметрии. Похоже, что микротрубочки необходимы для рекрутирования мРНК в центросому, а актин необходим для прикрепления центросомы к коре головного мозга. Наконец, введение нескольких центросом в одну клетку путем ингибирования цитокинеза показывает, что мРНК надежно локализуется на правильной центросоме, что указывает на внутренние различия между каждым центросомным составом. Важно отметить, что эти результаты отражают эксперименты, проведенные после первых двух делений, но все же демонстрируют различные молекулярные способы установления асимметрии в делящейся клетке.[18]
В стволовых клетках и предшественниках
Животные состоят из огромного числа различных типы клеток. Во время разработки зигота претерпевает множество клеточных делений, которые дают начало различным типам клеток, включая эмбриональные стволовые клетки. Асимметричные деления этих эмбриональных клеток дают начало одной клетке той же силы (самообновление), а другой может иметь такую же эффективность или стимулироваться для дальнейшей дифференцировки в специализированные типы клеток, такие как нейроны. Эта стимулированная дифференциация возникает из-за множества факторов, которые можно разделить на две широкие категории: внутренние и внешние. Внутренние факторы обычно включают разное количество детерминант клеточной судьбы, распределяемых в каждой дочерней клетке. Внешние факторы включают взаимодействия с соседними клетками, а также с микро- и макросредой клетки-предшественника.[19]
В дополнение к вышеупомянутому примеру нейронов дрозофилы было высказано предположение, что макросенсорные органы дрозофилы, в частности глиальные клетки, также возникают в результате аналогичного набора асимметричных делений из одной клетки-предшественника посредством регуляции Notch сигнальный путь и факторы транскрипции.[20]Примером того, как внешние факторы вызывают это явление, является физическое вытеснение одной из дочерних клеток из исходной ниши стволовых клеток, подвергая ее воздействию сигнальных молекул, таких как сульфат хондроитина.[21] Таким образом, дочерняя клетка вынуждена взаимодействовать с сильно сульфатированными молекулами, которые стимулируют ее дифференцировку, в то время как другая дочерняя клетка остается в исходной нише в состоянии покоя.
Роль в болезни
В нормальном стебле и прародитель клеток, асимметричное деление клеток уравновешивает пролиферацию и самообновление с клеточный цикл выход и дифференциация. Нарушение асимметричного деления клеток приводит к аберрантному самообновлению и ухудшению дифференциация, и поэтому может составлять ранний шаг в онкогенной трансформации стволовых клеток и клеток-предшественников. В нормальных неопухолевых стволовых клетках был описан ряд генов, отвечающих за плюрипотентность, например: Бми-1, Wnt и Notch. Эти гены были обнаружены также в случае раковых стволовых клеток и показывают, что их аберрантная экспрессия важна для образования массы опухолевых клеток.[22] Например, было показано, что рак желудочно-кишечного тракта содержат редкую субпопуляцию раковых стволовых клеток, которые способны асимметрично делиться. Асимметричное деление в этих клетках регулируется раковой нишей (микросредой) и путем Wnt. Блокирование пути Wnt с помощью IWP2 (антагониста WNT) или siRNA-TCF4 приводило к сильному подавлению асимметричного деления клеток.[23]
Другой мутация в асимметричных клеточных делениях, которые участвуют в росте опухоли, возникают мутации с потерей функции. Первое предположение о том, что потеря асимметричного деления клеток может быть вовлечена в онкогенез, было получено в результате исследований Дрозофила. Изучение мутаций потери функции в ключевых регуляторах асимметричного деления клеток, включая lgl, aurA, polo, numb и brat, выявило гиперпролиферативность. фенотипы на месте. У этих мутантов клетки делятся более симметрично и генерируют неправильно определенное потомство, которое не может выйти из клеточного цикла и дифференцироваться, а скорее непрерывно пролиферирует и формирует массу опухолевых клеток.[24]
Рекомендации
- ^ Моррисон, С. Дж .; Кимбл, Дж. (2006). «Асимметричные и симметричные деления стволовых клеток в развитии и раке» (PDF). Природа. 441 (7097): 1068–74. Дои:10.1038 / природа04956. PMID 16810241.
- ^ Хокинс, Нэнси; Гаррига, Джан (1998). «Асимметричное деление клеток: от А до Я». Genes Dev. 12 (23): 3625–38. Дои:10.1101 / gad.12.23.3625. PMID 9851969.
- ^ Генци П. и Роуз Л.С. Асимметричное деление клеток и формирование осей у эмбриона (15 октября 2005 г.), WormBook, ed. В C. elegans Исследовательское сообщество, WormBook, doi / 10.1895 / wormbook.1.30.1, [1]
- ^ Гольдштейн, Б., Хирд, С.Н. «Спецификация переднезадней оси у Caenorhabditis elegans». Development 1996. 122: 1467–74.
- ^ Коуэн, К; Хайман, А (2004). «Центросомы определяют полярность клеток независимо от сборки микротрубочек у эмбрионов C. elegans». Природа. 431 (7004): 92–96. Дои:10.1038 / природа02825. PMID 15343338.
- ^ O '; Коннелл, К. Максвелл; Уайт, Дж. (2000). «Ген spd-2 необходим для поляризации переднезадней оси и образования сперматозоидов в зиготе Caenorhabditis elegans». Биология развития. 222 (1): 55–70. Дои:10.1006 / dbio.2000.9714. PMID 10885746.
- ^ Хэмилл, ДР; Северсон, AF; Картер, JC; Бауэрман, Б. (2002). «Созревание центросом и сборка митотического веретена в C. elegans требуется SPD-5, белок с множественными доменами спиральной спирали ». Dev. Клетка. 3 (5): 673–84. Дои:10.1016 / с1534-5807 (02) 00327-1. PMID 12431374.
- ^ Sadler, PL; Встряхивает, округ Колумбия (2000). «Безъядерные сперматозоиды Caenorhabditis elegans могут ползать, оплодотворять ооциты и направлять передне-заднюю поляризацию одноклеточного эмбриона». Разработка. 127 (2): 355–66. PMID 10603352.
- ^ Щеки, RJ; Canman, JC; Габриэль, WN; Мейер, N; Стром, S; Гольдштейн, Б. (2004). "C. elegans Белки PAR функционируют за счет мобилизации и стабилизации асимметрично локализованных белковых комплексов ». Curr Biol. 14 (10): 851–62. Дои:10.1016 / j.cub.2004.05.022. PMID 15186741.
- ^ Генци П. и Роуз Л.С. Асимметричное деление клеток и формирование осей у эмбриона (15 октября 2005 г.), WormBook, ed. В C. elegans Исследовательское сообщество, WormBook, Дои:10.1895 / wormbook.1.30.1
- ^ Шнайдер, SQ; Бауэрман, Б. (2003). «Полярность клеток и цитоскелет в зиготе Caenorhabditis elegans». Анну Рев Жене. 37: 221–49. Дои:10.1146 / annurev.genet.37.110801.142443. PMID 14616061.
- ^ а б c d е Мацузаки, Ф (2000). «Асимметричное разделение Дрозофила нервные стволовые клетки: основа нейронного разнообразия ». Текущее мнение в нейробиологии. 10 (1): 38–44. Дои:10.1016 / s0959-4388 (99) 00052-5. PMID 10679433.
- ^ Го, М; Ян, LY; Ян, Ю.Н. (1996). «Контроль судьбы дочерних клеток при асимметричном делении: взаимодействие Numb и Notch». Нейрон. 17 (1): 27–41. Дои:10.1016 / s0896-6273 (00) 80278-0. PMID 8755476.
- ^ Икешима-Катаока, H; Скит, JB; Набешима, Y; Доу, CQ; Мацузаки, Ф (1997). "Миранда направляет Просперо в дочернюю камеру во время Дрозофила асимметричные деления ». Природа. 390 (6660): 625–29. Дои:10.1038/37641. PMID 9403694.
- ^ Генри, Джонатан Дж .; Мартиндейл, Марк К. (1999). «Сохранение и инновации в спиральном развитии». Гидробиология. 402: 255–65. Дои:10.1007/978-94-017-2887-4_15. ISBN 978-90-481-5340-4.
- ^ а б Shimizu, T .; и другие. (1998). «Неравное дробление в раннем эмбрионе Tubifex». Развивать. Разница в росте. 40 (3): 257–66. Дои:10.1046 / j.1440-169x.1998.00001.x.
- ^ а б Рен, Сяоюнь; Вайсблат, Дэвид А. (2006). «Асимметризация первого спайности при кратковременной разборке одной полюсной звездочки веретена у пиявки Helobdella robusta». Биология развития. 292 (1): 103–15. Дои:10.1016 / j.ydbio.2005.12.049. PMID 16458880.
- ^ а б Ламберт, Дж. Дэвид; Надь, Лиза М. (2002). «Асимметричное наследование мРНК, локализованных в центросомах во время эмбриональных дроблений». Природа. 420 (6916): 682–86. Дои:10.1038 / природа01241. PMID 12478296.
- ^ Ян Ю. Н. и Ян Л. Ю. (1998). «Асимметричное деление клеток». Природа. 392 (6678): 775–778. Дои:10.1038/33854. PMID 9572136.
- ^ Gho, M .; Bellaiche, Y .; Швайсгут, Ф. (1999). «Возвращаясь к клону микрохет Drosophila: новое по своей сути асимметричное деление клеток порождает глиальную клетку». Разработка. 126: 573–3584.
- ^ Hayes, A.J .; Tudor, D .; Nowell, M. A .; Caterson, B .; Хьюз, К. Э. (2008). «Мотивы сульфатирования хондроитина в качестве предполагаемых биомаркеров для выделения клеток-предшественников суставного хряща». J Histochem Cytochem. 56 (2): 125–138. Дои:10.1369 / jhc.7a7320.2007. ЧВК 2324172. PMID 17938280.
- ^ Гомес-Лопес, Сандра; Лернер, Робин Дж .; Петрич, Клаудия (2013). «Асимметричное деление стволовых клеток и клеток-предшественников при гомеостазе и раке». Клеточные и молекулярные науки о жизни. 71 (4): 575–97. Дои:10.1007 / s00018-013-1386-1. ЧВК 3901929. PMID 23771628.
- ^ Xin, H.W .; Ambe, C.M .; Ray, S .; Kim, B.K .; Коидзуми, Т .; Wiegand, G.W .; Hari, D .; Mullinax, J. E .; Jaiswal, K. R .; Garfield, S. H .; Стоядинович, А .; Rudloff, U .; Thorgeirsson, S. S .; Авиталь, И. (2013). «Wnt и раковая ниша: паракринные взаимодействия с клетками рака желудочно-кишечного тракта, претерпевающими асимметричное деление клеток». J Рак. 4 (6): 447–57. Дои:10.7150 / jca.6896. ЧВК 3726705. PMID 23901343.
- ^ Гонсалес, К. (2007). «Ориентация веретена, асимметричное деление и подавление опухоли в стволовых клетках дрозофилы». Нат Рев Жене. 8 (6): 462–72. Дои:10.1038 / nrg2103. PMID 17510666.
дальнейшее чтение
- Асимметричное деление клеток, Progress in Molecular and Subcellular Biology, volume 45, A. Macieira-Coelho, Editor. Springer Verlag, Берлин, Гейдельберг, Нью-Йорк (2007), ISBN 978-3-540-69160-0
