WikiDer > Боразин
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1,3,5,2,4,6-Триазатриборинан (только предварительно выбранный[1]) | |||
| Другие имена Циклотриборазанеборазол Неорганический бензол Боразол | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.169.303 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| B3ЧАС6N3 | |||
| Молярная масса | 80,50 г / моль | ||
| Внешность | Бесцветная жидкость | ||
| Плотность | 0,81 г / см3 | ||
| Температура плавления | -58 ° С (-72 ° F, 215 К) | ||
| Точка кипения | 53 ° C (127 ° F, 326 K) (55 ° C при 105 Па) | ||
| -49.6·10−6 см3/ моль | |||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Боразин, также известный как боразол, полярный неорганическое соединение с химическая формула B3ЧАС6N3. В этом циклическое соединение, чередуются три блока BH и три блока NH. Состав изоэлектронный и изоструктурный с бензол. По этой причине боразин иногда называют «неорганическим бензолом». Как и бензол, боразин - бесцветный жидкость.[2] Боразин - бесцветная жидкость с ароматным запахом.
Синтез
О соединении сообщили в 1926 году химики. Альфред Сток и Эрих Поланд по реакции диборан с аммиак.[3]
Боразин можно синтезировать путем лечения диборан и аммиак в соотношении 1: 2 при 250–300 ° С с преобразование 50%.
- 3 млрд2ЧАС6 + 6 NH3 → 2 млрд3ЧАС6N3 + 12 часов2
Альтернативный более эффективный маршрут начинается с борогидрид натрия и сульфат аммония:[4]
- 6 NaBH4 + 3 (NH4)2ТАК4 → 2 млрд3N3ЧАС6 + 3 Na2ТАК4 + 18 часов2
В двухэтапном процессе до боразина трихлорид бора сначала превращается в трихлорборазин:
- 3 BCl3 + 3 NH4Cl → Cl3B3ЧАС3N3 + 9 HCl
Связи B-Cl впоследствии конвертируются в связи B-H:
- 2 Cl3B3ЧАС3N3 + 6 NaBH4 → 2 млрд3ЧАС6N3 + 3 млрд2ЧАС6 + 6 NaCl
Структура
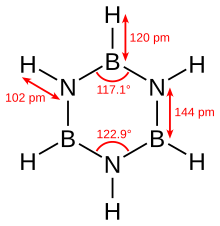
Боразин изоэлектронен с бензолом и имеет сходные связи, поэтому его иногда называют «неорганическим бензолом». Это сравнение не совсем корректно из-за электроотрицательность разница между бор и азот. Рентгеновский кристаллографический Структурные определения показывают, что длины связей в боразиновом кольце все эквивалентны при 1,429 Å, что характерно для бензола.[5] Однако кольцо из боразина не образует идеального шестиугольника. Валентный угол составляет 117,1 ° у атомов бора и 122,9 ° у атомов азота, что придает молекуле четкую симметрию.
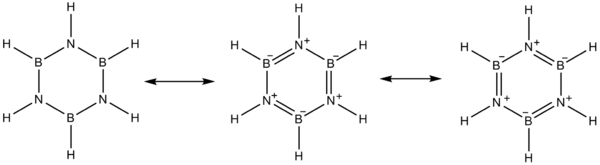
В электроотрицательность бора (2,04 по Шкала Полинга) по сравнению с азотом (3,04), а также дефицит электронов по бору атом и неподеленная пара на азоте выступает за альтернативу мезомер составы для боразина.
Бор ведет себя как Кислота Льюиса а азот ведет себя как База Льюиса.
Ароматичность
Из-за его сходства с бензолом был проведен ряд расчетных и экспериментальных анализов ароматичности боразина. Число пи-электронов в боразине подчиняется правилу 4n + 2, а длины связей B-N равны, что предполагает, что соединение может быть ароматическим. Разница в электроотрицательности между бором и азотом, однако, создает неравное распределение заряда, что приводит к связям с более сильным ионным характером, и, следовательно, ожидается, что он будет иметь более слабую делокализацию электронов, чем полностью углеродный аналог. Боразин, с стандартное изменение энтальпии образования ΔHж -531 кДж / моль, термически очень стабильна.
Орбитали естественной связи (NBO)
Natural Bond Orbital (NBO) анализ указывает на слабую ароматичность боразина.[6] В модели NBO связи B-N в кольце немного смещены от ядерных осей, а B и N имеют большие различия в заряде. Естественная химическая защита (NCS) анализ предоставляет некоторые дополнительные доказательства ароматичности, основанные на вкладе π-связи B-N в магнитное экранирование. Расчеты, основанные на орбиталях NBO, показывают, что эта π-связь допускает слабый кольцевой ток, который несколько противодействует магнитному полю, моделируемому в центре боразинового кольца. Небольшой кольцевой ток предполагает некоторую делокализацию.
Функция электронной локализации (ELF)
Топологический анализ связи в боразине Функция локализации электронов (ELF) указывает, что боразин может быть описан как π ароматическое соединение. Однако связь в боразине менее делокализована, чем в бензоле, из-за разницы в значениях бифуркации электронных бассейнов. Большие значения бифуркации указывают на лучшую делокализацию электронов, и утверждается, что, когда это значение бифуркации больше, чем 0,70, делокализации достаточно для обозначения соединения ароматического соединения.[7] Для бензола это значение составляет 0,91, но π-система боразина разветвляется при значении ELF 0,682.[8] Это вызвано разницей в электроотрицательности между B и N, что приводит к более слабому взаимодействию связей, чем взаимодействие C-C в бензоле, что приводит к повышенной локализации электронов на звеньях B-H и N-H. Значение бифуркации немного ниже предела 0,70, что предполагает умеренную ароматичность.
Реактивность
Гидролиз
en.
Полимеризация
Нагревание боразина до 70 ° C вытесняет водород с образованием полиборазилена:
- п Б3N3ЧАС6 → 1 / n [B3N3ЧАС4]п
С галогенидами водорода и галогенами
С хлористый водород это формирует аддукт.
- B3N3ЧАС6 + 3 HCl → B3N3ЧАС9Cl3
- Реакция присоединения боразина к хлористому водороду
- B3N3ЧАС9Cl3 + NaBH4 → (BH4N)3
- Снижение с борогидрид натрия
Реакция присоединения с бром не требует катализатор. Боразины подвергаются нуклеофильный атаковать бор и электрофильный атака азотом.
Керамический прекурсор
Нитрид бора может быть получен нагреванием полиборазилена до 1000 ° C.[4]
Боразины также являются исходным материалом для других потенциальных керамик, таких как карбонитриды бора. Боразин также можно использовать в качестве прекурсора для выращивания гаксагональный нитрид бора (h-BN) тонкие пленки и отдельные слои на каталитических поверхностях, таких как медь,[9] платина,[10] никель[11] утюг[12] и многое другое, с химическое осаждение из паровой фазы (CVD).
Полиборазилен был предложен как переработанный хранение водорода среда для водородный топливный элемент применения в транспортных средствах с использованием процесса «единого котла» для разложения и восстановления для воссоздания борана аммиака.[13]
Среди других соединений типа B-N было предсказано, что смешанные амино-нитрозамещенные боразины превосходят взрывчатые вещества на основе углерода, такие как CL-20.[14][15]
Родственные соединения
(C
2ЧАС
2B
2N
2) представляет собой шестичленное ароматическое кольцо с двумя атомами углерода, двумя атомами азота и двумя атомами бора в противоположных парах.[16][17]
1,2-дигидро-1,2-азаборин (C
4BNH
6) представляет собой шестичленное кольцо с четырьмя атомами углерода, одним атомом азота и одним атомом бора.
Рекомендации
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 968. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Дувард Шрайвер; Питер Аткинс (2010). Неорганическая химия (Пятое изд.). Нью-Йорк: В. Х. Фриман и компания. п. 328. ISBN 978-1429218207.
- ^ Stock A, Pohland E (октябрь 1926 г.). "Borwasserstoffe, VIII. Zur Kenntnis des B2ЧАС6 унд des B5ЧАС11"[Раствор борной кислоты, VIII Относительно знания B2ЧАС6 и B5ЧАС11]. Берихте (на немецком). 59 (9): 2210–2215. Дои:10.1002 / cber.19260590906.
- ^ а б Уайдман, Томас; Fazen, Paul J .; Линч, Энн Т .; Су, Кай; Ремсен, Эдвард Э .; Снеддон, Ларри Г. (1998). «Боразин, полиборазилен, β-винилборазин и поли (β-винилборазин)». Неорганические синтезы. 32. Дои:10.1002 / 9780470132630.ch39.
- ^ Бозе Р., Маулитц А.Х., Стеллберг П. (1994). «Твердотельный боразин: заслуживает ли он названия« неорганический бензол »?». Chemische Berichte. 127 (10): 1887–1889. Дои:10.1002 / cber.19941271011.
- ^ Шен В., Ли М., Ли Ф, Ван С. (2007). «Теоретическое исследование боразина и его производных». Неорг. Чим. Acta. 360 (2): 619–624. Дои:10.1016 / j.ica.2006.08.028.
- ^ Сантос Дж. К., Тизнадо В., Контрерас Р., Фуэнтеалба П. (январь 2004 г.). «Сигма-пи разделение функции локализации электронов и ароматичности». Журнал химической физики. 120 (4): 1670–3. Bibcode:2004ЖЧФ.120.1670С. Дои:10.1063/1.1635799. PMID 15268298.
- ^ Ислас Р., Чаморро Э, Роблес Дж., Хайне Т., Сантос Дж. К., Мерино Дж. (2007). «Боразин: быть или не быть ароматным». Struct. Chem. 18 (6): 833–839. Дои:10.1007 / s11224-007-9229-z. S2CID 95098134.
- ^ Kidambi PR, Blume R, Kling J, Wagner JB, Baehtz C, Weatherup RS и др. (Ноябрь 2014 г.). «Наблюдения in situ при химическом осаждении гексагонального нитрида бора из паровой фазы на поликристаллическую медь». Химия материалов. 26 (22): 6380–6392. Дои:10,1021 / см 502603n. ЧВК 4311958. PMID 25673919.
- ^ Kim G, Jang AR, Jeong HY, Lee Z, Kang DJ, Shin HS (апрель 2013 г.). «Выращивание высококристаллического однослойного гексагонального нитрида бора на повторно используемой платиновой фольге». Нано буквы. 13 (4): 1834–9. Bibcode:2013NanoL..13.1834K. Дои:10.1021 / nl400559s. PMID 23527543.
- ^ Чаттерджи С., Луо З., Асерс М., Йейтс Д.М., Джонсон А.Т., Снеддон Л.Г. (2011-10-25). "Химическое осаждение из паровой фазы нанолистов нитрида бора на металлические подложки посредством реакций декаборана / аммиака". Химия материалов. 23 (20): 4414–4416. Дои:10,1021 / см201955v. ISSN 0897-4756.
- ^ Caneva S, Weatherup RS, Bayer BC, Brennan B, Spencer SJ, Mingard K и др. (Март 2015 г.). «Контроль зарождения больших монокристаллических доменов монослойного гексагонального нитрида бора с помощью катализаторов Fe, легированных кремнием». Нано буквы. 15 (3): 1867–75. Bibcode:2015NanoL..15.1867C. Дои:10.1021 / nl5046632. ЧВК 4358078. PMID 25664483.
- ^ Дэвис Б.Л., Диксон Д.А., Гарнер Е.Б., Гордон Дж. К., Матус М. Х., Скотт Б., Стивенс Ф. Х. (2009). «Эффективная регенерация частично отработанного аммиачно-боранового топлива». Angewandte Chemie. 48 (37): 6812–6. Дои:10.1002 / anie.200900680. OSTI 960522. PMID 19514023.
- ^ Koch EC, Klapötke TM (2012). «Бризантные взрывчатые вещества на основе бора». Топливо, взрывчатые вещества, пиротехника. 37 (3): 335–344. Дои:10.1002 / преп.201100157.
- ^ Кервин С., Фенвик О., Ди Стасио Ф., Шин Ю.С., Воутерс Дж., Аккорси Дж. И др. (Июнь 2013). «Полиморфизм, флуоресценция и оптоэлектронные свойства производного боразина». Химия. 19 (24): 7771–9. Дои:10.1002 / chem.201204598. PMID 23616404. S2CID 9774352.
- ^ Шривастава А.К., Мисра Н. (2015). «Представление« карборазина »как нового гетероциклического ароматического соединения». Новый журнал химии. 39 (4): 2483–2488. Дои:10.1039 / c4nj02089h. S2CID 94792421.
- ^ Бонифази Д., Фазано Ф., Лоренцо-Гарсия М. М., Маринелли Д., Убаха Х., Тассерул Дж. (Октябрь 2015 г.). «Каркасы из углерода, легированного бором и азотом: органическая химия, самосборка и применение боразина и его производных в материалах». Химические коммуникации. 51 (83): 15222–36. Дои:10.1039 / C5CC06611E. PMID 26411675.
дальнейшее чтение
- Снеддон Л.Г., Мирабелли М.Г., Линч А.Т., Фазен П.Дж., Су К., Бек Дж.С. (1991). «Полимерные прекурсоры керамики на основе бора» (PDF). Pure Appl. Chem. 63 (3): 407–410. Дои:10.1351 / pac199163030407. S2CID 53629042.
- Чон Дж. К., Учимару Й, Ким Д. П. (август 2004 г.). «Синтез новой аморфной керамики карбонитрида бора из сополимера производного боразина посредством гидроборирования». Неорганическая химия. 43 (16): 4796–8. Дои:10.1021 / ic035254a. PMID 15285647.
- Паецольд П. (1991). «Новые перспективы в борно-азотной химии - I» (PDF). Pure Appl. Chem. 63 (3): 345–350. Дои:10.1351 / pac199163030345. S2CID 53659373.
- Ислас Р. (2007). «Боразин: быть или не быть ароматным». Структурная химия. 18 (6): 833–839. Дои:10.1007 / s11224-007-9229-z. S2CID 95098134.
внешняя ссылка
![]() СМИ, связанные с боразин в Wikimedia Commons
СМИ, связанные с боразин в Wikimedia Commons