WikiDer > Онкологический синдром

А онкологический синдром, или же синдром семейного рака, является генетическим заболеванием, при котором наследуется генетические мутации в одном или нескольких гены предрасполагают пораженных людей к развитию рака, а также могут вызывать их раннее начало. Раковые синдромы часто проявляются не только высоким риск жизни развития рака, но также и развития множественных независимых первичных опухолей.[1]
Многие из этих синдромов вызваны мутациями в гены-супрессоры опухолей, гены, которые участвуют в защите клетки от злокачественной опухоли. Другие гены, которые могут быть затронуты: Ремонт ДНК гены онкогены и гены, участвующие в производстве кровеносных сосудов (ангиогенез).[2] Типичные примеры наследственных онкологических синдромов: синдром наследственного рака груди-яичников и наследственный неполипозный рак толстой кишки (Синдром Линча).[3][4]
Фон
Синдромы наследственного рака лежат в основе от 5 до 10% всех видов рака, и существует более 50 идентифицируемых наследственных форм рака.[5] Научное понимание синдромов предрасположенности к раку активно расширяется: обнаруживаются дополнительные синдромы,[6] лежащая в основе биология становится более ясной, а коммерциализация методологии диагностической генетики улучшает клинический доступ.[нужна цитата] Учитывая распространенность рака груди и толстой кишки, наиболее широко известные синдромы включают: синдром наследственного рака груди-яичников и наследственный неполипозный рак толстой кишки (Синдром Линча).[6]
Некоторые редкие виды рака тесно связаны с синдромами наследственной предрасположенности к раку. Генетическое тестирование следует рассматривать с адренокортикальная карцинома; карциноидные опухоли; размытый рак желудка; маточная труба / первичная рак брюшины; лейомиосаркома; медуллярный рак щитовидной железы; параганглиома/феохромоцитома; почечно-клеточная карцинома хромофобной, гибридной онкоцитарной или онкоцитома гистология; сальная карцинома; и опухоли полового канатика с кольцевыми канальцами.[6] Врачи первичного звена может идентифицировать людей, которые подвержены риску развития синдрома наследственного рака.[7]
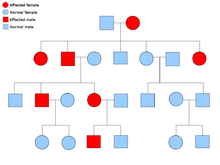
Генетика рака
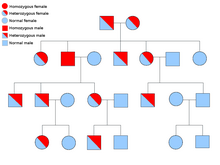
Две копии каждого гена присутствуют во всех клетках тела, и каждая из них называется аллель. Большинство онкологических синдромов передаются через менделевский аутосомно-доминантный манера. В этих случаях, чтобы человек имел предрасположенность к раку, должен присутствовать только один дефектный аллель. Лица с одним нормальным аллелем и одним ошибочным аллелем известны как гетерозиготный. Гетерозиготный человек и человек с двумя нормальными аллелями (гомозиготный) будет иметь 50% шанс произвести на свет пораженного ребенка.[8] Мутация унаследованного гена известна как мутация зародышевой линии и дальнейшая мутация нормального аллеля приводит к развитию рака. Это известно как Гипотеза Кнудсона о двух ударах, где первое попадание гена - это унаследованная мутация, а второе попадание происходит в более позднем возрасте.[2] Поскольку необходимо мутировать только один аллель (по сравнению с обоими в так называемых «спорадических раковых заболеваниях»), индивидуум имеет более высокий шанс развития рака, чем население в целом.[нужна цитата]
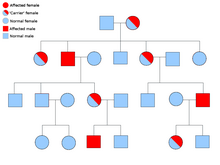
Реже синдромы могут передаваться как аутосомно-рецессивный черта. Оба аллеля гена должны быть мутированы при аутосомно-рецессивных заболеваниях, чтобы у человека была предрасположенность к раку. Человек с двумя рецессивными аллелями известен как гомозиготный рецессивный. У обоих родителей должен быть хотя бы один дефектный аллель, чтобы ребенок был гомозиготным рецессивным. Если у обоих родителей есть один мутантный аллель и один нормальный аллель (гетерозиготный), то у них есть 25% шанс произвести гомозиготного рецессивного ребенка (имеет предрасположенность), 50% шанс произвести гетерозиготного ребенка (носитель дефектного гена) и 25% шанс произвести ребенка с двумя нормальными аллелями.[8]
Примеры синдромов аутосомно-доминантного рака: аутоиммунный лимфопролиферативный синдром (Синдром Канале-Смита), Синдром Беквита – Видемана (хотя 85% случаев носят спорадический характер),[нужна цитата] Синдром Бирта – Хогга – Дюбе, Синдром Карни, семейный хордома, Синдром Каудена, синдром диспластического невуса с семейной меланомой, семейный аденоматозный полипоз, синдром наследственного рака груди и яичников, наследственно диффузный рак желудка (HDGC), Наследственный неполипозный колоректальный рак (Синдром Линча), Синдром Хауэла – Эванса рака пищевода с тилозом, синдром ювенильного полипоза, Синдром Ли – Фраумени, множественная эндокринная неоплазия тип 1/2, множественный остеохондроматоз, нейрофиброматоз тип 1/2, синдром невоидной базальноклеточной карциномы (Синдром Горлина), Синдром Пейтца-Егерса, семейный рак простаты, наследственный лейомиоматоз почечно-клеточный рак (LRCC), наследственный папиллярный почечно-клеточный рак, наследственный параганглиома-синдром феохромоцитомы, ретинобластома, туберозный склероз, болезнь фон Гиппеля – Линдау и Опухоль Вильма.[9]
Примеры синдромов аутосомно-рецессивного рака: атаксия – телеангиэктазия, Синдром Блума, Анемия Фанкони, MUTYH-ассоциированный полипоз, Синдром Ротмунда-Томсона, Синдром Вернера и Пигментная ксеродермия.[9]
Примеры
Хотя онкологические синдромы демонстрируют повышенный риск рака, риск варьируется. Для некоторых из этих заболеваний рак не является их основным признаком. Обсуждение здесь сосредоточено на их связи с повышенным риском рака. Этот список далеко не исчерпывающий.
Анемия Фанкони
Анемия Фанкони это расстройство с широким клиническим спектром, включая: раннее начало и повышенный риск рака; недостаточность костного мозга; и врожденные аномалии. Наиболее заметные проявления этого расстройства связаны с гемопоэз (производство крови Костный мозг); к ним относятся апластическая анемия, миелодиспластический синдром и острый миелоидный лейкоз. Опухоли печени и плоскоклеточный рак из пищевод, ротоглотка и язычок солидные опухоли, обычно связанные с ФА. Врожденные аномалии включают: аномалии скелета (особенно те, которые затрагивают руки), кафе с молоком и гипопигментация. На сегодняшний день известны гены, вызывающие ФА: ФАНКА, FANCB, FANCC, FANCD2, ФАНСА, FANCF, FANCG, FANCI, FANCJ, FANCL, FANCM, FANCN, ФАНКО, FANCP и BRCA2 (ранее известный как FANCD1). Наследование этого синдрома в первую очередь аутосомно-рецессивный, но FANCB может быть унаследован от материнского или отцовского х-хромосома (x-сцепленное рецессивное наследование). Путь FA участвует в репарации ДНК, когда две цепи ДНК неправильно соединены вместе (межнитевые сшивки). Многие пути координируются для этого путем FA, включая эксцизионная репарация нуклеотидов, транслезионный синтез и гомологичная рекомбинация.[10][11][12][13][14]
Семейный аденоматозный полипоз
Семейный аденоматозный полипоз (FAP) - это аутосомно-доминантный синдром, который значительно увеличивает риск колоректальный рак. Примерно 1 из 8000 человек болеет этим заболеванием, и у него примерно 100% пенетрантность. Человек с этим заболеванием будет иметь от сотен до тысяч доброкачественный аденомы на протяжении всего их двоеточие, который в большинстве случаев прогрессирует до рака. Другие опухоли с повышенной частотой включают; остеомы, надпочечники аденомы и карциномы, опухоли щитовидной железы и десмоидные опухоли. Причина этого расстройства - мутировавший Ген APC, который участвует в β-катенин регулирование. Неисправный APC заставляет β-катенин накапливаться в клетках и активировать факторы транскрипции участвует в распространение клеток, миграция, дифференциация и апоптоз (запрограммированная гибель клеток).[15][16][17]
Наследственный рак груди и яичников
Синдром наследственного рака груди и яичников является аутосомно-доминантный генетическое расстройство вызванный генетические мутации из BRCA1 и BRCA2 гены. У женщин это заболевание в первую очередь увеличивает риск грудь и рак яичников, но также увеличивает риск карцинома фаллопиевых труб и папиллярная серозная карцинома брюшины. У мужчин риск рак простаты увеличена. Другие виды рака, которые непоследовательно связаны с этим синдромом: панкреатический рак, рак груди у мужчин, колоректальный рак и рак матка и шейка матки. Генетические мутации составляют примерно 7% и 14% рака груди и яичников, соответственно, а BRCA1 и BRCA2 составляют 80% этих случаев. BRCA1 и BRCA2 оба являются гены-супрессоры опухолей участвует в поддержании и восстановлении ДНК, что, в свою очередь, приводит к нестабильности генома. Мутации в этих генах приводят к дальнейшему повреждению ДНК, что может привести к раку.[18][19]
Наследственный неполипозный рак толстой кишки
Наследственный неполипозный рак толстой кишки, также известный как синдром Линча, аутосомно-доминантный онкологический синдром, повышающий риск развития колоректального рака. Это вызвано генетическими мутациями в Ремонт несоответствия ДНК (MMR) гены, особенно MLH1, MSH2, MSH6 и PMS2. Помимо колоректального рака, частота многих других видов рака увеличивается. К ним относятся; рак эндометрия, рак желудка, рак яичников, рак тонкой кишки и панкреатический рак. Наследственный неполипозный рак толстой кишки также связан с ранним началом колоректального рака. Гены MMR участвуют в восстановлении ДНК, когда базы на каждой нити ДНК не совпадают. Дефектные гены MMR позволяют вставка и удаление мутации в областях ДНК, известных как микроспутники. Эти короткие повторяющиеся последовательности ДНК становятся нестабильными, что приводит к состоянию микроспутниковая нестабильность (MSI). Мутировавшие микросателлиты часто обнаруживаются в генах, участвующих в инициации и прогрессировании опухоли, и MSI может увеличить выживаемость клеток, что приводит к раку.[4][20][21][22]
Наследственный синдром параганглиомы-феохромоцитомы
Большинство случаев семейной параганглиомы вызвано мутациями в сукцинатдегидрогеназа (сукцинат: убихинон оксидоредуктаза) субъединичные гены (SDHD, SDHAF2, SDHC, SDHB).
PGL-1 связан с мутацией SDHD, и большинство людей с PGL-1 с параганглиомой поражали отцов, а не матерей. PGL1 и PGL2 являются аутосомно-доминантными с печать. PGL-4 связан с мутацией SDHB и связан с более высоким риском феохромоцитомы, а также почечно-клеточного рака и немедуллярного рака щитовидной железы.[23]
Синдром Ли-Фраумени
Синдром Ли-Фраумени является аутосомно-доминантный синдром, в первую очередь вызванный мутации в Ген TP53, что значительно увеличивает риск многих видов рака, а также тесно связано с ранним началом этих видов рака. Раки, связанные с этим расстройством, включают: саркомы мягких тканей (часто встречается в детстве), остеосаркома, рак молочной железы, рак мозга, лейкемия и адренокортикальная карцинома. Люди с синдромом Ли-Фраумени часто страдают множественными независимыми первичными формами рака. Причина широкого клинического спектра этого расстройства может быть связана с мутациями других генов, которые модифицируют болезнь. Белок, продуцируемый геном TP53, p53, участвует в остановка клеточного цикла, Ремонт ДНК и апоптоз. Дефектный p53 может быть не в состоянии должным образом выполнять эти процессы, что может быть причиной образования опухоли. Поскольку только 60-80% людей с этим заболеванием имеют обнаруживаемые мутации в TP53, другие мутации в пути p53 могут быть вовлечены в синдром Ли-Фраумени.[24][25][26][27]
MUTYH-ассоциированный полипоз
MUTYH-ассоциированный полипоз по большей части имеет общие клинические признаки с FAP; разница в том, что это аутосомно-рецессивный расстройство, вызванное мутациями в МУТЫХ Ремонт ДНК ген. Опухоли с повышенным риском этого заболевания - это рак прямой кишки, аденомы желудка и аденомы двенадцатиперстной кишки.[15][28]

Синдром невоидной базальноклеточной карциномы
Синдром невоидной базальноклеточной карциномы, также известный как синдром Горлина, аутосомно-доминантный онкологический синдром, при котором риск базально-клеточная карцинома очень высокий. Заболевание характеризуется: базальная клетка невусы, челюсть кератоцисты и аномалии скелета. Оценки распространенности синдрома невоидной базальноклеточной карциномы варьируются, но составляют примерно 1 на 60000. Наличие базальноклеточной карциномы намного выше у белых, чем у чернокожих людей; 80% и 38% соответственно. Одонтогенные кератоцисты обнаруживаются примерно у 75% людей с этим заболеванием и часто возникают в раннем возрасте. Наиболее частые аномалии скелета возникают на голове и лице, но часто страдают и другие области, например, грудная клетка. Причинная генетическая мутация этого заболевания возникает в Ген PTCH, а продукт ПТЧ - подавитель опухолей участвует в клеточная сигнализация. Хотя точная роль этого белка в синдроме невоидной базальноклеточной карциномы неизвестна, он участвует в сигнальный путь ежа, заведомо контролирующий рост клеток и развитие.[29][30]
Болезнь фон Гиппеля – Линдау
Болезнь фон Гиппеля – Линдау это редкое аутосомно-доминантное генетическое заболевание, которое предрасполагает людей к доброкачественным и злокачественным опухолям. Наиболее распространенными опухолями при болезни Фон Гиппеля-Линдау являются гемангиобластомы центральной нервной системы и сетчатки, светлоклеточные карциномы почек, феохромоцитомы, нейроэндокринные опухоли поджелудочной железы, кисты поджелудочной железы, опухоли эндолимфатического мешка и папиллярные цистаденомы придатка яичка.[31][32] Болезнь фон Хиппеля-Линдау возникает в результате мутации гена-супрессора опухоли фон Хиппеля-Линдау на хромосоме 3p25.3.[33]
Пигментная ксеродермия
Пигментная ксеродермия является аутосомно-рецессивный расстройство, характеризующееся чувствительностью к ультрафиолетовый (УФ) свет, значительно повышенный риск солнечный ожог и повышенный риск рак кожи. Риск рака кожи более чем в 10000 раз выше, чем у нормальных людей, и включает многие типы рака кожи, в том числе меланома и немеланомный рак кожи. Кроме того, открытые солнцу участки языка, губ и глаз имеют повышенный риск развития рака. Пигментная ксеродермия может быть связана с другими видами рака внутренних органов и доброкачественными опухолями.[нужна цитата] Помимо рака, некоторые генетические мутации которые вызывают пигментную ксеродермию, связаны с нейродегенерация. Пигментная ксеродермия может быть вызвана генетическими мутациями в 8 генах, которые вызывают следующие ферменты: XPA, XPB, XPC, XPD, XPE, XPF, XPG и Pol η. XPA-XPF являются эксцизионная репарация нуклеотидов ферменты, которые восстанавливают поврежденную УФ-светом ДНК и дефектные белки, позволяют накапливать мутации, вызванные УФ-светом. Pol η является полимераза, который является ферментом, участвующим в репликации ДНК. Существует много полимераз, но pol η - это фермент, который реплицирует ДНК, поврежденную УФ-светом. Мутации в этом гене будут производить неисправный фермент pol η, который не может реплицировать ДНК при повреждении УФ-светом. У лиц с мутациями этого гена есть подмножество XP; ХР-вариантная болезнь.[34][35]
Дефекты репарации ДНК и повышенный риск рака
Многие синдромы рака возникают из-за наследственных нарушений Ремонт ДНК возможности.[нужна цитата] Когда унаследованный мутация присутствует в гене репарации ДНК, ген репарации либо не экспрессируется, либо экспрессируется в измененной форме. Тогда функция репарации, вероятно, будет недостаточной, и, как следствие, будут накапливаться повреждения ДНК. Такие повреждения ДНК могут вызвать ошибки во время Синтез ДНК приводящие к мутациям, некоторые из которых могут вызвать рак. Мутации репарации ДНК зародышевой линии, повышающие риск рака, перечислены в таблице.
| Ген восстановления ДНК | Протеин | Затронутые пути ремонта * | Раки с повышенным риском |
|---|---|---|---|
| атаксия, телеангиэктазия, мутировавшая | Банкомат | Различные мутации в Банкомат уменьшать HRR, SSA или же NHEJ [36] | лейкемия, лимфома, грудь [36][37] |
| Синдром Блума | BLM (геликаза) | HRR [38] | лейкоз, лимфома, толстая кишка, грудь, кожа, легкое, слуховой проход, язык, пищевод, желудок, миндалины, гортань, матка [39] |
| рак груди 1 и 2 | BRCA1 BRCA2 | HRR двойных разрывов нитей и разрывов дочерних нитей[40] | грудь, яичник [41] |
| Анемия Фанкони гены FANCA, B, C, D1, D2, E, F, G, I, J, L, M, N, O, P | FANCA и др. | HRR и TLS [42] | лейкемия, опухоли печени, солидные опухоли многих областей [43] |
| Наследственный неполипозный колоректальный рак гены MSH2 MSH6 MLH1 PMS2 | MSH2 MSH6 MLH1 PMS2 | MMR [44] | колоректальный, эндометриальный, яичниковый, желудочно-кишечный тракт (желудок и тонкий кишечник, поджелудочная железа, желчевыводящие пути), мочевыводящие пути, мозг (глиобластомы) и кожа (кератоакантомы и сальные аденомы) [45] |
| Синдром Ли-Фраумени ген TP53 | P53 | Прямая роль в HRR, BER, NER и действует в ответ на повреждение ДНК[46] для этих путей и для NHEJ и MMR [47] | саркомы, рак груди, опухоли головного мозга и карциномы коры надпочечников [48] |
| MRE11A | MRE11 | HRR и NHEJ [49] | грудь [50] |
| МУТЫХ | MUTYH гликозилаза | BER из А в паре с 8-оксо-dG [51] | колоректальный, двенадцатиперстный, рак яичников, мочевого пузыря и кожи [52] |
| Синдром перелома Неймегена | NBS (NBN) | NHEJ [53] | лимфоидный рак [53] |
| NTHL1 | NTHL1 | BER для Tg, FapyG, 5-hC, 5-hU в дцДНК[54] | Рак толстой кишки, рак эндометрия, рак двенадцатиперстной кишки, базально-клеточная карцинома[55] |
| RECQL4 | RECQ4 | Геликаза, вероятно, активна в HRR [56] | базально-клеточная карцинома, плоскоклеточная карцинома, внутриэпидермальная карцинома [57] |
| Синдром Вернера ген WRN | Синдром Вернера АТФ-зависимая геликаза | HRR, NHEJ, длинный патч BER [58] | саркома мягких тканей, колоректальный, кожа, щитовидная железа, поджелудочная железа [59] |
| Пигментная ксеродермия гены XPA, XPB, XPD, XPF, XPG | XPA XPB XPD XPF XPG | Транскрипционный спаренный NER ремонтирует записано нити транскрипционно активных генов [60] | рак кожи (меланома и немеланома) [60] |
| Пигментная ксеродермия гены XPC, XPE (DDB2) | XPC, XPE | Глобальный геномный NER, восстанавливает повреждения как в транскрибированной, так и в нетранскрибированной ДНК [61][62] | рак кожи (меланома и немеланома) [61][62] |
| XPV (также называемая полимеразой H) | ДНК-полимераза эта (Pol η) | Транслезионный синтез (TLS) [63] | рак кожи (базально-клеточный, плоскоклеточный, меланома) [63] |
- Акронимы для путей репарации ДНК - HRR. гомологичный рекомбинационный ремонт, ССА суб-путь HRR, NHEJ негомологичное соединение концов, BER базовая эксцизионная пластика, TLS транслезионный синтез, NER эксцизионная репарация нуклеотидов, MMR ремонт несоответствия.
Генетический скрининг
Генетическое тестирование может использоваться для идентификации мутировавшие гены или хромосомы которые передаются из поколения в поколение. Люди с положительным результатом теста на наличие генетической мутации не обязательно обречены на развитие рака, связанного с этой мутацией, однако они обладают повышенным риском развития рака по сравнению с населением в целом. Людям рекомендуется пройти генетический тест, если их семья история болезни включает: несколько членов семьи, больных раком, кого-то в семье, кто заболел раком в особенно молодом возрасте или был частью определенного этническая группа.[64]
Процесс генетического скрининга - это простая неинвазивная процедура. Однако до того, как гены будут проверены на мутации, пациент обычно должен обратиться к врачу и пройти индивидуальный осмотр. консультация, где они обсуждают как личный, так и семейный анамнез рака. Затем медицинский работник может оценить вероятность наличия у пациента мутации и провести его через процесс генетического скрининга.[65] Важно, чтобы эта консультация проводилась, поскольку она гарантирует, что человек дает информированное согласие на участие в генетическом тестировании, осведомлен и понимает этапы, преимущества и ограничения процедуры и лучше осведомлен о последствиях результатов проверки слуха.[66] Тест можно выполнить с помощью телесные жидкости или же клетки пациента, это включает; кровь (которая является наиболее распространенной), слюна, околоплодные воды и даже клетки изо рта, полученные из буккальный мазок. Затем этот материал отправляется в специализированную генетическую лабораторию, где его исследуют техники, результаты теста отправляются обратно поставщику здравоохранения, который запросил анализ, и результаты обсуждаются с пациентом.[64]
Непосредственное тестирование потребителя можно провести без медицинского персонала, но оно не рекомендуется, поскольку потребитель теряет возможность обсудить свое решение с образованным специалистом.[67] По данным Национальной медицинской библиотеки США, генетическое тестирование в Америке стоит от 100 до 2000 долларов в зависимости от типа и сложности теста.[68]
Профилактические мероприятия
Генетическое тестирование важно, так как если результат теста окажется положительным, они лучше осведомлены о собственном здоровье и здоровье ближайших членов семьи.[69] С помощью и советом медицинского работника они могут предпринять шаги для снижения повышенного риска развития рака за счет:
- Регулярное упражнение
- Здоровая сбалансированная диета
- Поддержание здорового веса
- Не курить
- Оставаясь в безопасности под вредные солнечные лучи [70]
Есть и другие формы превентивных действий, например, Наследственный рак груди и яичников предстоит пройти операцию: A гистерэктомия удаление всех или некоторых из матка, тогда как мастэктомия удаляет грудь (двойная мастэктомия означает, что обе груди удалены), это часто может добавить годы к их продолжительность жизни.[71] Еще одна профилактическая мера - регулярная скрининг рака и обследования. Если у человека Синдром Линча тогда у них должен быть регулярный колоноскопия Чтобы проверить, есть ли какие-либо изменения в клетках, выстилающих стенку кишечника, было доказано, что регулярные осмотры увеличивают продолжительность жизни человека, страдающего синдромом Линча, в среднем на 7 лет, поскольку раннее выявление означает правильные профилактические меры и хирургическое вмешательство можно принять быстрее.[72] Регулярное обследование груди также рекомендуется женщинам с диагнозом BRCA мутацииКроме того, недавние исследования показывают, что мужчины с повышенным риском развития рак простаты из-за мутаций BRCA может снизить их риск, принимая аспирин.[73] Аспирин очень полезен в снижении распространенности рака; тем не менее, для получения эффекта его необходимо принимать регулярно, по крайней мере, в течение пяти лет.[74]
Распространенность генетических мутаций у разных этнических групп
Часто генетические мутации более распространены в определенных этнических группах, это связано с тем, что раса может отслеживать своих предков до одного географического местоположения, мутировавшие гены затем передаются от предков через поколения, поэтому некоторые этнические группы более восприимчивы к мутациям, что увеличивает их шансы заболеть раком [61]. Как упоминалось выше, это может быть полезно, поскольку может помочь медицинским работникам оценить риск мутации у пациента до того, как он пройдет тестирование.[65] Синдром Вернера имеет распространенность 1 на 200 000 живорождений в США, но в Японии он поражает 1 из 20 000-40 000 случаев.[75]1 из 40 Евреи ашкенази имеют мутацию BRCA, это сильно отличается от общей популяции в Соединенных Штатах, где страдает 1 из 400 человек. Евреи-ашкенази подвержены высокому риску развития наследственного рака груди и яичников, и им рекомендуется пройти как генетическое тестирование, чтобы узнать, есть ли у них мутации, так и регулярный скрининг на рак.[76]
Рекомендации
- ^ Аллгайер, Хайке; Редхер, Хельга; Фульда, Симона (2009). Наследственные опухоли: от генов к клиническим последствиям. Вайнхайм: Wiley-VCH. ISBN 9783527320288.
- ^ а б Ходжсон С (январь 2008 г.). «Механизмы наследственной предрасположенности к раку». J Zhejiang Univ Sci B. 9 (1): 1–4. Дои:10.1631 / jzus.B073001. ЧВК 2170461. PMID 18196605.
- ^ Кларк А.С., Домчек С.М. (Апрель 2011 г.). «Клиническое лечение наследственных синдромов рака груди». J Mammary Gland Biol Неоплазия. 16 (1): 17–25. Дои:10.1007 / s10911-011-9200-х. PMID 21360002.
- ^ а б Линч Х.Т., Линч П.М., Ланспа С.Дж., Снайдер К.Л., Линч Дж.Ф., Боланд С.Р. (июль 2009 г.). «Обзор синдрома Линча: история, молекулярная генетика, скрининг, дифференциальный диагноз и судебно-медицинские разветвления». Clin. Genet. 76 (1): 1–18. Дои:10.1111 / j.1399-0004.2009.01230.x. ЧВК 2846640. PMID 19659756.
- ^ «Генетика». Национальный институт рака. 2015-04-22. Получено 2018-02-20.
- ^ а б c Banks, KC; Moline, JJ; Марвин, ML; Ньюлин, AC; Фогель, KJ (март 2013 г.). «10 редких опухолей, требующих направления к генетикам». Семейный рак. 12 (1): 1–18. Дои:10.1007 / s10689-012-9584-9. PMID 23377869.
- ^ Корде, Лариса А .; Гадалла, Шахиназ М. (02.05.2017). «Оценка риска рака для врача первичного звена». Первая помощь. 36 (3): 471–488. Дои:10.1016 / j.pop.2009.04.006. ЧВК 2713871. PMID 19616151.
- ^ а б Андерсон, Синди Лу; Кэри Браун (2007). Патофизиология: функциональные изменения в здоровье человека. Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-6250-2.
- ^ а б Линдор Н. М., Грин М. Х. (июль 1998 г.). «Краткий справочник по синдромам семейного рака. Программа Майо по семейному раку». Журнал Национального института рака. 90 (14): 1039–71. Дои:10.1093 / jnci / 90.14.1039. PMID 9672254.
- ^ Молдавский ГЛ, Д'Андреа А.Д. (2009). «Как путь анемии фанкони охраняет геном». Анну. Преподобный Жене. 43: 223–49. Дои:10.1146 / annurev-genet-102108-134222. ЧВК 2830711. PMID 19686080.
- ^ Tischkowitz MD, Hodgson SV (январь 2003 г.). «Анемия Фанкони». Журнал медицинской генетики. 40 (1): 1–10. Дои:10.1136 / jmg.40.1.1. ЧВК 1735271. PMID 12525534.
- ^ Ки Ю., Д'Андреа А.Д. (ноябрь 2012 г.). «Молекулярный патогенез и клиническое лечение анемии Фанкони». Журнал клинических исследований. 122 (11): 3799–806. Дои:10.1172 / JCI58321. ЧВК 3484428. PMID 23114602.
- ^ Kottemann MC, Smogorzewska A (январь 2013 г.). «Анемия Фанкони и восстановление сшивок ДНК Уотсона и Крика». Природа. 493 (7432): 356–63. Bibcode:2013Натура.493..356K. Дои:10.1038 / природа11863. ЧВК 3700363. PMID 23325218.
- ^ Су X, Хуанг Дж (сентябрь 2011 г.). "Путь анемии Фанкони и восстановление межцепочечных сшивок ДНК". Белковая клетка. 2 (9): 704–11. Дои:10.1007 / s13238-011-1098-y. ЧВК 4875268. PMID 21948210.
- ^ а б Половина E, Беркович Д., Розен П. (2009). «Семейный аденоматозный полипоз». Орфанет Дж. Редкие Диск.. 4: 22. Дои:10.1186/1750-1172-4-22. ЧВК 2772987. PMID 19822006.
- ^ Галиатсатос П., Фоулкс В.Д. (февраль 2006 г.). «Семейный аденоматозный полипоз». Американский журнал гастроэнтерологии. 101 (2): 385–98. PMID 16454848.
- ^ Macrae F, du Sart D, Nasioulas S (2009). «Семейный аденоматозный полипоз». Лучшая практика Res Clin Gastroenterol. 23 (2): 197–207. Дои:10.1016 / j.bpg.2009.02.010. PMID 19414146.
- ^ Петручелли Н., Дали МБ, Фельдман Г.Л. (май 2010 г.). «Наследственный рак груди и яичников из-за мутаций в BRCA1 и BRCA2». Genet. Med. 12 (5): 245–59. Дои:10.1097 / GIM.0b013e3181d38f2f. PMID 20216074.
- ^ Смит EC (2012). «Обзор наследственного синдрома рака груди и яичников». J акушерство женское здоровье. 57 (6): 577–84. Дои:10.1111 / j.1542-2011.2012.00199.x. PMID 23050669.
- ^ Дрешер К.М., Шарма П., Линч Х.Т. (2010). «Текущие гипотезы о том, как микросателлитная нестабильность приводит к увеличению выживаемости пациентов с синдромом Линча». Clin. Dev. Иммунол. 2010: 1–13. Дои:10.1155/2010/170432. ЧВК 2901607. PMID 20631828.
- ^ Кункель Т.А., Эри Д.А. (2005). «Ремонт несоответствия ДНК». Анну. Преподобный Biochem. 74: 681–710. Дои:10.1146 / annurev.biochem.74.082803.133243. PMID 15952900.
- ^ Кастринос Ф, Сингал С (2011). «Унаследованные синдромы колоректального рака». Журнал рака. 17 (6): 405–15. Дои:10.1097 / PPO.0b013e318237e408. ЧВК 3240819. PMID 22157284.
- ^ Neumann HP, Pawlu C, Peczkowska M, Bausch B, McWhinney SR, Muresan M, Buchta M, Franke G, Klisch J, Bley TA, Hoegerle S, Boedeker CC, Opocher G, Schipper J, Januszewicz A, Eng C (2004) . «Отличительные клинические особенности синдромов параганглиомы, связанных с мутациями генов SDHB и SDHD». JAMA. 292 (8): 943–51. Дои:10.1001 / jama.292.8.943. PMID 15328326.
- ^ Малкин Д (апрель 2011). «Синдром Ли-Фраумени». Гены рака. 2 (4): 475–84. Дои:10.1177/1947601911413466. ЧВК 3135649. PMID 21779515.
- ^ Бакры, Д (2013). P53 в клинике: мутации TP53 зародышевой линии: генетика синдрома Ли – Фраумени. Нью-Йорк: Спрингер. С. 167–188. ISBN 978-1-4614-3676-8.
- ^ Берч Дж. М. (июль 1994 г.). «Семейные онкологические синдромы и кластеры». Британский медицинский бюллетень. 50 (3): 624–39. Дои:10.1093 / oxfordjournals.bmb.a072913. PMID 7987644.
- ^ Кенель С., Малкин Д. (август 1997 г.). «Генетическая предрасположенность к раку и семейные раковые синдромы». Педиатр. Clin. North Am. 44 (4): 791–808. Дои:10.1016 / s0031-3955 (05) 70530-7. PMID 9286285.
- ^ Сэмпсон Дж. Р., Джонс Н. (2009). «МУТИХ-ассоциированный полипоз». Лучшая практика Res Clin Gastroenterol. 23 (2): 209–18. Дои:10.1016 / j.bpg.2009.03.006. PMID 19414147.
- ^ Манфреди М., Вескови П., Бонанини М., Портер С. (март 2004 г.). «Синдром невоидной базальноклеточной карциномы: обзор литературы». Международный журнал оральной и челюстно-лицевой хирургии. 33 (2): 117–24. Дои:10.1054 / ijom.2003.0435. PMID 15050066.
- ^ Lo Muzio L (2008). «Синдром невоидной базальноклеточной карциномы (синдром Горлина)». Журнал редких заболеваний Orphanet. 3: 32. Дои:10.1186/1750-1172-3-32. ЧВК 2607262. PMID 19032739.
- ^ Ричард, S; Гарди, B; Couvé, S; Гад, С (30 мая 2012 г.). «Фон Хиппель-Линдау: Как редкое заболевание освещает биологию рака». Семинары по биологии рака. 23 (1): 26–37. Дои:10.1016 / j.semcancer.2012.05.005. PMID 22659535.
- ^ Генри, Тодд; Кампелл, Джеймс; Хоули, Артур (1969). Клиническая диагностика Тодда-Сэнфорда лабораторными методами, под редакцией Исраэля Дэвидсона [и] Джона Бернарда Генри. (14-е изд.). Филадельфия: Сондерс. п. 555. ISBN 978-0-7216-2921-6.
- ^ Вонг В. Т., Н. Э., Агро Коулман Х. Р. и др. (Февраль 2007 г.). «Генотип-фенотипическая корреляция при болезни фон Хиппеля – Линдау с ангиоматозом сетчатки». Архив офтальмологии. 125 (2): 239–45. Дои:10.1001 / archopht.125.2.239. ЧВК 3019103. PMID 17296901. Архивировано из оригинал на 2008-12-12. Получено 2008-10-22.
- ^ Леманн А.Р., МакГиббон Д., Стефанини М. (2011). «Пигментная ксеродермия». Журнал редких заболеваний Orphanet. 6: 70. Дои:10.1186/1750-1172-6-70. ЧВК 3221642. PMID 22044607.
- ^ Нидернхофер Л. Дж., Бор В. А., Сандер М., Кремер К. Х. (2011). «Пигментная ксеродермия и другие болезни преждевременного старения человека и восстановления ДНК: молекулы для пациентов». Мех. Старение Дев. 132 (6–7): 340–7. Дои:10.1016 / j.mad.2011.06.004. ЧВК 3474983. PMID 21708183.
- ^ а б Кеймлинг М., Волчич М., Чернок А., Виланд Б., Дёрк Т., Висмюллер Л. (2011). «Функциональная характеристика связывает мутации отдельных пациентов в телеангиэктазии атаксии (ATM) с дисфункцией специфических сигнальных путей репарации двухцепочечных разрывов ДНК». Журнал FASEB. 25 (11): 3849–60. Дои:10.1096 / fj.11-185546. PMID 21778326.
- ^ Томпсон LH, Шильд D (2002). «Рекомбинационная репарация ДНК и болезни человека». Мутат. Res. 509 (1–2): 49–78. Дои:10.1016 / s0027-5107 (02) 00224-5. PMID 12427531.
- ^ Нимонкар А.В., Озой А.З., Геншель Дж., Модрич П., Ковальчиковски С.К. (2008). «Человеческая экзонуклеаза 1 и геликаза BLM взаимодействуют, чтобы резектировать ДНК и инициировать репарацию ДНК». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (44): 16906–11. Bibcode:2008PNAS..10516906N. Дои:10.1073 / pnas.0809380105. ЧВК 2579351. PMID 18971343.
- ^ Герман Дж. (1969). «Синдром Блума. I. Генетические и клинические наблюдения у первых двадцати семи пациентов». Американский журнал генетики человека. 21 (2): 196–227. ЧВК 1706430. PMID 5770175.
- ^ Нагараджу Г., Скалли Р. (2007). «Не обращая внимания на пробел: подземные функции BRCA1 и BRCA2 при остановке вилок репликации». Ремонт ДНК (Amst.). 6 (7): 1018–31. Дои:10.1016 / j.dnarep.2007.02.020. ЧВК 2989184. PMID 17379580.
- ^ Ланкастер Дж. М., Пауэлл CB, Чен Л. М., Ричардсон Д. Л. (2015). «Заявление Общества гинекологической онкологии по оценке риска наследственной предрасположенности к гинекологическому раку». Гинеколь. Онкол. 136 (1): 3–7. Дои:10.1016 / j.ygyno.2014.09.009. PMID 25238946.
- ^ Томпсон Л. Х., Хинц Дж. М. (2009). «Клеточные и молекулярные последствия дефектных белков анемии Фанкони в репликационной репарации ДНК: понимание механизма». Мутат. Res. 668 (1–2): 54–72. Дои:10.1016 / j.mrfmmm.2009.02.003. ЧВК 2714807. PMID 19622404.
- ^ Альтер БП (2003). «Рак при анемии Фанкони, 1927-2001». Рак. 97 (2): 425–40. Дои:10.1002 / cncr.11046. PMID 12518367.
- ^ Мейер Л.А., Броддус Р.Р., Лу К.Х. (2009). «Рак эндометрия и синдром Линча: клинические и патологические соображения». Борьба с раком. 16 (1): 14–22. Дои:10.1177/107327480901600103. ЧВК 3693757. PMID 19078925.
- ^ Каретерс Дж. М., Стоффель Е. М. (2015). «Синдром Линча и мимика синдрома Линча: растущий сложный ландшафт наследственного рака толстой кишки». Всемирный журнал гастроэнтерологии. 21 (31): 9253–61. Дои:10.3748 / wjg.v21.i31.9253. ЧВК 4541378. PMID 26309352.
- ^ Кастан МБ (2008). «Реакция на повреждение ДНК: механизмы и роль в человеческих заболеваниях: лекция 2007 г. на присуждении премии имени Г.А. Клоуса». Мол. Рак Res. 6 (4): 517–24. Дои:10.1158 / 1541-7786.MCR-08-0020. PMID 18403632.
- ^ Викторссон К., Де Петрис Л., Левенсон Р. (2005). «Роль p53 в ответах на лечение рака легких». Biochem. Биофиз. Res. Сообщество. 331 (3): 868–80. Дои:10.1016 / j.bbrc.2005.03.192. PMID 15865943.
- ^ Теста JR, Малкин D, Шиффман JD (2013). «Связь молекулярных путей с наследственными синдромами риска рака». Учебное пособие Американского общества клинической онкологии. 33: 81–90. Дои:10.1200 / EdBook_AM.2013.33.81. ЧВК 5889618. PMID 23714463.
- ^ Рапп А, Грейлих КО (2004). «После индукции двухцепочечного разрыва УФ-А, гомологичная рекомбинация и негомологичное соединение концов взаимодействуют в одном DSB, если доступны обе системы». Журнал клеточной науки. 117 (Пт 21): 4935–45. Дои:10.1242 / jcs.01355. PMID 15367581.
- ^ Барткова Дж., Томмиска Дж., Оплюстилова Л., Аалтонен К., Тамминен А., Хейккинен Т., Мистрик М., Айттомяки К., Бломквист С., Хейккиля П., Лукас Дж., Неванлинна Х., Бартек Дж. (2008). «Аберрации сенсорного комплекса повреждения ДНК MRE11-RAD50-NBS1 при раке груди человека: MRE11 как кандидатный ген, предрасполагающий к семейному раку». Мол Онкол. 2 (4): 296–316. Дои:10.1016 / j.molonc.2008.09.007. ЧВК 5527773. PMID 19383352.
- ^ Маркканен Э, Дорн Дж, Хюбшер У. (2013). «MUTYH ДНК-гликозилаза: основание для удаления неповрежденных оснований из ДНК». Фронт Жене. 4: 18. Дои:10.3389 / fgene.2013.00018. ЧВК 3584444. PMID 23450852.
- ^ Патель С.Г., Анен Д.Д. (2012). «Синдромы семейного рака толстой кишки: обновление быстро развивающейся области». Curr Gastroenterol Rep. 14 (5): 428–38. Дои:10.1007 / s11894-012-0280-6. ЧВК 3448005. PMID 22864806.
- ^ а б Chrzanowska KH, Gregorek H, Dembowska-Bagińska B, Kalina MA, Digweed M (2012). «Синдром разрыва Неймегена (NBS)». Журнал редких заболеваний Orphanet. 7: 13. Дои:10.1186/1750-1172-7-13. ЧВК 3314554. PMID 22373003.
- ^ Krokan HE, Bjørås M (2013). «Базовая эксцизионная пластика». Холодная весна Харб Perspect Biol. 5 (4): a012583. Дои:10.1101 / cshperspect.a012583. ЧВК 3683898. PMID 23545420.
- ^ Койпер Р.П., Хугербрюгге Н (2015). «NTHL1 определяет новый раковый синдром». Oncotarget. 6 (33): 34069–70. Дои:10.18632 / oncotarget.5864. ЧВК 4741436. PMID 26431160.
- ^ Сингх Д.К., Ан Б., Бор В.А. (2009). «Роль RECQ геликаз в репарации ДНК на основе рекомбинации, стабильности генома и старении». Биогеронтология. 10 (3): 235–52. Дои:10.1007 / s10522-008-9205-z. ЧВК 2713741. PMID 19083132.
- ^ Анбари К.К., Иерарди-Курто Л.А., Силбер Дж. С., Асада Н., Спиннер Н., Закай Э. Х., Беласко Дж., Морриссетт Дж. Д., Дорман Дж. П. (2000). «Две первичные остеосаркомы у пациента с синдромом Ротмунда-Томсона». Clin. Orthop. Relat. Res. 378 (378): 213–23. Дои:10.1097/00003086-200009000-00032. PMID 10986997.
- ^ Бор В.А. (2005). «Недостаточная репарация ДНК при прогероидном расстройстве человека, синдром Вернера». Мутат. Res. 577 (1–2): 252–9. Дои:10.1016 / j.mrfmmm.2005.03.021. PMID 15916783.
- ^ Моннат Р.Дж. (2010). «Геликазы RECQ человека: роль в метаболизме ДНК, мутагенезе и биологии рака». Семин. Рак Биол. 20 (5): 329–39. Дои:10.1016 / j.semcancer.2010.10.002. ЧВК 3040982. PMID 20934517.
- ^ а б Менк CF, Манфорд V (2014). «Болезни восстановления ДНК: что они говорят нам о раке и старении?». Genet. Мол. Биол. 37 (1 приложение): 220–33. Дои:10.1590 / с1415-47572014000200008. ЧВК 3983582. PMID 24764756.
- ^ а б Леманн А.Р., МакГиббон Д., Стефанини М. (2011). «Пигментная ксеродермия». Журнал редких заболеваний Orphanet. 6: 70. Дои:10.1186/1750-1172-6-70. ЧВК 3221642. PMID 22044607.
- ^ а б О, К.С., Имото К., Эммерт С., Тамура Д., ДиДжиованна Дж. Дж., Кремер К. Х. (2011). «Белки эксцизионной репарации нуклеотидов быстро накапливаются, но не сохраняются в человеческих клетках XP-E (мутант DDB2)». Photochem. Фотобиол. 87 (3): 729–33. Дои:10.1111 / j.1751-1097.2011.00909.x. ЧВК 3082610. PMID 21388382.
- ^ а б Оплеталова К., Бурильон А., Ян В., Пувель С., Армир Дж., Деспрас Е., Людовик М., Матеус К., Роберт С., Каннуш П., Суфир Н., Сарасин А. (2014). «Корреляция фенотипа / генотипа в когорте из 23 пациентов с вариантом пигментной ксеродермы выявила 12 новых болезнетворных мутаций POLH». Гм. Мутат. 35 (1): 117–28. Дои:10.1002 / humu.22462. PMID 24130121.
- ^ а б "Генетическое тестирование наследственных онкологических синдромов". Национальный институт рака. 2013-04-22. Получено 2018-02-19.
- ^ а б Фоулкс, Уильям Д .; Кнопперс, Барта Мария; Тернбулл, Клэр (январь 2016 г.). «Популяционное генетическое тестирование на предрасположенность к раку: мутации-основатели в геномах». Обзоры природы. Клиническая онкология. 13 (1): 41–54. Дои:10.1038 / nrclinonc.2015.173. ISSN 1759-4782. PMID 26483301.
- ^ Справка, Дом генетики. "Что такое генетическое тестирование?". Домашний справочник по генетике. Получено 2018-02-20.
- ^ Майерс, Мелани Ф .; Бернхардт, Барбара А. (июнь 2012 г.). «Прямое генетическое тестирование потребителя: введение в специальный выпуск». Журнал генетического консультирования. 21 (3): 357–360. Дои:10.1007 / s10897-012-9500-3. ISSN 1573-3599. PMID 22441809.
- ^ Справка, Дом генетики. «Сколько стоит генетическое тестирование и сколько времени нужно, чтобы получить результаты?». Домашний справочник по генетике. Получено 2018-02-20.
- ^ Робсон, Марк Э .; Брэдбери, Анджела Р.; Арун, Бану; Домчек, Сьюзен М .; Форд, Джеймс М .; Hampel, Heather L .; Липкин, Стивен М .; Syngal, Сапна; Воллинз, Дана С. (01.11.2015). «Обновление заявления о политике Американского общества клинической онкологии: генетическое и геномное тестирование на предрасположенность к раку». Журнал клинической онкологии. 33 (31): 3660–3667. Дои:10.1200 / JCO.2015.63.0996. ISSN 1527-7755. PMID 26324357.
- ^ «Генетическое тестирование на риск рака». Cancer Research UK. 2015-06-02. Получено 2018-02-20.
- ^ Schrag, D .; Кунц, К. М .; Гарбер, Дж. Э .; Уикс, Дж. К. (1997-05-15). «Анализ решения - влияние профилактической мастэктомии и овариэктомии на продолжительность жизни женщин с мутациями BRCA1 или BRCA2». Медицинский журнал Новой Англии. 336 (20): 1465–1471. Дои:10.1056 / NEJM199705153362022. ISSN 0028-4793. PMID 9148160.
- ^ Ньютон, К .; Грин, К .; Lalloo, F .; Evans, D.G .; Хилл, Дж. (Январь 2015 г.). «Комплаентность и результаты скрининга колоноскопии у пациентов с синдромом Линча». Колоректальное заболевание. 17 (1): 38–46. Дои:10.1111 / codi.12778. ISSN 1463-1318. PMID 25213040.
- ^ Казак Матвей; Гаффари, Кэмерон; Уотсон, Патрис; Снайдер, Кэрри; Линч, Генри (апрель 2014 г.). «Использование аспирина связано с более низким риском рака простаты у мужчин-носителей мутаций BRCA». Журнал генетического консультирования. 23 (2): 187–191. Дои:10.1007 / s10897-013-9629-8. ISSN 1573-3599. PMID 23881471.
- ^ Thorat, Mangesh A .; Кузик, Джек (декабрь 2013 г.). «Роль аспирина в профилактике рака». Текущие онкологические отчеты. 15 (6): 533–540. Дои:10.1007 / s11912-013-0351-3. ISSN 1534-6269. PMID 24114189.
- ^ Справка, Дом генетики. «Синдром Вернера». Домашний справочник по генетике. Получено 2018-02-20.
- ^ "Генетический риск, раса и этническая принадлежность | Журнал" Борцы с раком Thrive Magazine ". CancerCenter.com. Архивировано из оригинал на 2018-02-21. Получено 2018-02-20.