WikiDer > Центральная толерантность
Центральная толерантность, также известный как отрицательный отбор, представляет собой процесс устранения любых развивающийся Т или же В-лимфоциты которые реагируют на себя.[1] Путем устранения аутореактивных лимфоцитов толерантность гарантирует, что иммунная система не атакует собственные пептиды.[2] Созревание лимфоцитов (и центральная толерантность) происходит в первичные лимфоидные органы такой как Костный мозг и вилочковая железа. У млекопитающих В-клетки созревают в костном мозге, а Т-клетки - в тимусе.[1]
Центральная толерантность не идеальна, поэтому периферическая толерантность существует как вторичный механизм, гарантирующий, что Т- и В-клетки не будут самореактивными, когда они покидают первичные лимфоидные органы.[3] Периферическая толерантность отличается от центральной толерантности тем, что возникает после выхода развивающихся иммунных клеток из первичных лимфоидных органов (тимуса и костного мозга) до их экспорта на периферию.[1]
Функция центральной толерантности
Центральная толерантность важна для правильного функционирования иммунных клеток, поскольку она помогает гарантировать, что зрелые В-клетки и Т-клетки не распознают аутоантигены как чужеродные микробы.[2] В частности, центральная толерантность необходима, потому что рецепторы Т-клеток (TCR) и рецепторы В-клеток (BCR) производятся клетками посредством случайной соматической перестройки.[1] Этот процесс, известный как V (D) J рекомбинация, важен, потому что он увеличивает разнообразие рецепторов, что увеличивает вероятность того, что В-клетки и Т-клетки будут иметь рецепторы для новых антигенов.[1] Функциональное разнообразие происходит во время рекомбинации и служит для дальнейшего увеличения разнообразия BCR и TCR.[1] Производство случайных TCR и BCR является важным методом защиты от микробов из-за их высокой скорости мутации. Этот процесс также играет важную роль в обеспечении выживания вида, потому что внутри вида будет происходить множество перегруппировок рецепторов, что означает очень высокую вероятность того, что по крайней мере один представитель вида будет иметь рецепторы для нового антигена.[1]
Хотя процесс соматической рекомбинации необходим для успешной иммунной защиты, он может привести к аутореактивности. Например, отсутствие функционала RAG1 / 2ферменты, необходимые для соматической рекомбинации, были связаны с развитием иммунных цитопений, при которых вырабатываются антитела против клеток крови пациента.[4] Из-за природы случайной рекомбинации рецепторов будут производиться некоторые BCR и TCR, которые распознают аутоантигены как чужеродные.[2] Это проблематично, поскольку эти В- и Т-клетки, если они будут активированы, вызовут атаку иммунной системы против себя, если не будут убиты или инактивированы центральными механизмами толерантности.[2] Следовательно, без центральной толерантности иммунная система может атаковать себя, что не является устойчивым и может привести к аутоиммунному расстройству.[2][3]
Механизмы центральной толерантности
Конечным результатом толерантности является популяция лимфоцитов, которые не реагируют на аутоантигены, но могут распознавать чужеродные, не аутоантигены, в зависимости от случайно расположенного рецептора.[2] Важно отметить, что лимфоциты могут развить толерантность только к антигенам, которые присутствуют в костном мозге (для B-клеток) и тимусе (для T-клеток).
Толерантность к В-клеткам
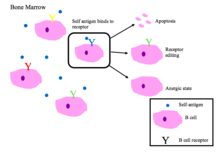
Незрелые В-клетки в костном мозге подвергаются отрицательной селекции, когда связываются с собственными пептидами.[2]
Правильно функционирующие рецепторы В-клеток распознают не собственный антиген или ассоциированные с патогеном молекулярные белки (PAMPs).[1]
Основные результаты аутореактивности BCR [1][2]
- Апоптоз (клональное удаление)
- Редактирование рецептора: самореактивные В-клетки изменяют специфичность путем перестройки генов и вырабатывают новый BCR, который не реагирует на себя. Этот процесс дает B-клетке возможность редактировать BCR до того, как она получит сигнал об апоптозе или анергии.
- Индукция анергия (состояние безреактивности)
Толерантность к Т-клеткам
Центральная толерантность Т-клеток возникает в тимусе.[1] Т-клетки подвергаются положительному и отрицательному отбору.[2]
Рецепторы Т-клеток должны обладать способностью распознавать себя. главный комплекс гистосовместимости (MHC) молекулы со связанным несамостоятельным пептидом.[1]
Шаги толерантности к Т-клеткам [2][5]
- Во время положительного отбора Т-клетки проверяются на их способность связывать комплексы пептид-MHC с аффинностью. Если Т-клетка не может связать MHC класс I или же MHC класс II сложный, он не получает сигналов о выживании, поэтому погибает в результате апоптоза. Рецепторы Т-клеток с достаточным сродством к комплексам пептид-MHC отбираются для выживания.
- Во время отрицательного отбора Т-клетки проверяются на их сродство к себе. Если они связываются с собственным пептидом, то они получают сигнал об апоптозе (процесс клональной делеции).
- Эпителиальные клетки тимуса отображают собственный антиген по отношению к Т-клеткам, чтобы проверить их сродство к себе.
- Регуляторы транскрипции AIRE и Fezf2 играют важную роль в экспрессии собственных тканевых антигенов на эпителиальных клетках тимуса в тимусе.
- Отрицательный отбор происходит в корково-мозговом соединении и мозговом веществе тимуса.
- Т-клетки, которые не связываются сами с собой, но распознают комплексы антиген / MHC, и являются либо CD4 +, либо CD8 +, мигрируют во вторичные лимфоидные органы в виде зрелых наивных Т-клеток.
Регуляторные Т-клетки представляют собой еще один тип Т-клеток, созревающих в тимусе. Отбор T reg клеток происходит в мозговом веществе тимуса и сопровождается транскрипцией Foxp3. Регуляторы T-клеток важны для регулирования аутоиммунитета, подавляя иммунную систему, когда она не должна быть активной.[6]
Генетические заболевания, вызванные дефектами центральной толерантности
Генетические дефекты центральной толерантности могут привести к аутоиммунитету.
- Синдром аутоиммунной полиэндокринопатии I типа вызвано мутациями в гене человека AIRE. Это приводит к недостаточной экспрессии периферических антигенов в тимусе и, следовательно, к отсутствию негативного отбора в отношении ключевых периферических белков, таких как инсулин.[7][8] В результате возникают множественные аутоиммунные симптомы.
История центральной толерантности
Впервые центральную толерантность использовал Рэй Оуэн в 1945 году, когда он заметил, что дизиготный рогатый скот-близнец не вырабатывает антител, когда одному из близнецов вводили кровь другого.[9] Его выводы были подтверждены более поздними экспериментами Хашека и Биллингема.[9] Результаты были объяснены Бюрет клональный отбор гипотеза.[10] Бернет и Медавар получили Нобелевскую премию в 1960 году за свою работу по объяснению того, как работает иммунная толерантность.[10][11]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я Оуэн Дж.А., Пунт Дж., Стрэнфорд С.А., Джонс П.П., Куби Дж. (2013). Кубы иммунология (7-е изд.). Нью-Йорк: W.H. Фримен. ISBN 978-1-4292-1919-8. OCLC 820117219.
- ^ а б c d е ж грамм час Romagnani S (2006). «Иммунологическая толерантность и аутоиммунитет». Внутренняя и неотложная медицина. 1 (3): 187–96. Дои:10.1007 / bf02934736. PMID 17120464.
- ^ а б Джейнвей C (2011). Иммунобиология 5: Иммунная система в состоянии здоровья и болезни (5-е изд.). Нью-Йорк: Гарленд. ISBN 978-0-8153-3642-6. OCLC 45708106.
- ^ Чен К., Ву В., Мэтью Д., Чжан Ю., Браун С. К., Розен Л. Б., Макманус М. П., Пульсифер М. А., Янделл М., Бонсак Дж. Ф., Джорд Л. Б., Нотаранджело Л. Д., Уолтер Дж. Э. (март 2014 г.). «Аутоиммунитет из-за дефицита RAG и предполагаемая частота заболевания мутациями RAG1 / 2». Журнал аллергии и клинической иммунологии. 133 (3): 880–2.e10. Дои:10.1016 / j.jaci.2013.11.038. ЧВК 4107635. PMID 24472623.
- ^ Спрент Дж., Кисимото Х. (май 2001 г.). «Тимус и центральная толерантность». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 356 (1409): 609–16. Дои:10.1098 / rstb.2001.0846. ЧВК 1088448. PMID 11375064.
- ^ Bettelli E, Carrier Y, Gao W., Korn T., Strom TB, Oukka M, Weiner HL, Kuchroo VK (май 2006 г.). «Взаимные пути развития для генерации патогенных эффекторных TH17 и регуляторных Т-клеток». Природа. 441 (7090): 235–8. Дои:10.1038 / природа04753. PMID 16648838.
- ^ Андерсон М.С., Венанци Е.С., Кляйн Л., Чен З., Берзиньш С.П., Терли С.Дж., фон Бёмер Х., Бронсон Р., Диерих А., Бенуа С., Матис Д. (ноябрь 2002 г.). «Проекция иммунологической собственной тени в тимусе белком воздуха». Наука. 298 (5597): 1395–401. Дои:10.1126 / science.1075958. PMID 12376594.
- ^ Листон А., Лесаж С., Уилсон Дж., Пелтонен Л., Гуднау СС (апрель 2003 г.). «Aire регулирует негативный отбор органоспецифических Т-клеток». Иммунология природы. 4 (4): 350–4. Дои:10.1038 / ni906. PMID 12612579.
- ^ а б Шварц Р.Х. (апрель 2012 г.). «Исторический обзор иммунологической толерантности». Перспективы Колд-Спринг-Харбор в биологии. 4 (4): а006908. Дои:10.1101 / cshperspect.a006908. ЧВК 3312674. PMID 22395097.
- ^ а б Листон А (январь 2011 г.). «Иммунологическая толерантность через 50 лет после присуждения Нобелевской премии Бернета». Иммунология и клеточная биология. 89 (1): 14–5. Дои:10.1038 / icb.2010.138. PMID 21209621.
- ^ Сильверштейн AM (март 2016 г.). «Любопытный случай с Нобелевской премией 1960 года Бернету и Медавару». Иммунология. 147 (3): 269–74. Дои:10.1111 / imm.12558. ЧВК 4754613. PMID 26790994.