WikiDer > Фторирование тетрафторидом серы
Фторирование тетрафторидом серы производит фторорганические соединения из окисленных органических соединений, включая спирты, карбонильные соединения, алкилгалогениды и другие.[1]
Тетрафторид серы представляет собой газообразный реагент, который можно использовать для фторирования различных органических функциональных групп, включая карбонильные соединения, спирты и галогениды. Обработка карбонильных соединений обычно превращает их в органофториды с эквивалентной степенью окисления: карбоновые кислоты превращаются в трифторметильные соединения, кетоны и альдегиды в дифториды и т. Д. Реакция имеет широкий диапазон и является одним из немногих доступных методов прямого введения фтора в конкретный участок в относительно мягких условиях.
(1)

Фторирование спиртов и галогенидов также возможно с помощью SF.4. Однако SF4 является газообразным при комнатной температуре, и многие превращения с участием этого реагента требуют повышенных температур, что несколько затрудняет обращение с ним. Кроме того, реакция генерирует большое количество фтороводород. Эти опасения привели к разработке более безопасных и надежных фторирующих реагентов, таких как DAST (трифторид диэтиламиносеры).[2]
Механизм и стереохимия
Преобладающий механизм
Механизм фторирования СФ4 является неопределенным и варьируется в зависимости от подложки. Первоначально в качестве промежуточных продуктов предлагались трифториды алкоксисеры;[3] однако реакции выделенных трифторидов алкоксисеры с фтороводород или нагревание не дало соответствующих алкилфторидов.
(2)

Механизм дифторирования вицинальных диолов хорошо изучен,[4] и происходит путем инвертирующей атаки по одной гидроксильной группе с образованием промежуточного фторсульфита, который превращается в дифторированный продукт после дополнительной обработки SF4 и ВЧ. Второе фторирование происходит с сохранением конфигурации. Здесь возможна внутримолекулярная доставка фторида и наблюдалась в некоторых других случаях фторирования SF.4. SN1 действуют для соединений, легко образующих карбокатионы, в то время как SN2 реакции происходят с менее ионизируемыми соединениями.
(3)

Фторирование карбоновых кислот дает не только ожидаемые трифторметильные соединения, но также α-тетрафторированные эфиры. Был предложен и экспериментально подтвержден механизм учета обоих продуктов.[5] Внутримолекулярная доставка фторида была использована для объяснения образования дифторметильных катионов. Атака молекулы ацилфторида на дифторметильный катион с последующей нейтрализацией на месте образуемый бифторид, приводит к α-тетрафторированным эфирным продуктам. Прямая реакция с бифторидом дает трифторметилсодержащие продукты.
(4)

Объем и ограничения
Тетрафторид серы можно использовать для замены ряда функциональных групп частично или полностью фторированными производными. Жидкий фтороводород может использоваться как растворитель и катализатор с SF.4 для селективного фторирования спиртов.[6] SF4Реакционная способность с карбонильными соединениями не увеличивается в присутствии HF. Как правило, только относительно кислые спирты могут быть эффективно фторированы SF.4, хотя аминоспирты, по-видимому, являются исключением из этого правила.
(5)
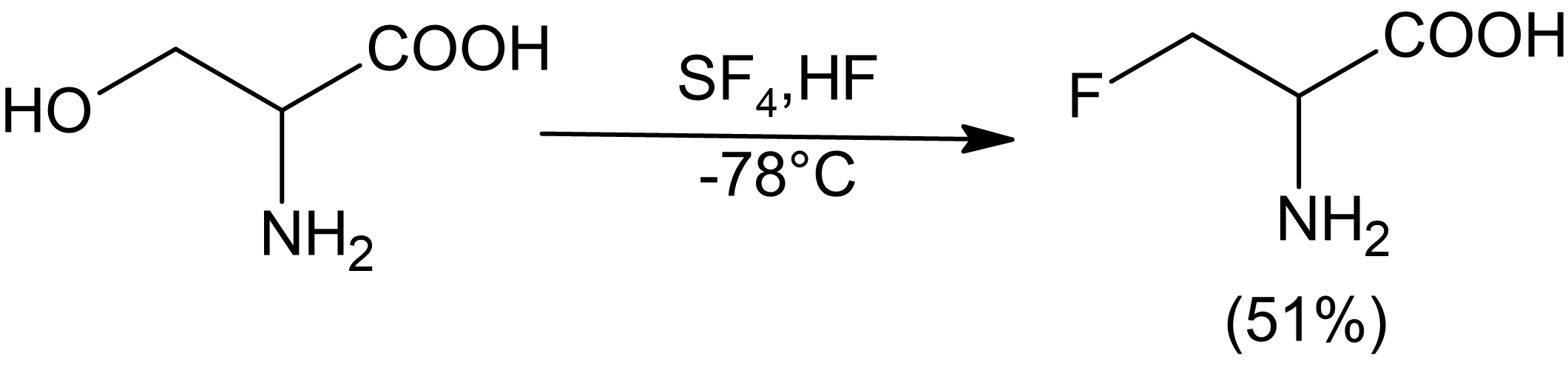
Когда вицинальные диолы сочетаются с SF4дифторирование происходит с изменением конфигурации одного из спиртов. Это было продемонстрировано при синтезе мезо-дифторсукцинат из (L) -тартрата и синтез (D) - и (L) -дифторсукцината из мезо-тартрат.[7]
(6)

Карбонильные соединения обычно реагируют с SF.4 с образованием геминальных дифторидов. Время реакции обычно составляет порядка часов, а выходы умеренные.[8]
(7)
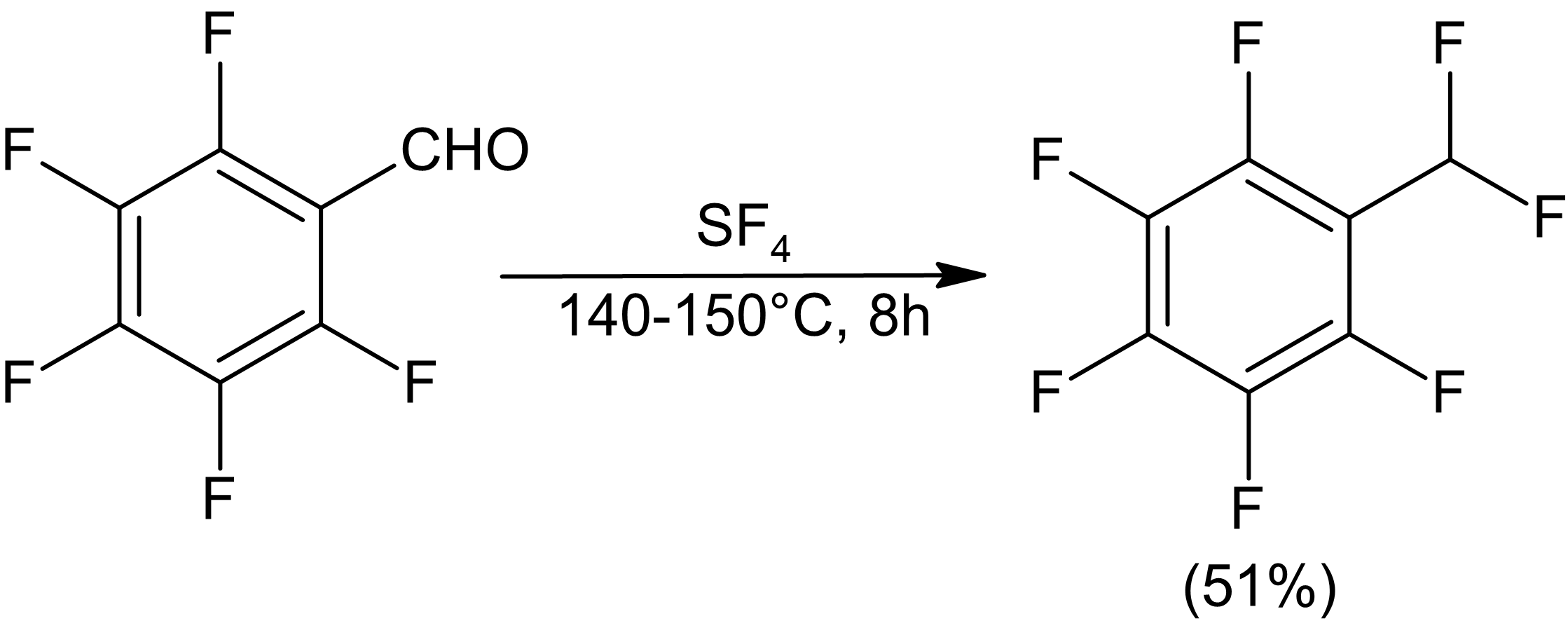
Фторирование лактонов может давать гетероциклические фториды, хотя раскрытие цикла наблюдалось для γ-бутиролактона. У шестичленного лактида не происходит раскрытия цикла.[9]
(8)

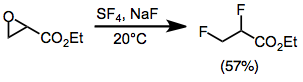
Фторирование открывает эпоксиды с образованием геминальных или вицинальных дифторидов в большинстве случаев. Моноарилепоксиды дают геминальные продукты с миграцией арильной группы. Для стерически затрудненных ди- и тризамещенных эпоксидов выходы низкие. Эпоксиды, замещенные сложноэфирной группой, дают вицинальные дифториды через промежуточное соединение - трифторид алкоксисеры.[10]
(9)
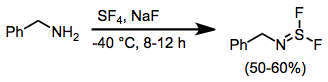
Когда амины обрабатывают SF4 и основание - дифториды иминосеры. Дальнейшая реакция этих соединений с фторидами щелочных металлов приводит к нитрилсульфиды, которые претерпевают [3 + 2] циклоприсоединение в присутствии диполярофилов.[11]
(10)
Карбоновые кислоты реагируют с SF4 с получением трифторметильных соединений через посредство ацилфторида. Тетрафторалкиловые эфиры также образуются в результате реакции между дифторметильным катионом и ацилфторидом.[12]
(11)

Тетрафторид серы можно использовать для эффективного фторирования полимеров. Это часто сильно влияет на свойства полимера - например, фторирование поливинилового спирта улучшает его устойчивость к сильным кислотам и основаниям.[13]
Синтетические приложения
Синтез простагландина, несущего трифторметильную группу у C-16, основан на промежуточном соединении, полученном фторированием карбоновой кислоты тетрафторидом серы.[14]
(12)

Сравнение с другими методами
Современные методы фторирования сделали трифторид серы практически устаревшим. Использование более удобного в обращении реагента DAST (трифторид диэтиламиносеры) теперь предпочтительнее SF4 для реакций нуклеофильного фторирования. DAST более селективен в отношении фторирования спиртов и способствует меньшему количеству перегруппировок и удалений в чувствительных к кислоте субстратах. Неудобство обращения с газообразным SF4 является недостатком фторирования с использованием этого реагента. Кроме того, неустойчивые к кислотам функциональные возможности не могут присутствовать в субстрате при использовании HF. Электрофильные фторирующие реагенты, такие как Selectfluor и N-фторсульфонимиды, дополняют реакционную способность SF4 и избежать этих проблем.[15]
(13)

Условия и методика экспериментов
Типичные условия
Тетрафторид серы представляет собой бесцветный газ при комнатной температуре, хотя он кипит при -38 ° C. Он быстро гидролизуется в водных средах, является коррозионным и токсичным; таким образом, реакции следует проводить в хорошо вентилируемом вытяжном шкафу в перчатках и защитных очках. Тетрафторид серы не реагирует с нержавеющей сталью, медью или никелем. Обычно реакции фторирования с SF4 выполняются в шейкере из нержавеющей стали. Газообразные реагенты вводятся в шейкер путем конденсации, а газообразные продукты обычно удаляются после завершения реакции (если газообразные продукты не представляют интереса, и в этом случае они могут быть конденсированы в отдельном сосуде). Фтористый водород можно отделить от желаемых продуктов выливанием реакционной смеси в воду с последующей фильтрацией. В этом контексте также можно использовать растворы гидроксида кальция, что дает безвредные фторид кальция.
Пример процедуры[16]
(14)

Дигидрохлорид 5-гидроксигистамина (1700 мг, 3,5 ммоль) растворяли в 25 мл безводной жидкой HF и раствор выпаривали в потоке сухого азота для удаления HCl. Остаток повторно растворяли в 40 мл HF при -78 ° C, обрабатывали 2,3 мл SF.4 (40,3 ммоль) и нагревали до 0 ° C в течение 2,5 ч. После повторного охлаждения до -78 ° C дополнительно добавляли 2 мл SF4 был конденсирован в раствор. Затем реактор погружали в ледяную баню (примерно 1 л), которой давали нагреться до комнатной температуры в течение ночи. Затем HF удаляли в потоке азота.2, остаток растворяли в 25 мл 2,5 н. HCl и раствор концентрировали. в вакууме до липкого остатка. Его наносили на 150 мл Dowex 50X8 и элюировали 200 мл H2O, 400 мл 1 н. HCl и прибл. 1 л 2,5 н. HCl. Положительные по нингидрину фракции (2,5 н. HCl) концентрировали до 500 мг кристаллического дигидрохлорида B-фторгистамина (71%): разложение при 130 ° C при введении при этой температуре; 60 МГц. 1H ЯМР (D2O-DCl) δ 3,3-4,2 (широкий мультиплет, 2 H), 6,27 (дублет четырехстрочных мультиплетов, 1 H, JHF = 47 Гц), 7,83 (м, 1 H, ДжHF = 2 Гц), 9,0 (с, 1 H). Анальный. Расчет. для C5ЧАС10N3FCl2: C 29,70; H 4,95; N 20,80; F, 9,40. Найдено: C 29,69; H 4,94; N 20,51; F, 9,72.
Рекомендации
- ^ Ван, К.-Л. Дж. Орг. Реагировать. 1985, 34, 319. Дои:10.1002 / 0471264180.or034.02
- ^ Худлики, М. Орг. Реагировать. 1988, 35, 513.
- ^ Hasek, R .; Smith, C .; Энгельгардт, А. Варенье. Chem. Soc. 1960, 82, 543.
- ^ Бурмаков, И .; Мотняк, А .; Куншенако, В .; Алексеева, А .; Ягупольский, М. J. Fluorine Chem. 1981, 19, 151.
- ^ Dmowski, W .; Колинский, А. Pol. J. Chem. 1978, 52, 547.
- ^ Kollonitsch, J .; Marburg, S .; Перкинс, М. J. Org. Chem. 1975, 40, 3808.
- ^ Bell, M .; Худлики, М. J. Fluorine Chem. 1980, 15, 191.
- ^ Моббс, Х. J. Fluorine Chem. 1971, 1, 361.
- ^ Муратов, Н .; Бурмаков, И .; Куншенко, В .; Алексеева, А .; Ягупольский, М. J. Org. Chem. СССР (англ. Пер.) 1982, 18, 1220.
- ^ Ягупольский, М .; Голиков, И .; Алексеева, А .; Александров, М. J. Org. Chem. СССР (англ. Пер.) 1971, 7, 737.
- ^ Grunwell, R .; Краситель, Л. Tetrahedron Lett., 1975, 1739.
- ^ Dmowski, W .; Колинский, А. Rocz. Chem. 1974, 48, 1697.
- ^ Bezsolitsen, P .; Горбунов, Н .; Назаров, А .; Хардин, П. Высокомол. Соедин., Сер. А 1972, 14, 950 [C.A., 77, 75710e (1972)].
- ^ Holland, G.W .; Jernow, J. L .; Rosen, P. Патент США. 4,256,911 (1981) [C.A., 89, 146500x (1978)].
- ^ Badoux, J .; Кахард, Д. Орг. Реагировать. 2007, 69, 347.
- ^ Бурмаков, И .; Мотняк, А .; Куншенко, В .; Алексеева, А .; Ягупольский, М. J. Org. Chem. СССР (англ. Пер.) 1980, 16, 1204.