WikiDer > Эффект Гоша
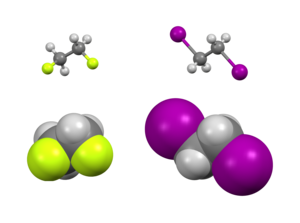
При изучении конформационная изомерия, то Эффект Гоша это нетипичная ситуация, когда грубая форма (группы разделены угол кручения примерно 60 °) более стабильна, чем антиконформация (180°).[2]
Есть оба стерический и электронные эффекты влияющие на относительную стабильность конформеров. Обычно стерические эффекты преобладают над большими заместители далеко друг от друга. Однако это не относится к некоторым заместителям, обычно тем, которые сильно электроотрицательный. Вместо этого существует электронное предпочтение, чтобы эти группы были бестактными. Обычно изучаемые примеры включают 1,2-дифторэтан (ЧАС2FCCFH2), этиленгликоль и вицинально-дифторалкильные структуры.
Есть два основных объяснения гош-эффекта: сверхсопряжение и гнутые облигации. В модели сверхсопряжения передача электронной плотности от связывающей орбитали C – H σ к C – F σ* разрыхляющая орбиталь считается источником стабилизации гош-изомера. Из-за большей электроотрицательности фтора орбиталь C – H σ является лучшим донором электронов, чем орбиталь C – F σ, а орбиталь C – F σ* орбиталь является лучшим акцептором электронов, чем C – H σ* орбитальный. Только гош-конформация обеспечивает хорошее перекрытие между лучшим донором и лучшим акцептором.
Ключевым моментом в объяснении гош-эффекта в дифторэтане с помощью изогнутой связи является усиление p орбитальный характер обеих связей C – F из-за большой электроотрицательности фтора. В результате электронная плотность увеличивается выше и ниже, слева и справа от центральной связи C – C. В результате уменьшенная орбитальное перекрытие может быть частично компенсирован, когда предполагается грубая конформация, образуя изогнутую связь. Из этих двух моделей гиперконъюгация обычно считается основной причиной гош-эффекта в дифторэтане.[5][6]
В молекулярная геометрия обоих ротамеров можно получить экспериментально с высоким разрешением ИК-спектроскопия дополненный in silico работай.[2] В соответствии с описанной выше моделью углерод-углеродный длина облигации выше для антиротамера (151,4 вечера против 150). Стерическое отталкивание между атомами фтора в гош-ротамере вызывает увеличение CCF. валентные углы (на 3,2 °) и увеличенный FCCF двугранные углы (от 60 ° до 71 ° по умолчанию).
В родственном соединении 1,2-дифтор-1,2-дифенилэтан трео изомер найден (по дифракция рентгеновских лучей и из ЯМР константы связи) иметь антиконформацию между двумя фенил групп и двух групп фтора, и для обеих групп найдена гош-конформация эритро изомер.[7] В соответствии с in silico В результате эта конформация более стабильна на 0,21 ккал / моль (880 Дж / моль).
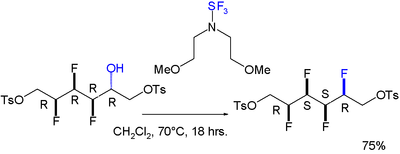
Также сообщалось о гош-эффекте для молекулы, состоящей из четырех последовательных фторзаместителей. Реакция на установку четвертого - стереоселективный:[8]
Гош-эффект также проявляется в 1,2-диметоксиэтан[нужна цитата] и некоторые вицинальные-динитроалкильные соединения.
В алкен-цис-эффект аналогичный атипичный стабилизатор некоторых алкенов.
Внешние воздействия
Гош-эффект очень чувствителен к эффекты растворителя, из-за большой разницы в полярности между двумя конформерами. Например, 2,3-динитро-2,3-диметилбутан, который в твердом состоянии существует только в гош-конформации, предпочитает гош-конформацию в бензол раствор в соотношении 79:21, но в четыреххлористый углерод он предпочитает антиконформер в соотношении 58:42.[9] Другой случай транс-1,2 дифторциклогексан, который в более полярных растворителях предпочитает диэкваториальный конформер, а не антидиаксиальный конформер.[6]
Смотрите также
Рекомендации
- ^ Флорис Аккерман, Юрген Бушманн, Дитер Ленц, Петер Люгер, Ева Рёдел (2003). «Кристаллическая и молекулярная структура 1,2-дифторэтана и 1,2-дииодэтана». Журнал химической кристаллографии. 33: 969–975. Дои:10.1023 / А: 1027494101785.CS1 maint: использует параметр авторов (связь)
- ^ а б Вклад в изучение эффекта Гоша. Полная структура антиротамера 1,2-дифторэтана. Норман К. Крейг, Энтони Чен, Ки Хван Сух, Стефан Клее, Георг К. Меллау, Бренда П. Винньюиссер и Манфред Винньюиссер Варенье. Chem. Soc.; 1997; 119 (20) pp 4789–4790; (Коммуникация) Дои:10.1021 / ja963819e
- ^ Дж., Макмерри (2012). Органическая химия (8-е изд.). Бельмонт, Калифорния: Брукс / Коул. п. 98. ISBN 9780840054449.
- ^ Мосс, GP (1996-01-01). «Базовая терминология стереохимии (Рекомендации IUPAC 1996 г.)». Чистая и прикладная химия. 68 (12): 2193–2222. Дои:10.1351 / pac199668122193. ISSN 1365-3075.
- ^ Goodman, L .; Gu, H .; Пофристик, В. .. Эффект Гоша в 1,2-дифторэтане. Гиперконъюгация, искривленные связи, стерическое отталкивание. J. Phys. Chem. А. 2005, 109, 1223–1229. Дои:10.1021 / jp046290d
- ^ а б Дэвид О'Хаган. Понимание химии фторорганических соединений. Введение в связь C – F. Chem. Soc. Ред. 2008 Дои:10.1039 / b711844a
- ^ Вицинальный дифтормотив: синтез и конформация эритро- и трео-диастереоизомеров 1,2-дифтордифенилэтанов, 2,3-дифторянтарных кислот и их производных. О'Хаган Д., Рзепа Х., Шулер М., Славин А. Журнал органической химии Байльштейна, 2006 2:19 (2 октября 2006 г.) Дои:10.1186/1860-5397-2-19
- ^ Энантиоселективный синтез четырехвицинального фтористого мотива All-syn Люк Хантер, Дэвид О'Хаган и Александра М. З. Славин Варенье. Chem. Soc.; 2006; 128 (51) pp 16422–16423; (Коммуникация) Дои:10.1021 / ja066188p
- ^ Смит, Майкл. B .; March, Advanced Organic Chemistry J. March, 5-е издание. Wiley, 2001. ISBN 0-471-58589-0