WikiDer > Реакция на омологацию - Википедия
А реакция омологации, также известный как омологизация, любой химическая реакция который превращает реагент в следующий член гомологическая серия. Гомологический ряд - это группа соединений, которые отличаются постоянной единицей, обычно (-CH2-) группа. Реагенты проходят омологация когда количество повторяющихся структурных единиц в молекулах увеличивается. Наиболее частые реакции омологации увеличивают количество метилен (-CH2-) звеньев в насыщенной цепи внутри молекулы.[1] Например, реакция альдегиды или же кетоны с диазометан или же метоксиметилентрифенилфосфин дать следующий гомолог в серии.
Примеры реакций омологации включают:
- Синтез Килиани-Фишера, где альдоза Молекула удлиняется в результате трехэтапного процесса, состоящего из:
- Нуклеофильное добавление цианида в карбонил с образованием циангидрин
- Гидролиз с образованием лактон
- Восстановление до гомологичной альдозы
- Реакция Виттига альдегида с метоксиметилентрифенилфосфин, который производит гомологичный альдегид.
- Реакция Арндта – Эйстерта представляет собой серию химических реакций, предназначенных для превращения карбоновой кислоты в гомолог высшей карбоновой кислоты (т.е. содержит один дополнительный атом углерода)
- Соответствие эфира Ковальски, альтернатива синтезу Арндта-Эйстерта. Используется для преобразования сложных эфиров β-амино из сложных эфиров α-амино через воспевать средний.[2]
- Соответствие Сейферта – Гилберта в котором альдегид превращается в концевой алкин, а затем снова гидролизуется до альдегида.
Некоторые реакции увеличивают длину цепи более чем на одну единицу. Например, считаются следующие реакции двухуглеродной гомологации.
Цепное сокращение
Таким же образом можно уменьшить длину цепи:
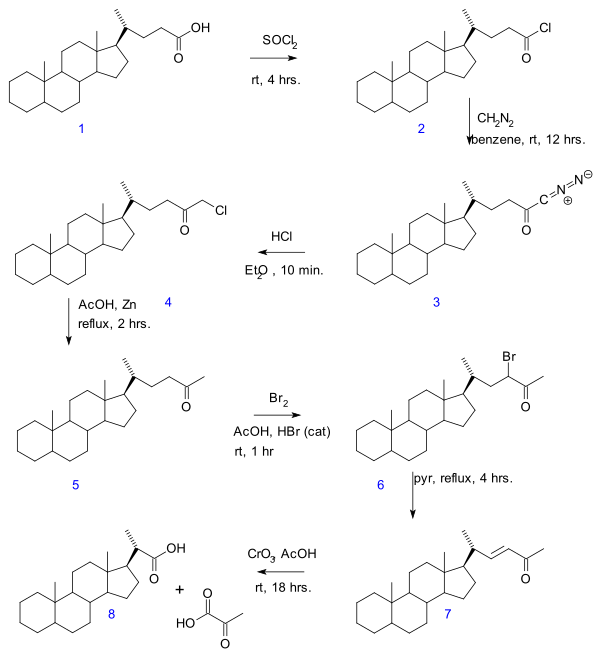
- в Деградация Галлахера-Холландера (1946) пировиноградная кислота удален из линейного алифатического карбоновая кислота давая новую кислоту с 2 атомами углерода меньше.[3] Оригинальная публикация касается преобразования желчная кислота в серии реакций: хлорангидрид (2) образование с тионилхлорид, диазокетон формирование (3) с диазометан, образование хлорметилкетона (4) с соляная кислота, органическое восстановление хлора в метилкетон (5), галогенирование кетонов к 6, реакция элиминации с пиридин к Enone 7 и, наконец, окисление с триоксид хрома к биснорхолановая кислота 8.
- в Реакция проститутки (1936) алкильная цепь в определенной нафтохинон (явление, впервые наблюдаемое в соединении лапахол) уменьшается на единицу метилен единица как углекислый газ в каждом перманганат калия окисление.[4][5]

- Механически окисление вызывает разрыв кольца в алкеновой группе, экструзию углекислый газ в декарбоксилирование с последующим закрытием кольца.
Смотрите также
Рекомендации
- ^ Энциклопедия неорганической химии Дои:10.1002 / 0470862106.id396
- ^ Д. Грей, К. Конселлон и Т. Галлахер (2004). «Гомологация эфиров Ковальски. Применение к синтезу β-аминоэфиров». J. Org. Chem. 69 (14): 4849–4851. Дои:10.1021 / jo049562h. PMID 15230615.
- ^ Винсент П. Холландер и Т. Ф. Галлахер ЧАСТИЧНЫЙ СИНТЕЗ СОЕДИНЕНИЙ, СВЯЗАННЫХ С ГОРМОНАМИ КОРОТКИ НАДПЕЧНИКА. VII. ДЕГРАДАЦИЯ БОКОВОЙ ЦЕПИ ХОЛАНИНОВОЙ КИСЛОТЫ J. Biol. Chem., Мар 1946; 162: 549 - 554 Связь
- ^ Об окислении производных 2-гидрокси-1,4-нафтохинона щелочным перманганатом калия Сэмюэл С. Хукер Варенье. Chem. Soc. 1936; 58(7); 1174-1179. Дои:10.1021 / ja01298a030
- ^ Об окислении производных 2-гидрокси-1,4-нафтохинона щелочным перманганатом калия. Часть II. Соединения с ненасыщенной стороной Цепи Сэмюэл С. Хукер и Эл Стейермарк Варенье. Chem. Soc. 1936; 58 (7); 1179 - 1181 с .; Дои:10.1021 / ja01298a031