WikiDer > Визуализация живых клеток

Визуализация живых клеток исследование живых клеток с использованием покадровая микроскопия. Он используется учеными для лучшего понимания биологических функций путем изучения динамики клеток.[1] Визуализация живых клеток была впервые применена в первом десятилетии 20-го века. Одна из первых покадровых микрокинематографических пленок клеток, когда-либо сделанных Джулиусом Райсом, демонстрирует оплодотворение и развитие морской еж яйцо.[2] С тех пор было разработано несколько методов микроскопии, которые позволяют исследователям более детально изучать живые клетки с меньшими усилиями. Новый тип визуализации с использованием квантовые точки были использованы, поскольку они показали свою более стабильную работу.[3] При разработке голотомографической микроскопии не учитывались фототоксичность и другие недостатки, связанные с окрашиванием, путем применения цифрового окрашивания на основе показателя преломления клеток.[4][5]
Обзор
Биологические системы существуют как сложное взаимодействие бесчисленных клеточные компоненты взаимодействуя в четырех измерениях, создавая явление, называемое жизнью. Хотя принято преобразовывать живые организмы в неживые образцы, чтобы приспособить традиционные инструменты статической визуализации, чем дальше образец отклоняется от естественных условий, тем более вероятно, что рассматриваемые тонкие процессы будут демонстрировать возмущения.[6] Обременительная задача запечатлеть истинное физиологический идентичность живой ткани, следовательно, требует визуализации с высоким разрешением как в пространстве, так и во времени внутри родительского организма.[7] Технологические достижения в области визуализации живых клеток, призванные обеспечить пространственно-временной изображения субклеточный событий в реальном времени, играет важную роль в подтверждении биологической значимости физиологических изменений, наблюдаемых во время экспериментов. Из-за их непрерывной связи с физиологическими условиями, анализы живых клеток считаются стандартом для исследования сложных и динамических клеточных событий.[8] Как динамические процессы, такие как миграция, развитие клеток, и внутриклеточный трафик все больше и больше становятся центром биологических исследований, методы, способные собирать трехмерные данные в реальном времени для сотовых сетей (на месте) и целые организмы (in vivo) станут незаменимыми инструментами в понимании биологических систем. Широкое признание визуализации живых клеток привело к быстрому увеличению числа практикующих врачей и установило потребность в увеличении пространственного и временного разрешения без ущерба для здоровья клетки.[9]
Типы используемых микроскопов
Фазовый контраст
До появления фазово-контрастного микроскопа было трудно наблюдать живые клетки. Поскольку живые клетки полупрозрачны, они должны быть окрашенный быть видимым в традиционном оптический микроскоп. К сожалению, процесс окрашивание клеток вообще убивает клетки. С изобретением фазово-контрастной микроскопии стало возможным детально наблюдать неокрашенные живые клетки. После его появления в 1940-х годах визуализация живых клеток быстро стала популярной с помощью фазово-контрастной микроскопии.[13] Фазово-контрастный микроскоп стал популярен благодаря серии видеороликов с интервальной съемкой (Видео 1), снятых с помощью фотопленочной камеры.[14] Его изобретатель, Фриц Зерникебыл удостоен Нобелевской премии 1953 года.[15] Другие методы более позднего фазового контраста, используемые для наблюдения за неокрашенными клетками: Модуляция Хоффмана и дифференциальная помеха контрастная микроскопия.
Флуоресцентный
Фазово-контрастная микроскопия не позволяет наблюдать определенные белки или другие органические химические соединения, которые образуют сложный механизм клетки. Синтетические и органические флуоресцентные пятна поэтому были разработаны, чтобы маркировать такие соединения, делая их наблюдаемыми с помощью флуоресцентной микроскопии (Видео 2).[16] Однако флуоресцентные пятна могут фототоксичный, инвазивный и отбеливатель при наблюдении. Это ограничивает их использование при наблюдении за живыми клетками в течение продолжительных периодов времени. Поэтому неинвазивные методы фазового контраста часто используются в качестве жизненно важного дополнения к флуоресцентной микроскопии при визуализации живых клеток.[17][18]
Количественный фазовый контраст
В результате быстрого увеличения плотности пикселей цифровые датчики изображения, количественная фазово-контрастная микроскопия стала альтернативным методом микроскопии для визуализации живых клеток.[19][20] Количественная фазово-контрастная микроскопия имеет преимущество перед флуоресцентной и фазово-контрастной микроскопией в том, что она является неинвазивной и количественной по своей природе.
Из-за узкой фокусной глубины традиционной микроскопии визуализация живых клеток в настоящее время в значительной степени ограничивается наблюдением клеток в одной плоскости. Большинство реализаций количественной фазово-контрастной микроскопии позволяют создавать изображения и фокусировать их в разных фокальных плоскостях за одну экспозицию. Это открывает в будущем возможность трехмерной визуализации живых клеток с помощью флуоресцентных методов.[21] Количественная фазово-контрастная микроскопия с ротационным сканированием позволяет получать покадровые трехмерные изображения живых клеток с высоким разрешением.[22][23][24]
Голотомография
Голотомография (HT) - это лазерный метод измерения трехмерных изображений. показатель преломления (RI) томограмма микроскопического образца, такого как биологические клетки и ткани. Поскольку RI может служить внутренним контрастом изображения для прозрачных или фазовых объектов, измерения томограмм RI могут обеспечить количественное изображение микроскопических фазовых объектов без меток. Для измерения 3-D RI томограммы образцов HT использует принцип голографической визуализации и обратного рассеяния. Обычно несколько двумерных голографических изображений образца измеряются при различных углах освещения с использованием принципа интерферометрической визуализации. Затем трехмерная томограмма RI образца восстанавливается из этих нескольких двумерных голографических изображений путем обратного решения светорассеяния в образце.
Принцип HT очень похож на рентгеновскую компьютерную томографию (КТ) или компьютерная томография. Компьютерная томография измеряет несколько двумерных рентгеновских изображений человеческого тела при разных углах освещения, а затем извлекается трехмерная томограмма (поглощающая способность рентгеновского излучения) с помощью теории обратного рассеяния. И рентгеновская КТ, и лазерная HT имеют одно и то же основное уравнение - Уравнение Гельмгольца, то волновое уравнение для монохроматической длины волны. HT также известен как оптическая дифракционная томография.
Комбинация голографии и ротационного сканирования позволяет проводить длительные записи живых клеток без этикеток.
Неинвазивная оптическая наноскопия может достичь такого латерального разрешения с помощью схемы квази-2π-голографического обнаружения и сложной деконволюции. Пространственные частоты отображаемой клетки не имеют никакого смысла для человеческого глаза. Но эти рассеянные частоты преобразуются в голограмму и синтезируют полосу пропускания, которая имеет разрешение, вдвое превышающее обычно доступное. Голограммы записываются с разных направлений освещения на плоскости образца и позволяют наблюдать субволновые томографические вариации образца. Апертуры в наномасштабе служат для калибровки томографической реконструкции и характеристики системы визуализации с помощью когерентной передаточной функции. Это приводит к реалистичной обратной фильтрации и гарантирует истинную реконструкцию комплексного поля.[25]
В заключение, две терминологии: (i) оптическое разрешение (реальное) и (ii) разрешение выборки (одно на экране) разделены для трехмерной голотомографической микроскопии.
Приборы и оптика
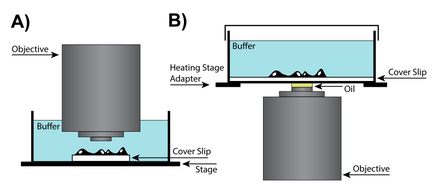
Визуализация живых клеток представляет собой тщательный компромисс между получением изображения с самым высоким разрешением и сохранением живых клеток как можно дольше.[26] В результате, микроскописты живых клеток сталкиваются с уникальным набором проблем, которые часто упускаются из виду при работе с фиксированными образцами. Более того, для получения изображений живых клеток часто используются специальные оптические системы и детекторы. Например, в идеале микроскопы, используемые для визуализации живых клеток, должны иметь высокий отношения сигнал / шум, высокая скорость получения изображений для захвата покадровое видео внеклеточных событий и поддержание долгосрочной жизнеспособности клеток.[27] Однако оптимизация даже одного аспекта получения изображения может потребовать значительных ресурсов и должна рассматриваться в индивидуальном порядке.
Дизайн линз
Малое увеличение «сухое»
В случаях, когда дополнительное пространство между задача и образец требуется для работы с образцом, может использоваться сухая линза, что потенциально может потребовать дополнительных настроек корректирующего кольца, которое изменяет положение линзы в объективе, чтобы учесть различия в камерах формирования изображений. Специальные линзы объектива имеют корректирующие кольца, которые корректируют сферические аберрации с учетом толщины покровного стекла. В сухих объективах с высокой числовой апертурой (NA) регулировочное кольцо корректирующего кольца изменяет положение группы подвижных линз, чтобы учесть различия в способе фокусировки света внешней стороной линзы относительно центра. Хотя аберрации линз присущи всем конструкциям линз, они становятся более проблематичными в сухих линзах, где сохранение разрешения является ключевым моментом.[28]
Масляная иммерсия высокая NA
Погружение в масло это метод, который может повысить разрешение изображения за счет погружения линзы и образца в масло с высоким показатель преломления. Поскольку свет изгибается при прохождении между средами с разными показателями преломления, поместив масло с тем же показателем преломления, что и стекло, между линзой и предметным стеклом, можно избежать двух переходов между показателями преломления.[29] Однако для большинства применений рекомендуется использовать масляную иммерсию для неподвижных (мертвых) образцов, поскольку живым клеткам требуется водная среда, а смешивание масла и воды может вызвать серьезные сферические аберрации. Для некоторых приложений силиконовое масло может использоваться для получения более точных реконструкций изображения. Силиконовое масло является привлекательной средой, поскольку его показатель преломления близок к показателю преломления живых клеток, что позволяет получать изображения с высоким разрешением при минимизации сферических аберраций.[28]
Погружение в воду
Для визуализации живых клеток требуется образец в водной среде, которая часто находится на расстоянии от 50 до 200 микрометров от покровного стекла. Следовательно, линзы для погружения в воду могут помочь достичь более высокой разрешающей способности благодаря тому, что и окружающая среда, и сами клетки будут близки к показателю преломления воды. Водные иммерсионные линзы совместимы с показателем преломления воды и обычно имеют корректирующую манжету, которая позволяет регулировать объектив. Кроме того, из-за более высокого показателя преломления воды иммерсионные линзы имеют высокую числовая апертура и может создавать изображения, превосходящие иммерсионные линзы при разрешении плоскостей глубиной более 0 мкм.[28]
Погружение
Еще одно решение для визуализации живых клеток - окунание линзы. Эти линзы представляют собой подмножество линз для погружения в воду, которые не требуют покровное стекло и может быть погружен непосредственно в водную среду образца. Одним из основных преимуществ погружной линзы является то, что она имеет большое эффективное рабочее расстояние.[30] Поскольку покровное стекло не требуется, линзы этого типа могут приближаться к поверхности образца, и в результате разрешение ограничивается ограничениями, налагаемыми сферической аберрацией, а не физическими ограничениями покровного стекла. Хотя погружные линзы могут быть очень полезными, они не идеальны для всех экспериментов, так как процесс «погружения» линзы может нарушить клетки в образце. Кроме того, поскольку инкубационная камера должна быть открыта для линзы, необходимо внимательно следить за изменениями в среде образца из-за испарения.[28]
Фототоксичность и фотообесцвечивание
Сегодня большинство методов визуализации живых существ основываются либо на режимах сильного освещения, либо на флуоресцентной маркировке, вызывая фототоксичность и ставя под угрозу способность сохранять клетки в спокойном состоянии и сохранять их живыми с течением времени. Поскольку наши знания биологии основаны на наблюдениях, важно минимизировать возмущения, вызванные методами визуализации.
Распространение конфокальной микроскопии тесно связано с появлением мощных лазеров, способных достигать высоких интенсивностей светового возбуждения. Однако высокая выходная мощность может повредить чувствительный флуорофоры и обычно работают значительно ниже максимальной выходной мощности.[31] Избыточное воздействие света может привести к фотоповреждению из-за фотообесцвечивание или фототоксичность. Эффекты фотообесцвечивания могут значительно снизить качество флуоресцентных изображений, и в последние годы появился значительный спрос на коммерческие флуорофоры длительного действия. Одно решение, Алекса Флуор серии, выцветание практически отсутствует даже при высокой интенсивности лазера.[32]
В физиологических условиях многие клетки и ткани подвергаются воздействию только слабого света.[33] В результате важно минимизировать воздействие на живые клетки высоких доз ультрафиолетовый (УФ), инфракрасный (ИК), или флуоресценция, возбуждающая длины волн света, которые могут повреждать ДНК, повышают температуру клеток и вызывают фотообесцвечивание соответственно.[34] Фотоны высокой энергии, поглощаемые флуорофором и образцом, излучаются на более длинных волнах, пропорциональных Стоксов сдвиг.[35] Однако клеточные органеллы могут быть повреждены, когда энергия фотона вызывает химические и молекулярные изменения, а не переизлучается.[36] Считается, что основной причиной индуцированной светом токсичности живых клеток является результат: свободные радикалы производится возбуждением флуоресцентных молекул.[33] Эти свободные радикалы обладают высокой реакционной способностью и приводят к разрушению клеточных компонентов, что может привести к нефизиологическому поведению.
Один из методов минимизации фотоповреждений - снизить концентрацию кислорода в образце, чтобы избежать образования активные формы кислорода.[37] Однако этот метод не всегда возможен при визуализации живых клеток и может потребовать дополнительного вмешательства. Еще один метод уменьшения воздействия свободных радикалов в образце - использование реагентов против тушения. К сожалению, большинство коммерческих антифадеров нельзя использовать для визуализации живых клеток из-за их токсичности.[38] Вместо этого естественные поглотители свободных радикалов, такие как витамин C или витамин Е может использоваться без существенного изменения физиологического поведения в более коротких временных масштабах.[39]Недавно была разработана и коммерциализирована визуализация живых клеток без фототоксичности. Голотомографическая микроскопия позволяет избежать фототоксичности благодаря маломощному лазеру (класс лазера 1: 0,2 мВт / мм2).[4][5][40]
Смотрите также
использованная литература
- ^ Бейкер М (август 2010 г.). «Клеточная визуализация: долгий и внимательный взгляд». Природа. 466 (7310): 1137–40. Bibcode:2010Натура.466.1137Б. Дои:10.1038 / 4661137a. PMID 20740018. S2CID 205056946.
- ^ Landecker H (октябрь 2009 г.). «Увидеть: от микрокинематографии до визуализации живых клеток». Методы природы. 6 (10): 707–09. Дои:10.1038 / nmeth1009-707. PMID 19953685. S2CID 6521488.
- ^ Джайсвал Дж. К., Голдман Э. Р., Маттусси Х., Саймон С. М. (октябрь 2004 г.). «Использование квантовых точек для визуализации живых клеток». Методы природы. 1 (1): 73–8. Дои:10.1038 / nmeth1004-73. PMID 16138413. S2CID 13339279.
- ^ а б Pollaro, L .; Equis, S .; Далла Пьяцца, Б. Котт, Ю. (2016). «Трехмерная наноскопия живых клеток без пятен». Оптик и Фотоник. 11: 38–42. Дои:10.1002 / opph.201600008.
- ^ а б Pollaro, L .; Далла Пьяцца, Б. Котт, Ю. (2015). «Цифровое окрашивание: микроскопия живых клеток без инвазивных химических веществ» (PDF). Микроскопия сегодня. 23 (4): 12–17. Дои:10.1017 / S1551929515000590.
- ^ Petroll, W. M .; Jester, J. V .; Кавана, Х. Д. (май 1994 г.). «Конфокальная визуализация in vivo: общие принципы и приложения». Сканирование. 16 (3): 131–149. ISSN 0161-0457. PMID 8038913.
- ^ Мейеринг, Эрик; Дзюбачик Олег; Смаль, Игорь (01.01.2012). Методы отслеживания клеток и частиц. Методы в энзимологии. 504. С. 183–200. Дои:10.1016 / B978-0-12-391857-4.00009-4. ISBN 9780123918574. ISSN 0076-6879. PMID 22264535.
- ^ Аллан, Виктория Дж .; Стивенс, Дэвид Дж. (2004-04-04). «Методы световой микроскопии для визуализации живых клеток». Наука. 300 (5616): 82–86. Bibcode:2003Научный ... 300 ... 82S. CiteSeerX 10.1.1.702.4732. Дои:10.1126 / science.1082160. ISSN 1095-9203. PMID 12677057. S2CID 33199613.
- ^ DanceMar. 27, янтарь; 2018; Вечер, 2:10 (27.03.2018). «Визуализация живых клеток: глубже, быстрее, шире». Наука | AAAS. Получено 2018-12-17.CS1 maint: числовые имена: список авторов (ссылка на сайт)
- ^ Мишель К. «Исторический замедленный фильм доктора Курта Мишеля, Carl Zeiss Jena (приблизительно 1943)». Библиотека Zeiss Microscopy.
- ^ фон Дассов G, Verbrugghe KJ, Миллер AL, Sider JR, Bement WM. «Клеточное деление эмбриона пурпурного ежа». The Cell - библиотека изображений.
- ^ Янике Б. «Видео с цифровой голографической микроскопии, демонстрирующее деление немеченых клеток рака молочной железы JIMT-1». The Cell - библиотека изображений.
- ^ Берджесс М. (15 октября 2003 г.). «Празднование 50-летия визуализации живых клеток» (PDF). Carl Zeiss UK и Королевское микроскопическое общество. Лондон: Биохимическое общество.
- ^ Гундлах Х. "50 лет назад: Фриц Зернике (1888-1966) получил Нобелевскую премию по физике за разработку метода фазового контраста" (PDF) (Пресс-релиз). Carl Zeiss AG. Архивировано из оригинал (PDF) 22 марта 2014 г.
- ^ "Нобелевская премия по физике 1953 г.". Nobel Media AB.
- ^ Stockert JC, Blázquez-Castro A (2017). Флуоресцентная микроскопия в науках о жизни. Издательство Bentham Science. ISBN 978-1-68108-519-7. Получено 24 декабря 2017.
- ^ Стивенс DJ, Аллан VJ (апрель 2003 г.). «Методы световой микроскопии для визуализации живых клеток». Наука. 300 (5616): 82–6. Bibcode:2003Sci ... 300 ... 82S. CiteSeerX 10.1.1.702.4732. Дои:10.1126 / science.1082160. PMID 12677057. S2CID 33199613.
- ^ Ге Дж., Вуд Д. К., Вайнгейст Д. М., Прасонгтанакий С., Навасумрит П., Ручирават М., Энгелвард Б. П. (июнь 2013 г.). «Стандартная флуоресцентная визуализация живых клеток очень генотоксична». Цитометрия. Часть А. 83 (6): 552–60. Дои:10.1002 / cyto.a.22291. ЧВК 3677558. PMID 23650257.
- ^ Парк Y, Деперсинг C, Попеску, G (2018). «Количественная фазовая визуализация в биомедицине». Природа Фотоника. 12 (10): 578–589. Bibcode:2018НаФо..12..578П. Дои:10.1038 / с41566-018-0253-х. PMID 26648557. S2CID 126144855.
- ^ Cuche E, Bevilacqua F, Depeursinge C (1999). «Цифровая голография для количественной фазово-контрастной визуализации». Письма об оптике. 24 (5): 291–293. Bibcode:1999OptL ... 24..291C. Дои:10.1364 / OL.24.000291. PMID 18071483. S2CID 38085266.
- ^ Розен Дж, Брукер Дж (2008). «Несканирующая неподвижная флуоресцентная трехмерная голографическая микроскопия». Природа Фотоника. 2 (3): 190–195. Bibcode:2008НаФо ... 2..190р. Дои:10.1038 / nphoton.2007.300. S2CID 17818065.
- ^ Воншик С, Fang-Yen C, Badizadegan K, Oh S, Lue N, Dasari R, Feld M (2007). «Томографическая фазовая микроскопия». Методы природы. 4 (9): 717–719. Дои:10.1038 / nmeth1078. PMID 17694065. S2CID 205418034.
- ^ Котт И., Той Ф, Журден П., Павильон Н., Босс Д., Магистретти П., Марке П., Деперсинг С. (2013). «Безмаркерная фазовая наноскопия». Природа Фотоника. 7 (2): 113–117. Bibcode:2013НаФо ... 7..113C. Дои:10.1038 / nphoton.2012.329. S2CID 16407188.
- ^ Pollaro L, Equis S, Dalla Piazza B, Cotte Y (2016). «Трехмерная наноскопия живых клеток без пятен». Оптик и Фотоник. Интернет-библиотека Wiley. 11: 38–42. Дои:10.1002 / opph.201600008.
- ^ Котт, Янн; Той, Фатих; Журден, Паскаль; Павильон, Николас; Босс, Дэниел; Магистретти, Пьер; Марке, Пьер; Деперсинг, Кристиан (февраль 2013 г.). «Безмаркерная фазовая наноскопия». Природа Фотоника. 7 (2): 113–117. Bibcode:2013НаФо ... 7..113C. Дои:10.1038 / nphoton.2012.329. ISSN 1749-4893.
- ^ Дженсен ЕС (январь 2013 г.). «Обзор визуализации живых клеток: требования и используемые методы». Анатомическая запись. 296 (1): 1–8. Дои:10.1002 / ar.22554. PMID 22907880. S2CID 35790454.
- ^ Уотерс JC (2013). «Флуоресцентная визуализация живых клеток». Цифровая микроскопия. Методы клеточной биологии. 114. С. 125–50. Дои:10.1016 / B978-0-12-407761-4.00006-3. ISBN 9780124077614. PMID 23931505.
- ^ а б c d Хиббс AR (2004). Конфокальная микроскопия для биологов. Нью-Йорк: Kluwer Academic / Plenum Publishers. ISBN 978-0306484681. OCLC 54424872.
- ^ Мэнсфилд С.М., Кино Г.С. (1990-12-10). «Иммерсионный твердотельный микроскоп». Письма по прикладной физике. 57 (24): 2615–2616. Bibcode:1990АпФЛ..57.2615М. Дои:10.1063/1.103828.
- ^ Келлер HE (2006), «Объективные линзы для конфокальной микроскопии», Справочник по биологической конфокальной микроскопии, Springer US, стр. 145–161, Дои:10.1007/978-0-387-45524-2_7, ISBN 9780387259215, S2CID 34412257
- ^ Amos, W.B .; Уайт, Дж. (2003-09-01). «Как конфокальный лазерный сканирующий микроскоп попал в биологические исследования». Биология клетки. 95 (6): 335–342. Дои:10.1016 / S0248-4900 (03) 00078-9. PMID 14519550. S2CID 34919506.
- ^ Андерсон Г.П., Неруркар Н.Л. (20 декабря 2002 г.). «Усовершенствованные флюороиммуноанализы с использованием красителя Alexa Fluor 647 с RAPTOR, волоконно-оптическим биосенсором 7». Журнал иммунологических методов. 271 (1–2): 17–24. Дои:10.1016 / S0022-1759 (02) 00327-7. ISSN 0022-1759. PMID 12445725.
- ^ а б Frigault MM, Lacoste J, Swift JL, Brown CM (март 2009 г.). «Микроскопия живых клеток - советы и инструменты». Журнал клеточной науки. 122 (Pt 6): 753–67. Дои:10.1242 / jcs.033837. PMID 19261845.
- ^ Магидсон В, Ходжаков А (2013). «Обход фотоповреждений в микроскопии живых клеток». Цифровая микроскопия. Методы клеточной биологии. 114. С. 545–60. Дои:10.1016 / B978-0-12-407761-4.00023-3. ISBN 9780124077614. ЧВК 3843244. PMID 23931522.
- ^ Рост FW (1992–1995). Флуоресцентная микроскопия. Кембридж: Издательство Кембриджского университета. ISBN 978-0521236416. OCLC 23766227.
- ^ Лаиссю П.П., Альгамди Р.А., Томанчак П., Рейно Э. Г., Шрофф Х. (июнь 2017 г.). «Оценка фототоксичности в живой флуоресцентной визуализации». Методы природы. 14 (7): 657–661. Дои:10.1038 / nmeth.4344. HDL:21.11116 / 0000-0002-8B80-0. PMID 28661494. S2CID 6844352.
- ^ Эттингер А., Виттманн Т. (2014). «Флуоресцентная визуализация живых клеток». Количественная визуализация в клеточной биологии. Методы клеточной биологии. 123. С. 77–94. Дои:10.1016 / B978-0-12-420138-5.00005-7. ISBN 9780124201385. ЧВК 4198327. PMID 24974023.
- ^ Поли Дж. Б. (2006). Справочник по биологической конфокальной микроскопии (3-е изд.). Нью-Йорк, штат Нью-Йорк: Спрингер. ISBN 9780387455242. OCLC 663880901.
- ^ Вату А, Метусин Н., Ясин Х.М., Усман А (2018). «Общая антиоксидантная способность и флуоресцентная визуализация отдельных листьев растений, обычно потребляемых в Брунее-Даруссаламе». Материалы конференции AIP. 1933 (1): 020001. Bibcode:2018AIPC.1933b0001W. Дои:10.1063/1.5023935.
- ^ Патрик А. Сандос, Кристофер Трембле, Себастьян Эквис, Сорин Поп, Лиза Полларо, Янн Котт, Ф. Гизу ван дер Гут, Матье Фрешин. Безмаркированный трехмерный анализ органелл в живых клетках по показателю преломления показывает пре-митотическое вращение органелл в стволовых клетках млекопитающих bioRxiv 407239; doi: https://doi.org/10.1101/407239