WikiDer > МиР-155
| Премир-155 | |
|---|---|
 pre-mir-155 вторичная структура и сохранение последовательности. | |
| Идентификаторы | |
| Символ | miR-155 |
| Рфам | RF00731 |
| Семейство miRBase | MIPF0000157 |
| Прочие данные | |
| РНК тип | микроРНК |
| Домен (ы) | Эукариоты; |
| PDB структуры | PDBe |
| МИР155 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | МИР155, MIRN155, miRNA155, mir-155, miR-155, микроРНК 155 | ||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 609337 Генные карты: МИР155 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||
| Entrez |
| ||||||||||||||||||||||||
| Ансамбль |
| ||||||||||||||||||||||||
| UniProt |
|
| |||||||||||||||||||||||
| RefSeq (мРНК) |
|
| |||||||||||||||||||||||
| RefSeq (белок) |
|
| |||||||||||||||||||||||
| Расположение (UCSC) | Chr 21: 25,57 - 25,57 Мб | н / д | |||||||||||||||||||||||
| PubMed поиск | [2] | н / д | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
МиР-155 это микроРНК что у людей кодируется МИР155 хозяин ген или же MIR155HG.[3] МиР-155 участвует в различных физиологический и патологический процессы.[4][5][6][7][8][9] Экзогенный молекулярный контроль in vivo экспрессии miR-155 может ингибировать злокачественный рост,[10][11] популярный инфекции,[12] и улучшить прогрессирование сердечно-сосудистый болезни.[13]
Открытие
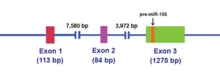
В MIR155HG изначально был определен как ген который транскрипционно активировался вставкой промотора в общий сайт интеграции ретровируса в В-клетка лимфомы и раньше назывался BIC (B-cell Integration Cluster). В MIR155HG транскрибируется РНК-полимераза II и в результате ~ 1500 нуклеотид РНК блокируется и полиаденилирован. Одноцепочечный miR-155 из 23 нуклеотидов, который находится в экзоне 3, впоследствии процессируется из исходной молекулы РНК.[14]
Биогенез
Транскрипт РНК MIR155HG не содержит длинного открытая рамка чтения (ORF), однако, он включает несовершенно спаренный по основанию стержень петля это сохраняется у разных видов.[15] Эта некодирующая РНК (нкРНК) теперь определяется как первичная миРНК (pri-miRNA).[15] После того, как miR-155 pri-miRNA транскрибируется, этот транскрипт расщепляется ядерным микропроцессорный комплекс, из которых основными компонентами являются эндонуклеаза РНКазы III типа Дроша и критическая область ДиДжорджи 8 (DGCR8) белок,[16][17] произвести 65 нуклеотидов стебель-петля предшественник miRNA (pre-mir-155) (см. рисунок 2).
После экспорта из ядра с помощью экспортина-5 молекулы pre-mir-155 расщепляются около концевой петли с помощью Дайсер приводя к дуплексам РНК из ~ 22 нуклеотидов.[16][17] После расщепления Дайсера возникает Аргонавт (Ago) белок связывается с короткими дуплексами РНК, образуя ядро многосубъединичного комплекса, называемого РНК-индуцированным комплексом сайленсинга (RISC).[18] Подобным образом миРНК дуплексы, одна из двух цепей, «пассажирская миРНК» (miR-155 *), высвобождается и деградирует, в то время как другая цепь, обозначенная как «направляющая цепь» или «зрелая миРНК» (miR-155), сохраняется внутри RISC.[18]
Недавние данные подтверждают, что оба плеча шпильки pre-miRNA могут давать зрелые miRNAs.[19][20] Из-за увеличения числа примеров, когда две функциональные зрелые miRNA обрабатываются из противоположных плеч одной и той же пре-miRNA, продукты pre-mir-155 теперь обозначаются суффиксом -5p (от 5'-плеча) (например, miR-155 -5p) и -3p (от 3'-плеча) (например, miR-155-3p) после их названия (см. Рисунок 3).[21]
Как только miR-155-5p / -3p собирается в RISC, эти молекулы впоследствии узнают свою информационную РНК-мишень (мРНК) за счет взаимодействия пар оснований между нуклеотидами 2 и 8 miR-155-5p / -3p (затравочная область) и дополнительный нуклеотидов преимущественно в 3'-нетранслируемой области (3'-UTR) мРНК (см. рис. 4 и 5 ниже).[22] Наконец, с miR-155-5p / -3p, действующим как адаптер для RISC, комплексно связанные мРНК подвергаются репрессии трансляции (то есть ингибированию перевод инициирование) и / или разложение после деаденилирования.[18]
Эволюционное сохранение
Рано филогенетический Анализы показали, что последовательность pre-mir-155 и miR-155-5p сохраняется у человека, мыши и курицы.[15] Недавние аннотированные данные секвенирования показали, что 22 различных организма, включая млекопитающих, амфибий, птиц, рептилий, морских брызг и морских миног, экспрессируют консервативную miR-155-5p.[1] В настоящее время доступно гораздо меньше данных о последовательностях miR-155-3p, поэтому неясно, насколько консервативна эта miRNA у разных видов.[2]
Распределение тканей
Нозерн-блот Анализ показал, что при-миРНК miR-155 обильно экспрессируется в селезенке и тимусе человека и обнаруживается в печени, легких и почках.[15] Впоследствии полимеразная цепная реакция (ПЦР) эксперименты продемонстрировали, что miR-155-5p обнаруживается во всех исследованных тканях человека.[23] Анализ последовательности библиотек клонов малых РНК, сравнивающий экспрессию miRNA со всеми другими исследованными системами органов, показал, что miR-155-5p была одной из пяти miRNA (т.е. miR-142, miR-144, miR-150, miR-155 и miR-223). ), специфичную для кроветворных клеток, включая В-клетки, Т-клетки, моноциты и гранулоциты.[24] Вместе эти результаты предполагают, что miR-155-5p экспрессируется в ряде тканей и типов клеток и, следовательно, может играть решающую роль в широком спектре биологических процессов, включая кроветворение [4][5][6]
Хотя очень мало исследований изучали уровни экспрессии miR-155-3p, Landgraf et al.[24] установили, что уровни экспрессии этой miRNA были очень низкими в гемопоэтических клетках. Кроме того, анализ ПЦР показал, что хотя miR-155-3p обнаруживается в ряде тканей человека, уровни экспрессии этой miRNA были в 20-200 раз меньше по сравнению с уровнями miR-155-5p.[25] Несмотря на то, что функция miR-155-3p в значительной степени игнорировалась, несколько исследований теперь показывают, что в некоторых случаях (астроциты и плазмацитоидные дендритные клетки) как miR-155-5p, так и -3p могут функционально созревать из пре-зеркалки. 155.[26][27]
Цели
Биоинформатический анализ с использованием TargetScan 6.2 (дата выпуска июнь 2012 г.) [3] выявили, что существует по крайней мере 4174 предполагаемых мишени для мРНК miR-155-5p человека, в общей сложности 918 консервативных сайтов (т.е. между мышью и человеком) и 4249 плохо консервативных сайтов (т.е. только для человека).[22][28] Хотя алгоритм TargetScan 6.2 не может быть использован для определения предполагаемых мишеней miR-155-3p, можно предположить, что эта miRNA может также потенциально регулировать экспрессию тысяч мишеней мРНК.
Недавно был составлен исчерпывающий список мишеней miR-155-5p / мРНК, которые были экспериментально подтверждены как демонстрацией регуляции эндогенного транскрипта с помощью miR-155-5p, так и проверкой посевной последовательности miR-155-5p с помощью репортерного анализа.[29] Этот список включал 140 генов и включал регуляторные белки миелопоэза и лейкемогенеза (например, КОРАБЛЬ-1, AICDA, ETS1, JARID2, SPI1и т. д.), воспаление (например, BACH1, FADD, ИКБКЕ, INPP5D, MYD88, РИПК1, SPI1, SOCSи т. д.) и известные опухолевые супрессоры (например, CEBPβ, IL17RB, PCCD4, TCF12, ZNF652, так далее.).[29] Подтвержденный сайт связывания miR-155-5p, расположенный в мРНК SPI1[30] и подтвержденный сайт связывания miR-155-3p, расположенный в мРНК IRAK3 [27] показаны на рисунках 4 и 5 соответственно.

Физиологические роли
Гемопоэз
Гемопоэз определяется как образование и развитие клеток крови, все из которых происходят из гемопоэтические стволовые клетки-предшественники (HSPC).[31] HSPC - это примитивные клетки, способные к самообновлению и первоначально дифференцироваться в общий миелоидный предшественник (CMP) или общий лимфоидный предшественник (CLP) клетки.[31] CMP представляют собой клеточную популяцию, которая превратилась в миелоидную линию, и это главное миелопоэз начинается.[31] Во время миелопоэза происходит дальнейшая клеточная дифференцировка, в том числе тромбопоэз, эритропоэз, гранулопоэз, и моноцитопоэз.[31] CLP впоследствии дифференцируются на В-клетки и Т-клетки в процессе, назначенном лимфопоэз.[31] Учитывая, что miR-155-5p экспрессируется в гемопоэтических клетках[24] было высказано предположение, что эта miRNA играет критическую роль в этих процессах клеточной дифференцировки. В поддержку этой предпосылки было обнаружено, что miR-155-5p экспрессируется в CD34 (+) HSPC человека, и было высказано предположение, что эта miRNA может удерживать эти клетки на ранней стадии стволовых клеток-предшественников, ингибируя их дифференцировку в более зрелые клетки. клеточный (т.е. мегакариоцитарный / эритроидный / гранулоцитарный / моноцитарный / B-лимфоидный / T-лимфоидный).[32] Эта гипотеза была подтверждена, когда HSPC, трансдуцированные pre-mir-155, образовали в 5 раз меньше миелоидных и в 3 раза меньше эритроидных колоний.[32] Кроме того, Hu et al.[33] продемонстрировали, что белок гомеобокса, HOXA9, регулируемый MIR155HG экспрессия в миелоидных клетках и что эта miRNA играет функциональную роль в гематопоэзе. Эти исследователи обнаружили, что форсированная экспрессия miR-155-5p в клетках костного мозга приводит к ~ 50% снижению SPI1 (т.е. PU.1),[33] а фактор транскрипции и регулятор миелопоэза,[34] и подтвержденная мишень этой miRNA.[30] Также было установлено, что in vitro дифференцировка очищенных клеток-предшественников эритроидных клеток человека приводила к прогрессивному снижению экспрессии miR-155-5p в зрелых эритроцитах.[35] Кроме того, у мышей с дефицитом pre-mir-155 наблюдались явные дефекты в развитии лимфоцитов и генерации В- и Т-клеточных ответов. in vivo.[30][36][37] Наконец, было установлено, что регуляторные Т-клетки (Tregs) для развития требовалась miR-155-5p, и было показано, что эта miRNA играет роль в гомеостазе Treg и общей выживаемости, напрямую воздействуя на SOCS1, отрицательный регулятор для Ил-2 сигнализация.[38][39] Взятые вместе, эти результаты убедительно свидетельствуют о том, что miR-155-5p является важной молекулой в контроле нескольких аспектов гематопоэза, включая миелопоэз, эритропоэз и лимфопоэз.
Иммунная система
В врожденная иммунная система составляет первую линию защиты от вторжения патогены и рассматривается как главный инициатор воспалительный ответы.[40] Его клеточная составляющая включает в первую очередь моноцит/макрофаги, гранулоциты, и дендритные клетки (ДК), которые активируются при обнаружении консервативных структур патогенов (PAMPs) рецепторами распознавания образов, такими как Толл-подобные рецепторы ((TLR)).[41] MIR155HG (т.е. miR-155-5p) экспрессия значительно усиливается за счет стимуляции макрофагов и дендритных клеток агонистами TLR.[42][43][44][45][46][47] Поскольку микробный липополисахарид (агонист TLR4) активирует цепь событий, которые приводят к стимуляции NF-κB и АП-1 факторы транскрипции,[41] было высказано предположение, что активация эндотоксином MIR155HG может опосредоваться этими факторами транскрипции.[42] В самом деле, MIR155HG Было обнаружено, что экспрессия активируется в мышиных макрофагальных клетках, обработанных LPS (например, Raw264.7), посредством механизма, опосредованного NF-κB.[43] Более того, Хеликобактер пилори заражение первичных мышей макрофаги костного мозга привело к зависимой от NF-κB активации регуляции MIR155HG.[48] В контексте вирусной инфекции вирусом везикулярного стоматита (VSV) заражение перитонеальных макрофагов мышей, как сообщается, приводит к сверхэкспрессии miR-155-5p через индуцируемый ретиноевой кислотой ген, I / JNK / NF-κB-зависимый путь.[49] Поддержка роли AP-1 в MIR155HG активация происходит в результате исследований с использованием стимулов, относящихся к вирусной инфекции, таких как лиганд TLR3 poly (I: C) или интерферон бета (IFN-β).[44] После этих стимулов AP-1, по-видимому, играет важную роль в MIR155HG активация.[44][50][51][52]
При его инициировании посредством активации, например, TLR возбудителями патогенов miR-155-5p функционирует как посттранскрипционный регулятор сигнальных путей врожденного иммунитета. Важно отметить, что miR-155-5p проявляет такую же реакцию на стимулы патогенов (например, LPS, агонист TLR4), что и мРНК основных провоспалительных маркеров.[53] После активации miR-155-5p подавляет негативные регуляторы воспаления. К ним относятся инозитолполифосфат-5-фосфатаза (INPP5D, также обозначаемая как SHIP1) и супрессор передачи сигналов цитокинов 1 (SOCS1), подавление которых способствует выживанию клеток, росту, миграции и антипатогенным ответам.[49][54][55][56] Помимо поддержки активации защитных путей miR-155-5p может также ограничивать силу результирующего NF-κB-зависимого воспалительного ответа,[53] предполагая различные функции miR-155 на разных стадиях воспаления.
Взятые вместе, эти наблюдения означают, что активация MIR155HG может быть контекстно-зависимым, учитывая, что механизмы, опосредованные AP-1 и NF-κB, регулируют экспрессию этого гена. Эти исследования также предполагают, что широкий спектр вирусных и бактериальных медиаторов воспаления может стимулировать экспрессию miR-155-5p, и указывают на тесную взаимосвязь между воспалением, врожденным иммунитетом и MIR155HG выражение.
Активность и фенотипы
Есть данные, что miR-155 участвует в каскадах, связанных с сердечно-сосудистые заболевания и гипертония, а также было установлено, что она влияет на иммунитет, геномная нестабильность, клетка дифференциация, воспаление, вирусные инфекции и рак.[нужна цитата]
Защитные роли miR-155 могут возникать в ответ на его действие на гены сайленсинга, тем самым регулируя время их экспрессии, мутации в сайте-мишени miR-155 лишает его оптимального доступа, необходимого для подавления гена, что приводит к чрезмерному количеству правонарушений, которые могут злокачественный, например, роль miR-155 в качестве защитного агента против предрасположенности к злокачественным новообразованиям, связанным с В-клетками, подчеркивается поддержанием баланса индуцированной активацией цитидиндезаминазы (ПОМОГАТЬ) фермент. MiR-155 опосредует регуляцию количества и времени экспрессии AID по иммунологическим сигналам, однако мутации в мишени на мРНК AID приводят к ее невосприимчивости к сайленсингу miR-155 и приводят к необузданной экспрессии его белка, вызывая всплески диких незрелых B-лимфоцитов и AID- опосредованный хромосомные транслокации.[5][6]
Клиническое значение
Сердечно-сосудистые
Трансфекция miR-155 в первичные фибробласты легких человека снижает эндогенную экспрессию ангиотензин II рецептор AT1R белок. Кроме того, AT1R опосредует связанное с ангиотензином II повышение артериального давления и вносит вклад в патогенез сердечной недостаточности. Нарушение функции miR-155 может быть связано с гипертония и сердечно-сосудистые заболевания, если цис-регуляторный сайт на 3` UTR AT1R (целевой сайт miR-155) был затронут из-за Полиморфизм SNP в самом AT1R. Эта мутация нарушает нацеливание miR-155 и, таким образом, предотвращает подавление экспрессии AT1R.[5] При низком кровяном давлении избыточная экспрессия miR-155 коррелирует с нарушением активности AT1R.[4]
Иммунитет
miR-155 участвует в иммунитете, играя ключевую роль в модуляции гуморальных и врожденных клеточно-опосредованных иммунных ответов, например, у мышей с дефицитом miR-155 иммунологическая память нарушена; делая его жертвой повторяющихся приступов вторжений одного и того же патогена (Rodriguez et al. 2007), созревание и специфичность miR-155-дефицитных B-лимфоцитов нарушаются, так как процесс зависит от фермента AID, который имеет мишень miR-155 в его конец 3 'UTR.[5][6] Фенотипические последствия, связанные с дефицитом miR-155 у мышей, проявляются в более позднем возрасте, когда у животных развиваются легкие и кишечник. поражения.[4]
Активированные В- и Т-клетки демонстрируют повышенную экспрессию miR-155, то же самое касается макрофаги и дендритные клетки из иммунная система. MiR-155 имеет решающее значение для правильного развития и созревания лимфоцитов. Подробности различных проявлений уровней miR-155 и участия в деятельности, определяющей оптимальные иммунные ответы, были предметом многих исследований:
Снижение IgG1
Дефектные Т- и В-клетки, а также заметно уменьшились IgG1 ответы наблюдались у мышей с дефицитом miR-155, IgG1 снижен, тогда как экспрессия IgM иммуноглобулин остается нормальным у этих мышей. Изменение уровня IgG1 может быть объяснено тем фактом, что он является мишенью для miR-155 в В-клетках, мРНК, кодирующей белок для регулятора транскрипции. Pu.1-белок, повышение уровня белка Pu.1 предрасполагает к нарушению выработки IgG1. Помимо Pu.1, имеется около 60 других дифференциально повышенных генов в miR-155-дефицитных B-клетках, дальнейшее изучение выявило возможные сайты-мишени miR-155 в 3'-UTR областях этих генов.[6]
Лимфоцитарные злокачественные новообразования
Зрелые рецепторы близость и специфичность лимфоцитов к патогенным агентам лежит в основе правильных иммунных ответов, оптимальная координация miR-155 требуется для производства нормальных B-лимфоцитов, продукции высокоаффинных антител и балансировки передачи сигналов BCR. Было продемонстрировано, что miR-155 может передаваться через щелевые контакты от лейкозных клеток к здоровым В-клеткам и способствовать их трансформации в опухолеподобные клетки. [57]
Отбор компетентных В-клеток происходит в зародышевый центр там, где их обучают дифференцировать клетки тела от чужеродных антигенов, они соревнуются за распознавание антигена и за помощь Т-лимфоцитов, таким способом избирательного давления на те В-клетки, которые продемонстрировали высокоаффинные рецепторы и сотрудничество с Т-клетками (созревание аффинности) набираются и отправляются в костный мозг или становятся В-клетками памяти, прекращение апоптоза имеет место для тех В-клеток, которые не выдерживают конкуренции. Незрелые В-клетки с дефицитом miR-155 избегают апоптоза в результате повышенного Белок Bcl-2 уровни; белок, который, как было установлено, участвует в злокачественных новообразованиях В-клеток и контролируется miR-155.[6]
Воспаление
Воспалительные реакции на триггеры, такие как TNF-α вовлекают макрофаги с компонентами, которые включают miR-155. miR-155 сверхэкспрессируется при атопическом дерматите и способствует хроническому воспалению кожи, увеличивая пролиферативный ответ T (H) -клеток за счет подавления CTLA-4.[58] В Аутоиммунные расстройства Например, при ревматоидном артрите miR-155 обнаруживает более высокую экспрессию в тканях пациентов и синовиальных фибробластах.[4] При рассеянном склерозе повышенная экспрессия mir-155 также была измерена в периферических и резидентных миелоидных клетках ЦНС, включая моноциты циркулирующей крови и активированную микроглию.[59] Также было обнаружено, что mir-155 участвует в воспалении. Избыточная экспрессия mir-155 приведет к хроническому воспалительному состоянию у человека.[60]
ДНК-вирусы
В ДНК-вирусы, miRNAs были экспериментально подтверждены, miRNA в вирусах кодируются dsDNA,[5] примеры таких вирусов включают герпесвирусы такие как Вирус Человека-Эпштейна-Барра (EBV) и аденовирусы,[4] другим вирусом, экспрессирующим miR-155-подобную miRNA у кур, является онкогенный MDV-1, неонкогенный родственник которого MDV-2 не обладает, это предполагает участие miR-155 в лимфомагенезе.[5]Вирусы могут использовать миРНК хозяина в той степени, в которой они используют миРНК хозяина для кодирования вирусных клонов, например: miR-K12-11 в Герпесвирус, ассоциированный с саркомой Капоши имеет целевой регион специфичности ортологичный к таковому из miR-155; имитирует действие miR-155 [61] и, разделяя с ним мишени, таким образом, можно думать, что он подавляет доступность miR-155 к своим мишеням за счет конкуренции, и это, по сути, подавляет экспрессию генов, играющих роль в клеточном росте и апоптозе, таким образом, который не поддается регулированию miR-155.[4]EBV модулирует экспрессию miR-155 хозяина, которая необходима для роста В-клеток, инфицированных EBV.[62] Клетки, инфицированные EBV, обладают повышенной экспрессией miR-155, что нарушает равновесие экспрессии генов, регулирующих транскрипцию в этих клетках.[4][5]
Рак
Чрезмерное молчание с помощью miR-155 может привести к запуску онкогенных каскадов, которые начинаются с резистентности к апоптозу, проапоптотического ядерного белка, индуцированного Tumor Protein-531 (TP53INP1) подавляется miR-155, сверхэкспрессия miR-155 приводит к снижению уровней TP53INP1 в протоке поджелудочной железы. аденокарциномы и, возможно, в других эпителиальных раках, где активность TP53INP1 теряется, что приводит к уклонению от апоптоза и неконтролируемым приступам роста.[5]
Инактивация восстановления несоответствия ДНК (MMR), что определяется увеличением частоты мутаций, является причиной Синдром Линча (LS), также известный как наследственный неполипозный колоректальный рак (HNPCC), подавление белка, контролирующего MMR, осуществляется за счет сверхэкспрессии miR-155, MMR контролируется группой консервативных белков, что приводит к снижению активности этих белков. в повышенных уровнях мутаций в фенотипе, запускающих марш к развитию этого типа рака.[63]
К другим типам опухолей, в которых сообщалось о сверхэкспрессии miR-155, относятся: карцинома щитовидной железы, рак груди, рак толстой кишки, рак шейки матки и рак легких, где выделяется miR-155. профили выражения количественная оценка потенциально может служить сигналами для обнаружения опухоли и оценки результатов прогноза.[4] Анализ показывает, что экспрессия miR-155 связана с выживаемостью при тройном отрицательном раке молочной железы.[64]
Примечания
Версия этой статьи 2012 года была обновлена внешним экспертом в соответствии с моделью двойной публикации. Соответствующие академическая экспертная оценка статья была опубликована в Ген и может быть процитирован как: Терри С. Элтон; Хелина Селемон; Шейн М. Элтон; Нарасимхам Л. Паринанди (14 декабря 2012 г.), «Регулирование гена-хозяина MIR155 в физиологических и патологических процессах», Ген, 532 (1): 1–12, Дои:10.1016 / J.GENE.2012.12.009, ISSN 0378-1119, PMID 23246696, Викиданные Q34318174 |
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000283904 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Энтрез Джин: MIR155HG".
- ^ а б c d е ж грамм час я Фараони I, Антонетти FR, Cardone J, Bonmassar E (июнь 2009 г.). «Ген miR-155: типичная многофункциональная микроРНК» (PDF). Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1792 (6): 497–505. Дои:10.1016 / j.bbadis.2009.02.013. PMID 19268705.
- ^ а б c d е ж грамм час я Teng G, Papavasiliou FN (март 2009 г.). "Шшш! Выключение микрофона с помощью микроРНК-155". Философские труды Лондонского королевского общества. Серия B, Биологические науки. 364 (1517): 631–637. Дои:10.1098 / rstb.2008.0209. ЧВК 2660923. PMID 19008191.
- ^ а б c d е ж Calame K (декабрь 2007 г.). «Функция MicroRNA-155 в B-клетках». Иммунитет. 27 (6): 825–827. Дои:10.1016 / j.immuni.2007.11.010. PMID 18093533.
- ^ Тили Э, Кроче СМ, Мишай Дж.Дж. (2009). «miR-155: на стыке воспаления и рака». Международные обзоры иммунологии. 28 (5): 264–284. Дои:10.1080/08830180903093796. PMID 19811312. S2CID 205589961.
- ^ О'Коннелл Р.М., Рао Д.С., Балтимор Д. (2012). «МикроРНК регуляция воспалительных реакций». Ежегодный обзор иммунологии. 30: 295–312. Дои:10.1146 / аннурев-иммунол-020711-075013. PMID 22224773.
- ^ Элтон Т.С., Селемон Х., Элтон С.М., Паринанди Н.Л. (декабрь 2013 г.). «Регулирование гена хозяина MIR155 в физиологических и патологических процессах». Ген. 532 (1): 1–12. Дои:10.1016 / j.gene.2012.12.009. PMID 23246696.
- ^ Маттиске С., Суетани Р.Дж., Нилсен П.М., Каллен Д.Ф. (август 2012 г.). «Онкогенная роль miR-155 при раке груди». Эпидемиология, биомаркеры и профилактика рака. 21 (8): 1236–1243. Дои:10.1158 / 1055-9965.EPI-12-0173. PMID 22736789.
- ^ Бабар И.А., Ченг СиДжей, Бут СиДжей, Лян Х, Вейдхаас Дж.Б., Зальцман В.М., Slack FJ (июнь 2012 г.). «Терапия на основе наночастиц на in vivo microRNA-155 (miR-155) -зависимой мышиной модели лимфомы». Труды Национальной академии наук Соединенных Штатов Америки. 109 (26): E1695–1704. Дои:10.1073 / pnas.1201516109. ЧВК 3387084. PMID 22685206.
- ^ Ван Л., Туми Н. Л., Диас Л. А., Уокер Дж., Рамос Дж. К., Парикмахер Г. Н., Нин С. (август 2011 г.). «Онкогенные IRF обеспечивают преимущество в выживаемости для клеток, трансформированных вирусом Эпштейна-Барра или вирусом Т-клеточного лейкоза человека типа 1, посредством индукции экспрессии BIC». Журнал вирусологии. 85 (16): 8328–8337. Дои:10.1128 / JVI.00570-11. ЧВК 3147954. PMID 21680528.
- ^ Corsten MF, Papageorgiou A, Verhesen W, Carai P, Lindow M, Obad S, Summer G, Coort SL, Hazebroek M, van Leeuwen R, Gijbels MJ, Wijnands E, Biessen EA, De Winther MP, Stassen FR, Carmeliet P, Кауппинен С., Шроен Б., Хейманс С. (август 2012 г.). «Профилирование микроРНК определяет микроРНК-155 как неблагоприятного медиатора сердечного повреждения и дисфункции во время острого вирусного миокардита». Циркуляционные исследования. 111 (4): 415–425. Дои:10.1161 / CIRCRESAHA.112.267443. PMID 22715471.
- ^ Eis PS, Tam W, Sun L, Chadburn A, Li Z, Gomez MF, Lund E, Dahlberg JE (март 2005 г.). «Накопление miR-155 и BIC РНК в В-клеточных лимфомах человека». Труды Национальной академии наук Соединенных Штатов Америки. 102 (10): 3627–3632. Bibcode:2005PNAS..102.3627E. Дои:10.1073 / pnas.0500613102. ЧВК 552785. PMID 15738415.
- ^ а б c d Tam W (август 2001 г.). «Идентификация и характеристика человеческого BIC, гена на хромосоме 21, который кодирует некодирующую РНК». Ген. 274 (1–2): 157–167. Дои:10.1016 / S0378-1119 (01) 00612-6. PMID 11675008.
- ^ а б Ким В.Н., Хан Дж., Сиоми МС (февраль 2009 г.). «Биогенез малых РНК у животных». Обзоры природы Молекулярная клеточная биология. 10 (2): 126–139. Дои:10.1038 / nrm2632. PMID 19165215. S2CID 8360619.
- ^ а б Krol J, Loedige I, Filipowicz W (сентябрь 2010 г.). «Распространенная регуляция биогенеза, функции и распада микроРНК». Природа Обзоры Генетика. 11 (9): 597–610. Дои:10.1038 / nrg2843. PMID 20661255. S2CID 2619579.
- ^ а б c Fabian MR, Sonenberg N (июнь 2012 г.). «Механика опосредованного miRNA сайленсинга генов: взгляд изнутри miRISC». Структурная и молекулярная биология природы. 19 (6): 586–593. Дои:10.1038 / nsmb.2296. PMID 22664986. S2CID 13176647.
- ^ Бушати Н., Коэн С.М. (2007). «Функции микроРНК». Ежегодный обзор клеточной биологии и биологии развития. 23: 175–205. Дои:10.1146 / annurev.cellbio.23.090506.123406. PMID 17506695.
- ^ Филипович В., Бхаттачарья С.Н., Соненберг Н. (февраль 2008 г.). «Механизмы посттранскрипционной регуляции микроРНК: есть ли ответы?». Природа Обзоры Генетика. 9 (2): 102–114. Дои:10.1038 / nrg2290. PMID 18197166. S2CID 11824239.
- ^ Гриффитс-Джонс S (январь 2004 г.). «Реестр микроРНК». Исследования нуклеиновых кислот. 32 (Выпуск базы данных): D109–11. Дои:10.1093 / нар / gkh023. ЧВК 308757. PMID 14681370.
- ^ а б Friedman RC, Farh KK, Burge CB, Bartel DP (январь 2009 г.). «Большинство мРНК млекопитающих являются консервативными мишенями для микроРНК». Геномные исследования. 19 (1): 92–105. Дои:10.1101 / гр.082701.108. ЧВК 2612969. PMID 18955434.
- ^ Мартин М.М., Ли Э.Дж., Бакенбергер Дж.А., Шмитген Т.Д., Элтон Т.С. (июль 2006 г.). «МикроРНК-155 регулирует экспрессию рецептора ангиотензина II типа 1 человека в фибробластах». Журнал биологической химии. 281 (27): 18277–18284. Дои:10.1074 / jbc.M601496200. PMID 16675453.
- ^ а б c Ландграф П., Русу М., Шеридан Р., Канализация А, Иовино Н., Аравин А., Пфеффер С., Райс А, Камфорст А.О., Ландталер М., Лин С, Соччи Н.Д., Гермида Л., Фульчи В., Кьяретти С., Фоа Р., Шливка Дж. , Fuchs U, Novosel A, Müller RU, Schermer B, Bissels U, Inman J, Phan Q, Chien M, Weir DB, Choksi R, De Vita G, Frezzetti D, Trompeter HI, Hornung V, Teng G, Hartmann G, Палковиц М., Ди Лауро Р., Вернет П., Мачино Дж., Роглер К. Э., Нэгл Дж. В., Джу Дж., Папавасилиу Ф. Н., Бенцинг Т., Лихтер П., Там В., Браунштейн М.Дж., Босио А., Боркхард А., Руссо Дж. M, Tuschl T (июнь 2007 г.). «Атлас экспрессии микроРНК млекопитающих на основе секвенирования библиотеки малых РНК». Клетка. 129 (7): 1401–1414. Дои:10.1016 / j.cell.2007.04.040. ЧВК 2681231. PMID 17604727.
- ^ Элтон Т.С., Сансом С.Е., Мартин М.М. (2010). «Сверхэкспрессия miRNA гена трисомии-21 приводит к гаплонедостаточности конкретных белков-мишеней». РНК Биология. 7 (5): 540–547. Дои:10.4161 / rna.7.5.12685. ЧВК 3073250. PMID 21081842.
- ^ Тарасишин Л., Лоудиг О., Бауман А., Шафит-Загардо Б., Сух Х.С., Ли С.К. (декабрь 2011 г.). «Фактор регуляции интерферона 3 подавляет экспрессию воспалительного гена астроцитов посредством подавления провоспалительных miR-155 и miR-155 *». Глия. 59 (12): 1911–1922. Дои:10.1002 / glia.21233. ЧВК 3241213. PMID 22170100.
- ^ а б Чжоу Х, Хуан Х, Цуй Х, Ло Х, Тан И, Чен С., Ву Л, Шен Н. (декабрь 2010 г.). «miR-155 и его звездообразный партнер miR-155 * кооперативно регулируют продукцию интерферона I типа плазматическими дендритными клетками человека». Кровь. 116 (26): 5885–5894. Дои:10.1182 / blood-2010-04-280156. PMID 20852130.
- ^ Льюис Б.П., Burge CB, Bartel DP (январь 2005 г.). «Консервативное спаривание семян, часто фланкированное аденозинами, указывает на то, что тысячи человеческих генов являются мишенями для микроРНК». Клетка. 120 (1): 15–20. Дои:10.1016 / j.cell.2004.12.035. PMID 15652477. S2CID 17316349.
- ^ а б Neilsen PM, Noll JE, Mattiske S, Bracken CP, Gregory PA, Schulz RB, Lim SP, Kumar R, Suetani RJ, Goodall GJ, Callen DF (июнь 2013 г.). «Мутантный p53 управляет инвазией в опухолях груди за счет активации miR-155». Онкоген. 32 (24): 2992–3000. Дои:10.1038 / onc.2012.305. PMID 22797073.
- ^ а б c Вигорито Э., Перкс К.Л., Абреу-Гуджер С., Бантинг С., Сян З., Кольхаас С., Дас П.П., Миска Э.А., Родригес А., Брэдли А., Смит К.Г., Рада С., Энрайт А.Дж., Толлнер К.М., Макленнан И.С., Тернер М. ( Декабрь 2007 г.). «микроРНК-155 регулирует образование плазматических клеток с переключением класса иммуноглобулинов». Иммунитет. 27 (6): 847–859. Дои:10.1016 / j.immuni.2007.10.009. ЧВК 4135426. PMID 18055230.
- ^ а б c d е Mayani H (март 2010 г.). «Биологические различия между неонатальными и взрослыми человеческими гемопоэтическими стволовыми / предшественниками клетками». Стволовые клетки и развитие. 19 (3): 285–298. Дои:10.1089 / scd.2009.0327. PMID 19778207.
- ^ а б Георгантас Р.В., Хилдрет Р., Моризот С., Олдер Дж., Лю К.Г., Хеймфельд С., Калин Г.А., Кроче С.М., Сивин С.И. (февраль 2007 г.). "Экспрессия и функция микроРНК CD34 + гемопоэтических стволовых клеток-предшественников: принципиальная схема контроля дифференцировки". Труды Национальной академии наук Соединенных Штатов Америки. 104 (8): 2750–2755. Bibcode:2007PNAS..104.2750G. Дои:10.1073 / pnas.0610983104. ЧВК 1796783. PMID 17293455.
- ^ а б Ху Ю.Л., Фонг С., Ларгман С., Шен В.Ф. (сентябрь 2010 г.). «HOXA9 регулирует miR-155 в гемопоэтических клетках». Исследования нуклеиновых кислот. 38 (16): 5472–5478. Дои:10.1093 / nar / gkq337. ЧВК 2938212. PMID 20444872.
- ^ Кастнер П., Чан С. (2008). «PU.1: решающий и разносторонний игрок в гемопоэзе и лейкемии». Международный журнал биохимии и клеточной биологии. 40 (1): 22–27. Дои:10.1016 / j.biocel.2007.01.026. PMID 17374502.
- ^ Масаки С., Оцука Р., Абэ Й, Мута К., Умемура Т. (декабрь 2007 г.). «Паттерны экспрессии микроРНК 155 и 451 во время нормального эритропоэза человека». Сообщения о биохимических и биофизических исследованиях. 364 (3): 509–514. Дои:10.1016 / j.bbrc.2007.10.077. PMID 17964546.
- ^ Родригес А., Вигорито Е., Клэр С., Уоррен М. В., Кутте П., Сонд Д. Р., ван Донген С., Грокок Р. Дж., Дас П. П., Миска Е. А., Ветри Д., Оккенхауг К., Энрайт А. Дж., Дуган Г., Тернер М., Брэдли А. (апр. 2007). «Потребность в bic / microRNA-155 для нормальной иммунной функции». Наука. 316 (5824): 608–611. Bibcode:2007Научный ... 316..608R. Дои:10.1126 / science.1139253. ЧВК 2610435. PMID 17463290.
- ^ Thai TH, Calado DP, Casola S, Ansel KM, Xiao C, Xue Y, Murphy A, Frendewey D, Valenzuela D, Kutok JL, Schmidt-Supprian M, Rajewsky N, Yancopoulos G, Rao A, Rajewsky K (апрель 2007 г.) . «Регулирование ответа зародышевого центра с помощью микроРНК-155». Наука. 316 (5824): 604–608. Bibcode:2007Наука ... 316..604Т. Дои:10.1126 / science.1141229. PMID 17463289. S2CID 8174458.
- ^ Kohlhaas S, Garden OA, Scudamore C, Turner M, Okkenhaug K, Vigorito E (март 2009 г.). «Передний край: miR-155-мишень Foxp3 способствует развитию регуляторных Т-клеток». Журнал иммунологии. 182 (5): 2578–2582. Дои:10.4049 / jimmunol.0803162. PMID 19234151.
- ^ Лу LF, Thai TH, Calado DP, Chaudhry A, Kubo M, Tanaka K, Loeb GB, Lee H, Yoshimura A, Rajewsky K, Rudensky AY (январь 2009 г.). «Foxp3-зависимая микроРНК155 придает конкурентную способность регуляторным Т-клеткам за счет воздействия на белок SOCS1». Иммунитет. 30 (1): 80–91. Дои:10.1016 / j.immuni.2008.11.010. ЧВК 2654249. PMID 19144316.
- ^ Меджитов Р. (март 2010 г.). «Воспаление 2010: новые приключения старого пламени». Клетка. 140 (6): 771–776. Дои:10.1016 / j.cell.2010.03.006. PMID 20303867. S2CID 10297400.
- ^ а б Такеда К., Акира С. (январь 2005 г.). «Толл-подобные рецепторы врожденного иммунитета». Международная иммунология. 17 (1): 1–14. Дои:10.1093 / intimm / dxh186. PMID 15585605.
- ^ а б Таганов К.Д., Болдин М.П., Чанг К.Дж., Балтимор Д. (август 2006 г.). «NF-kappaB-зависимая индукция микроРНК miR-146, ингибитора, нацеленного на сигнальные белки врожденных иммунных ответов». Труды Национальной академии наук Соединенных Штатов Америки. 103 (33): 12481–12486. Bibcode:2006ПНАС..10312481Т. Дои:10.1073 / pnas.0605298103. ЧВК 1567904. PMID 16885212.
- ^ а б Тили Э., Мишай Дж. Дж., Чимино А., Костинян С., Думитру С. Д., Адаир Б., Фаббри М., Альдер Х., Лю К. Г., Калин Г. А., Кроче С. М. (октябрь 2007 г.). «Модуляция уровней miR-155 и miR-125b после стимуляции липополисахаридом / TNF-альфа и их возможная роль в регулировании ответа на эндотоксиновый шок». Журнал иммунологии. 179 (8): 5082–5089. Дои:10.4049 / jimmunol.179.8.5082. PMID 17911593.
- ^ а б c О'Коннелл Р.М., Таганов К.Д., Болдин М.П., Ченг Г., Балтимор Д. (январь 2007 г.). «МикроРНК-155 индуцируется во время воспалительной реакции макрофагов». Труды Национальной академии наук Соединенных Штатов Америки. 104 (5): 1604–1609. Bibcode:2007PNAS..104.1604O. Дои:10.1073 / pnas.0610731104. ЧВК 1780072. PMID 17242365.
- ^ Сеппи М., Перейра П.М., Дунанд-Сотье И., Баррас Э., Райт В., Сантос М.А., Пьер П. (февраль 2009 г.). «МикроРНК-155 модулирует путь передачи сигнала интерлейкина-1 в активированных дендритных клетках человека, происходящих из моноцитов». Труды Национальной академии наук Соединенных Штатов Америки. 106 (8): 2735–2740. Bibcode:2009PNAS..106.2735C. Дои:10.1073 / pnas.0811073106. ЧВК 2650335. PMID 19193853.
- ^ Cremer TJ, Ravneberg DH, Clay CD, Piper-Hunter MG, Marsh CB, Elton TS, Gunn JS, Amer A, Kanneganti TD, Schlesinger LS, Butchar JP, Tridandapani S (2009). «Индукция MiR-155 F. novicida, но не вирулентным F. tularensis, приводит к подавлению SHIP-регуляции и усилению провоспалительного цитокинового ответа». PLOS ONE. 4 (12): e8508. Bibcode:2009PLoSO ... 4.8508C. Дои:10.1371 / journal.pone.0008508. ЧВК 2794384. PMID 20041145.
- ^ Мао С.П., Хе Л., Цай Ю.С., Пэн С., Кан ТХ, Панг Х, Мони А., Хунг К.Ф., Ву ТК (2011). «Экспрессия микроРНК-155 in vivo влияет на антиген-специфические Т-клеточные иммунные ответы, генерируемые ДНК-вакцинацией». Cell & Bioscience. 1 (1): 3. Дои:10.1186/2045-3701-1-3. ЧВК 3116247. PMID 21711593.
- ^ Кох М., Молленкопф Х. Дж., Клемм У., Мейер Т.Ф. (май 2012 г.). «Индукция микроРНК-155 зависит от системы секреции TLR и типа IV в макрофагах и подавляет апоптоз, вызванный повреждением ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 109 (19): E1153–1162. Дои:10.1073 / pnas.1116125109. ЧВК 3358876. PMID 22509021.
- ^ а б Ван П, Хоу Дж, Линь Л., Ван С, Лю Х, Ли Д., Ма Ф, Ван З, Цао Х (ноябрь 2010 г.). «Индуцируемая обратная связь микроРНК-155 способствует передаче сигналов IFN типа I в противовирусном врожденном иммунитете путем нацеливания на супрессор передачи сигналов цитокинов 1». Журнал иммунологии. 185 (10): 6226–6233. Дои:10.4049 / jimmunol.1000491. PMID 20937844.
- ^ Тили Э., Мишай Дж. Дж., Адаир Б., Олдер Х, Лимань Э, Такчиоли С., Феррацин М., Дельмас Д., Латруфф Н., Кроче С. М. (сентябрь 2010 г.). «Ресвератрол снижает уровни miR-155 за счет активации miR-663, микроРНК, нацеленной на JunB и JunD». Канцерогенез. 31 (9): 1561–1566. Дои:10.1093 / carcin / bgq143. ЧВК 4647642. PMID 20622002.
- ^ McCoy CE, Sheedy FJ, Qualls J.E., Doyle SL, Quinn SR, Murray PJ, O'Neill LA (июль 2010 г.). «IL-10 ингибирует индукцию miR-155 толл-подобными рецепторами». Журнал биологической химии. 285 (27): 20492–20498. Дои:10.1074 / jbc.M110.102111. ЧВК 2898307. PMID 20435894.
- ^ Ruggiero T, Trabucchi M, De Santa F, Zupo S, Harfe BD, McManus MT, Rosenfeld MG, Briata P, Gherzi R (сентябрь 2009 г.). «ЛПС индуцирует регуляторный белок-зависимый процессинг сплайсинга KH-типа предшественников микроРНК-155 в макрофагах». Журнал FASEB. 23 (9): 2898–2908. Дои:10.1096 / fj.09-131342. PMID 19423639. S2CID 588328.
- ^ а б Шульте Л.Н., Вестерманн А.Дж., Фогель Дж. (Январь 2013 г.). «Дифференциальная активация и функциональная специализация miR-146 и miR-155 в восприятии врожденного иммунитета». Исследования нуклеиновых кислот. 41 (1): 542–553. Дои:10.1093 / нар / гкс1030. ЧВК 3592429. PMID 23143100.
- ^ Андрулидаки А., Илиопулос Д., Арранс А., Доксаки С., Шворер С., Захариоудаки В., Маргиорис А. Н., Цихлис П. Н., Цацанис С. (август 2009 г.). «Киназа Akt1 контролирует ответ макрофагов на липополисахарид, регулируя микроРНК». Иммунитет. 31 (2): 220–231. Дои:10.1016 / j.immuni.2009.06.024. ЧВК 2865583. PMID 19699171.
- ^ О'Коннелл Р.М., Чаудхури А.А., Рао Д.С., Балтимор Д. (апрель 2009 г.). «Инозитолфосфатаза SHIP1 является основной мишенью miR-155». Труды Национальной академии наук Соединенных Штатов Америки. 106 (17): 7113–7118. Bibcode:2009PNAS..106.7113O. Дои:10.1073 / pnas.0902636106. ЧВК 2678424. PMID 19359473.
- ^ Костинян С., Сандху С.К., Педерсен И.М., Тили Э., Тротта Р., Перротти Д., Чиарлариелло Д., Невиани П., Харб Дж., Кауфман Л. Р., Шидхам А., Кроче С. М. (август 2009 г.). «Инозитол-5-фосфатаза, содержащая домен Src homology 2, и белок бета, связывающий энхансер CCAAT, нацелены на miR-155 в B-клетках трансгенных мышей Emicro-MiR-155». Кровь. 114 (7): 1374–1382. Дои:10.1182 / кровь-2009-05-220814. ЧВК 2727407. PMID 19520806.
- ^ Несмиянов П., Стрыгин А., Толкачев Б., Капланов К., Доценко А., Стрыгина А. (2016). «Транзит mIRNA-155 через щелевые контакты способствует прогрессированию ХЛЛ». 14-е ежегодное совещание CIMT «Механизмы эффективности в иммунотерапии рака», Майнц, Германия, 2016 г..
- ^ Сонколи Э, Янсон П., Маджури М.Л., Савинко Т., Фирквист Н, Эйдсмо Л., Сюй Н., Мейсген Ф, Вей Т., Брэдли М., Стенванг Дж., Кауппинен С., Алениус Х, Лауэрма А., Хоми Б., Винквист О, Стахле М. , Pivarcsi A (сентябрь 2010 г.). «MiR-155 сверхэкспрессируется у пациентов с атопическим дерматитом и модулирует пролиферативные ответы Т-клеток, воздействуя на цитотоксический антиген 4, связанный с Т-лимфоцитами». Журнал аллергии и клинической иммунологии. 126 (3): 581–589.e1–20. Дои:10.1016 / j.jaci.2010.05.045. PMID 20673989.
- ^ Moore CS, Rao VT, Durafourt BA, Bedell BJ, Ludwin SK, Bar-Or A, Antel JP (ноябрь 2013 г.). «miR-155 как релевантный для рассеянного склероза регулятор поляризации миелоидных клеток». Анналы неврологии. 74 (5): 709–720. Дои:10.1002 / ana.23967. PMID 23818336. S2CID 205344718.
- ^ О'Коннелл Р.М., Рао Д.С., Балтимор Д. (2012). «МикроРНК регуляция воспалительных реакций». Ежегодный обзор иммунологии. 30: 295–312. Дои:10.1146 / аннурев-иммунол-020711-075013. PMID 22224773.
- ^ Скальский Р.Л., Самолс М.А., Плезанс КБ, Босс И.В., Рива А., Лопес М.С., Бейкер Х.В., Ренне Р. (декабрь 2007 г.). «Связанный с саркомой герпесвирус Капоши кодирует ортолог miR-155». Журнал вирусологии. 81 (23): 12836–12845. Дои:10.1128 / JVI.01804-07. ЧВК 2169101. PMID 17881434.
- ^ Linnstaedt SD, Gottwein E, Skalsky RL, Luftig MA, Cullen BR (ноябрь 2010 г.). «Вирусно-индуцированная клеточная микроРНК miR-155 играет ключевую роль в иммортализации В-клеток вирусом Эпштейна-Барра». Журнал вирусологии. 84 (22): 11670–11678. Дои:10.1128 / JVI.01248-10. ЧВК 2977875. PMID 20844043.
- ^ Валери Н., Гаспарини П., Фаббри М., Бракони К., Веронезе А., Ловат Ф, Адаир Б., Ваннини И., Фанини Ф., Боттони А., Костинян С., Сандху С.К., Нуово Г.Дж., Ольха Х, Гафа Р., Калор Ф, Феррацин М. , Lanza G, Volinia S, Negrini M, McIlhatton MA, Amadori D, Fishel R, Croce CM (апрель 2010 г.). «Модуляция репарации несовпадений и стабильности генома с помощью miR-155». Труды Национальной академии наук Соединенных Штатов Америки. 107 (15): 6982–6987. Bibcode:2010ПНАС..107.6982В. Дои:10.1073 / pnas.1002472107. ЧВК 2872463. PMID 20351277.
- ^ Ланцки, Андраш; Надь, Адам; Боттаи, Джулия; Мункачи, Дьёнджи; Сабо, Андраш; Сантарпиа, Либеро; Дьёрфи, Балаж (01.12.2016). «miRpower: веб-инструмент для проверки миРНК, связанных с выживанием, с использованием данных экспрессии от 2178 пациентов с раком груди». Исследования и лечение рака груди. 160 (3): 439–446. Дои:10.1007 / s10549-016-4013-7. ISSN 1573-7217. PMID 27744485. S2CID 11165696.
дальнейшее чтение
- Бентвич I, Авниэль А., Каров Ю., Ахаронов Р., Гилад С., Барад О., Барзилай А., Эйнат П., Эйнав Ю., Мейри Е., Шарон Е., Спектор И., Бентвич З. (июль 2005 г.). «Идентификация сотен консервативных и неконсервативных микроРНК человека». Природа Генетика. 37 (7): 766–770. Дои:10,1038 / ng1590. PMID 15965474. S2CID 7746954.
- Хуан Р.С., Ху GQ, Линь Б., Линь З.Й., Сунь CC (декабрь 2010 г.). «Подавление звука MicroRNA-155 усиливает воспалительный ответ и захват липидов в окисленных липопротеинах низкой плотности-стимулированных макрофагами человека THP-1». Журнал следственной медицины. 58 (8): 961–967. Дои:10.2310 / jim.0b013e3181ff46d7. PMID 21030878. S2CID 83123221.
- Ceolotto G, Papparella I, Bortoluzzi A, Strapazzon G, Ragazzo F, Bratti P, Fabricio AS, Squarcina E, Gion M, Palatini P, Semplicini A (февраль 2011 г.). «Взаимодействие между miR-155, полиморфизмом AT1R A1166C и экспрессией AT1R у молодых нелеченных гипертоников». Американский журнал гипертонии. 24 (2): 241–246. Дои:10.1038 / ajh.2010.211. PMID 20966899.
- Ван Г., Там Л.С., Ли Е.К., Кван BC, Чоу К.М., Лук С.К., Ли П.К., Сзето С.К. (декабрь 2010 г.). «Бесклеточные MiR-146a и MiR-155 в сыворотке и моче у пациентов с системной красной волчанкой». Журнал ревматологии. 37 (12): 2516–2522. Дои:10.3899 / jrheum.100308. PMID 20952466. S2CID 23208771.
- Kutty RK, Nagineni CN, Samuel W, Vijayasarathy C, Hooks JJ, Redmond TM (ноябрь 2010 г.). «Воспалительные цитокины регулируют экспрессию микроРНК-155 в клетках пигментного эпителия сетчатки человека путем активации пути JAK / STAT». Сообщения о биохимических и биофизических исследованиях. 402 (2): 390–395. Дои:10.1016 / j.bbrc.2010.10.042. ЧВК 2992362. PMID 20950585.
- Имаидзуми Т, Танака Х, Тадзима А, Йоконо Й, Мацумия Т, Йошида Х, Цуруга К., Аидзава-Ясиро Т, Хаякари Р., Иноуэ I, Ито Э, Сато К. (2010). «IFN-γ и TNF-α синергетически индуцируют микроРНК-155, которая регулирует экспрессию TAB2 / IP-10 в мезангиальных клетках человека». Американский журнал нефрологии. 32 (5): 462–468. Дои:10.1159/000321365. PMID 20948191. S2CID 12859943.
- Thompson RC, Herscovitch M, Zhao I., Ford TJ, Gilmore TD (январь 2011 г.). «NF-kappaB подавляет экспрессию маркера CD10 В-лимфомы через путь miR-155 / PU.1». Журнал биологической химии. 286 (3): 1675–1682. Дои:10.1074 / jbc.M110.177063. ЧВК 3023462. PMID 20947507.
- Ван П, Хоу Дж, Линь Л., Ван С, Лю Х, Ли Д., Ма Ф, Ван З, Цао Х (ноябрь 2010 г.). «Индуцируемая обратная связь микроРНК-155 способствует передаче сигналов IFN типа I в противовирусном врожденном иммунитете путем нацеливания на супрессор передачи сигналов цитокинов 1». Журнал иммунологии. 185 (10): 6226–6233. Дои:10.4049 / jimmunol.1000491. PMID 20937844.
- О'Коннелл Р.М., Кан Д., Гибсон В.С., Раунд JL, Шольц Р.Л., Чаудхури А.А., Кан М.Э., Рао Д.С., Балтимор Д. (октябрь 2010 г.). «MicroRNA-155 способствует аутоиммунному воспалению за счет усиления развития воспалительных Т-клеток». Иммунитет. 33 (4): 607–619. Дои:10.1016 / j.immuni.2010.09.009. ЧВК 2966521. PMID 20888269.
- Ся QS, Исигаки Y, Чжао X, Шимасаки Т., Накадзима Х., Накагава Х., Такегами Т., Чен Чж, Мотоо Y (январь 2011 г.). «Человеческий SMG-1 участвует в индуцированной гемцитабином первичной микроРНК-155 / BIC-регуляции в клетках PANC-1 рака поджелудочной железы человека». Поджелудочная железа. 40 (1): 55–60. Дои:10.1097 / MPA.0b013e3181e89f74. PMID 20871480. S2CID 39789659.
- Чжоу Х, Хуан Х, Цуй Х, Ло Х, Тан Й, Чен С., Ву Л, Шен Н. (декабрь 2010 г.). «miR-155 и его звездообразный партнер miR-155 * кооперативно регулируют продукцию интерферона I типа плазматическими дендритными клетками человека». Кровь. 116 (26): 5885–5894. Дои:10.1182 / blood-2010-04-280156. PMID 20852130.
- Линнштадт С.Д., Готвейн Э., Скальски Р.Л., Луфтиг М.А., Каллен Б.Р. (ноябрь 2010 г.). «Вирусно-индуцированная клеточная микроРНК miR-155 играет ключевую роль в иммортализации В-клеток вирусом Эпштейна-Барра». Журнал вирусологии. 84 (22): 11670–11678. Дои:10.1128 / JVI.01248-10. ЧВК 2977875. PMID 20844043.
- Чжэн Л., Сюй С.К., Чен В.Д., Шен В.Л., Жуань С.К., Чжу Л.М., Чжу Д.Л., Гао П.Дж. (октябрь 2010 г.). «МикроРНК-155 регулирует экспрессию рецептора ангиотензина II типа 1 и фенотипическую дифференциацию в адвентициальных фибробластах сосудов». Сообщения о биохимических и биофизических исследованиях. 400 (4): 483–488. Дои:10.1016 / j.bbrc.2010.08.067. PMID 20735984.
- Тили Э., Мишай Дж. Дж., Адаир Б., Олдер Х, Лимань Э, Такчиоли С., Феррацин М., Дельмас Д., Латруфф Н., Кроче С. М. (сентябрь 2010 г.). «Ресвератрол снижает уровни miR-155 за счет активации miR-663, микроРНК, нацеленной на JunB и JunD». Канцерогенез. 31 (9): 1561–1566. Дои:10.1093 / carcin / bgq143. ЧВК 4647642. PMID 20622002.
- Бош-Саадатманди C, Лобода A, Вагнер AE, Стахурска A, Jozkowicz A, Dulak J, Döring F, Wolffram S, Rimbach G (март 2011 г.). «Влияние кверцетина и его метаболитов изорамнетина и кверцетин-3-глюкуронида на экспрессию воспалительных генов: роль miR-155». Журнал пищевой биохимии. 22 (3): 293–299. Дои:10.1016 / j.jnutbio.2010.02.008. PMID 20579867.
- Лю Дж., Ван Мил А., Врийсен К., Чжао Дж., Гао Л., Мец СН, Гуманс М.Дж., Доевенданс ПА, Слуиджтер Дж. П. (июль 2011 г.). «МикроРНК-155 предотвращает некротическую гибель клеток-предшественников кардиомиоцитов человека посредством нацеливания на RIP1». Журнал клеточной и молекулярной медицины. 15 (7): 1474–1482. Дои:10.1111 / j.1582-4934.2010.01104.x. ЧВК 3823192. PMID 20550618.
- Погрибный И.П., Старлард-Давенпорт А., Трындяк В.П., Хан Т., Росс С.А., Русин I, Беланд Ф.А. (октябрь 2010 г.). «Разница в экспрессии печеночных микроРНК miR-29c, miR-34a, miR-155 и miR-200b связана со штамм-специфической восприимчивостью мышей к диетическому неалкогольному стеатогепатиту». Лабораторные исследования. 90 (10): 1437–1446. Дои:10.1038 / labinvest.2010.113. ЧВК 4281935. PMID 20548288.
- Чжан И, Дяо З, Су Л, Сун Х, Ли Р, Цуй Х, Ху Й (май 2010 г.). «MicroRNA-155 способствует преэклампсии, подавляя CYR61». Американский журнал акушерства и гинекологии. 202 (5): 466.e1–7. Дои:10.1016 / j.ajog.2010.01.057. PMID 20452491.
- Ху Ю.Л., Фонг С., Ларгман С., Шен В.Ф. (сентябрь 2010 г.). «HOXA9 регулирует miR-155 в гемопоэтических клетках». Исследования нуклеиновых кислот. 38 (16): 5472–5478. Дои:10.1093 / nar / gkq337. ЧВК 2938212. PMID 20444872.
- McCoy CE, Sheedy FJ, Qualls J.E., Doyle SL, Quinn SR, Murray PJ, O'Neill LA (июль 2010 г.). «IL-10 ингибирует индукцию miR-155 толл-подобными рецепторами». Журнал биологической химии. 285 (27): 20492–20498. Дои:10.1074 / jbc.M110.102111. ЧВК 2898307. PMID 20435894.
- Yin Q, Wang X, Fewell C, Cameron J, Zhu H, Baddoo M, Lin Z, Flemington EK (июль 2010 г.). «МикроРНК miR-155 ингибирует передачу сигналов костного морфогенетического белка (BMP) и реактивацию BMP-опосредованного вируса Эпштейна-Барра». Журнал вирусологии. 84 (13): 6318–6327. Дои:10.1128 / JVI.00635-10. ЧВК 2903268. PMID 20427544.
- Чжу Дж., Ху XQ, Го ГЛ, Чжан И, Ван О.К., Ю Дж, Хуан К.Д., Чжан XH (февраль 2010 г.). «[Экспрессия и ее клиническое значение miR-155 при первичном раке груди человека]». Чжунхуа Вай Кэ Дза Чжи [Китайский журнал хирургии]. 48 (3): 205–208. PMID 20388420.
- Kong W, He L, Coppola M, Guo J, Esposito NN, Coppola D, Cheng JQ (июнь 2010 г.). «MicroRNA-155 регулирует выживаемость, рост и химиочувствительность клеток, воздействуя на FOXO3a при раке груди». Журнал биологической химии. 285 (23): 17869–17879. Дои:10.1074 / jbc.M110.101055. ЧВК 2878550. PMID 20371610.
- Ся QS, Исигаки Ю., Сун Л., Чен Р., Мотоу И. (январь 2010 г.). «[Влияние противораковых препаратов на экспрессию BIC / miR-155 в клетках рака поджелудочной железы человека PANC-1]». Чжунхуа И Сюэ За Чжи. 90 (2): 123–127. PMID 20356498.
- Цзян С., Чжан Х.В., Лу М.Х., Хе ХХ, Ли И, Гу Х, Лю М.Ф., Ван Э.Д. (апрель 2010 г.). «MicroRNA-155 действует как OncomiR при раке груди, воздействуя на супрессор цитокинового гена, передающего сигнал». Исследования рака. 70 (8): 3119–3127. Дои:10.1158 / 0008-5472.CAN-09-4250. PMID 20354188.
- Рю Дж. К., Хонг С. М., Карикари КА, Хрубан Р. Х., Гоггинс М. Г., Майтра А. (2010). «Аберрантная экспрессия MicroRNA-155 является ранним событием в многоэтапном прогрессировании аденокарциномы поджелудочной железы». Панкреатология. 10 (1): 66–73. Дои:10.1159/000231984. ЧВК 2865485. PMID 20332664.
- Fabani MM, Abreu-Goodger C, Williams D, Lyons PA, Torres AG, Smith KG, Enright AJ, Gait MJ, Vigorito E (июль 2010 г.). «Эффективное ингибирование функции miR-155 in vivo пептидными нуклеиновыми кислотами». Исследования нуклеиновых кислот. 38 (13): 4466–4475. Дои:10.1093 / nar / gkq160. ЧВК 2910044. PMID 20223773.
- Тан Б., Сяо Б., Лю Цзы, Ли Н, Чжу Э.Д., Ли Б.С., Се К.Х., Чжуан Ю., Цзоу К.М., Мао XH (апрель 2010 г.). «Идентификация MyD88 как новой мишени для miR-155, участвующей в негативной регуляции воспаления, вызванного Helicobacter pylori». Письма FEBS. 584 (8): 1481–1486. Дои:10.1016 / j.febslet.2010.02.063. PMID 20219467. S2CID 41984991.
- Фасси Фери Л., Кох М., Белоголова Е., Халил Х., Больц С., Калали Б., Молленкопф Х. Дж., Бейджье-Бомпадре М., Карлас А., Шнайдер Т., Чурин Ю., Герхард М., Мейер Т.Ф. (2010). «Helicobacter pylori индуцирует miR-155 в Т-клетках цАМФ-Foxp3-зависимым образом». PLOS ONE. 5 (3): e9500. Bibcode:2010PLoSO ... 5.9500F. Дои:10.1371 / journal.pone.0009500. ЧВК 2830477. PMID 20209161.
- Сидоркевич М., Грек М., Йозвяк Б., Майда-Станиславска Е., Пекарска А., Бартковяк Дж. (2010). «Экспрессия предшественника микроРНК-155 в мононуклеарных клетках периферической крови пациентов с гепатитом С после противовирусного лечения». Acta Virologica. 54 (1): 75–78. Дои:10.4149 / av_2010_01_75. PMID 20201617.
- Гета К., Молоцкий Н., Герчиков Н., Мор Э, Савион С., Фейн А., Тодер В., Шомрон Н., Торчинский А. (2010). «Тератоген-индуцированные изменения в экспрессии микроРНК-34, микроРНК-125b и микроРНК-155: корреляция с генотипом эмбриона р53 и фенотипом конечностей». Биология развития BMC. 10: 20. Дои:10.1186 / 1471-213X-10-20. ЧВК 2841584. PMID 20170545.
- Рай Д., Ким С.В., Маккеллер М.Р., Дахия П.Л., Агияр Р.К. (февраль 2010 г.). «Нацеливание на SMAD5 связывает микроРНК-155 с путем TGF-бета и лимфомагенезом». Труды Национальной академии наук Соединенных Штатов Америки. 107 (7): 3111–3116. Bibcode:2010PNAS..107.3111R. Дои:10.1073 / pnas.0910667107. ЧВК 2840369. PMID 20133617.
- Cremer TJ, Ravneberg DH, Clay CD, Piper-Hunter MG, Marsh CB, Elton TS, Gunn JS, Amer A, Kanneganti TD, Schlesinger LS, Butchar JP, Tridandapani S (2009). «Индукция MiR-155 F. novicida, но не вирулентным F. tularensis, приводит к подавлению SHIP-регуляции и усилению провоспалительного цитокинового ответа». PLOS ONE. 4 (12): e8508. Bibcode:2009PLoSO ... 4.8508C. Дои:10.1371 / journal.pone.0008508. ЧВК 2794384. PMID 20041145.
- Forrest AR, Kanamori-Katayama M, Tomaru Y, Lassmann T, Ninomiya N, Takahashi Y, de Hoon MJ, Kubosaki A, Kaiho A, Suzuki M, Yasuda J, Kawai J, Hayashizaki Y, Hume DA, Suzuki H (февраль 2010 г.) ). «Индукция микроРНК, mir-155, mir-222, mir-424 и mir-503, способствует дифференцировке моноцитов посредством комбинаторной регуляции». Лейкемия. 24 (2): 460–466. arXiv:1007.2689. Дои:10.1038 / leu.2009.246. PMID 19956200. S2CID 2333658.
- Педерсен И.М., Отеро Д., Као Э., Милетик А.В., Хотер С., Ральфкиер Э., Рикерт Р.С., Гронбек К., Дэвид М. (август 2009 г.). «Onco-miR-155 нацелен на SHIP1, чтобы способствовать TNF-зависимому росту В-клеточных лимфом». EMBO Молекулярная медицина. 1 (5): 288–295. Дои:10.1002 / emmm.200900028. ЧВК 2771872. PMID 19890474.
- Хэ М., Сюй З., Дин Т., Куанг Д.М., Чжэн Л. (октябрь 2009 г.). «МикроРНК-155 регулирует продукцию воспалительных цитокинов в опухоль-ассоциированных макрофагах посредством нацеливания на C / EBPbeta». Клеточная и молекулярная иммунология. 6 (5): 343–352. Дои:10,1038 / cmi.2009.45. ЧВК 4003217. PMID 19887047.
- Тили Э, Кроче СМ, Мишай Дж.Дж. (2009). «miR-155: на стыке воспаления и рака». Международные обзоры иммунологии. 28 (5): 264–284. Дои:10.1080/08830180903093796. PMID 19811312. S2CID 205589961.
- Шталь Х.Ф., Фаути Т., Ульрих Н., Бопп Т., Кубах Дж., Руст В., Лабхарт П., Алексиадис В., Беккер С., Хафнер М., Вейт А., Лентер М.С., Йонулейт Х., Шмитт Е., Меннерих Д. (2009). «Ингибирование miR-155 сенсибилизирует CD4 + Th-клетки для подавления, опосредованного TREG». PLOS ONE. 4 (9): e7158. Bibcode:2009PLoSO ... 4.7158S. Дои:10.1371 / journal.pone.0007158. ЧВК 2743997. PMID 19777054.
- Bolisetty MT, Dy G, Tam W, Beemon KL (декабрь 2009 г.). «Штамм вируса ретикулоэндотелиоза T индуцирует miR-155, который нацелен на JARID2 и способствует выживанию клеток». Журнал вирусологии. 83 (23): 12009–12017. Дои:10.1128 / JVI.01182-09. ЧВК 2786729. PMID 19759154.
- Ван Б., Маджумдер С., Нуово Г., Кутай Х., Волиния С., Патель Т., Шмитген Т.Д., Кроче С., Гошал К., Джейкоб С.Т. (октябрь 2009 г.). «Роль микроРНК-155 на ранних стадиях гепатоканцерогенеза, индуцированного холин-дефицитной и определенной аминокислотой диетой у мышей C57BL / 6». Гепатология. 50 (4): 1152–1161. Дои:10.1002 / hep.23100. ЧВК 2757532. PMID 19711427.
- Pottier N, Maurin T, Chevalier B, Puisségur MP, Lebrigand K, Robbe-Sermesant K, Bertero T, Lino Cardenas CL, Courcot E, Rios G, Fourre S, Lo-Guidice JM, Marcet B, Cardinaud B, Barbry P, Мари Б (2009). «Идентификация фактора роста кератиноцитов как мишени для микроРНК-155 в фибробластах легких: участие в эпителиально-мезенхимальных взаимодействиях». PLOS ONE. 4 (8): e6718. Bibcode:2009PLoSO ... 4.6718P. Дои:10.1371 / journal.pone.0006718. ЧВК 2726943. PMID 19701459.
- Сяо Б., Лю З., Ли Б.С., Тан Б., Ли В., Го Г, Ши И, Ван Ф, Ву И, Тонг В.Д., Гуо Х., Мао XH, Цзоу QM (сентябрь 2009 г.). «Индукция микроРНК-155 во время инфекции Helicobacter pylori и ее отрицательная регулирующая роль в воспалительной реакции». Журнал инфекционных болезней. 200 (6): 916–925. Дои:10.1086/605443. PMID 19650740.
- Ворм Дж., Стенванг Дж., Петри А., Фредериксен К.С., Обад С., Элмен Дж., Хедтъярн М., Страаруп Е.М., Хансен Дж. Б., Кауппинен С. (сентябрь 2009 г.). «Замалчивание микроРНК-155 у мышей во время острой воспалительной реакции приводит к дерепрессии c / ebp Beta и подавлению G-CSF». Исследования нуклеиновых кислот. 37 (17): 5784–5792. Дои:10.1093 / нар / gkp577. ЧВК 2761263. PMID 19596814.
- Костинян С., Сандху С.К., Педерсен И.М., Тили Э., Тротта Р., Перротти Д., Чиарлариелло Д., Невиани П., Харб Дж., Кауфман Л. Р., Шидхам А., Кроче С. М. (август 2009 г.). «Инозитол-5-фосфатаза, содержащая домен Src homology 2, и белок бета, связывающий энхансер CCAAT, нацелены на miR-155 в B-клетках трансгенных мышей Emicro-MiR-155». Кровь. 114 (7): 1374–1382. Дои:10.1182 / кровь-2009-05-220814. ЧВК 2727407. PMID 19520806.
- Ruggiero T, Trabucchi M, De Santa F, Zupo S, Harfe BD, McManus MT, Rosenfeld MG, Briata P, Gherzi R (сентябрь 2009 г.). «ЛПС индуцирует регуляторный белок-зависимый процессинг сплайсинга KH-типа предшественников микроРНК-155 в макрофагах». Журнал FASEB. 23 (9): 2898–2908. Дои:10.1096 / fj.09-131342. PMID 19423639. S2CID 588328.
- Мартинес-Нуньес RT, Луафи Ф., Фридманн П.С., Санчес-Эльснер Т. (июнь 2009 г.). «МикроРНК-155 модулирует способность дендритных клеток (ДК) связывать патогены путем подавления ДК-специфической молекулы-3 межклеточной адгезии, захватывающей неинтегрин (DC-SIGN)». Журнал биологической химии. 284 (24): 16334–16342. Дои:10.1074 / jbc.M109.011601. ЧВК 2713543. PMID 19386588.
- О'Коннелл Р.М., Чаудхури А.А., Рао Д.С., Балтимор Д. (апрель 2009 г.). «Инозитолфосфатаза SHIP1 является основной мишенью miR-155». Труды Национальной академии наук Соединенных Штатов Америки. 106 (17): 7113–7118. Bibcode:2009PNAS..106.7113O. Дои:10.1073 / pnas.0902636106. ЧВК 2678424. PMID 19359473.
- Kohlhaas S, Garden OA, Scudamore C, Turner M, Okkenhaug K, Vigorito E (март 2009 г.). «Передний край: miR-155-мишень Foxp3 способствует развитию регуляторных Т-клеток». Журнал иммунологии. 182 (5): 2578–2582. Дои:10.4049 / jimmunol.0803162. PMID 19234151.
- Сеппи М., Перейра П.М., Дунанд-Сотье И., Баррас Э., Рейт В., Сантос М.А., Пьер П. (февраль 2009 г.). «МикроРНК-155 модулирует путь передачи сигнала интерлейкина-1 в активированных дендритных клетках человека, происходящих из моноцитов». Труды Национальной академии наук Соединенных Штатов Америки. 106 (8): 2735–2740. Bibcode:2009PNAS..106.2735C. Дои:10.1073 / pnas.0811073106. ЧВК 2650335. PMID 19193853.
- Habbe N, Koorstra JB, Mendell JT, Offerhaus GJ, Ryu JK, Feldmann G, Mullendore ME, Goggins MG, Hong SM, Maitra A (февраль 2009 г.). «МикроРНК miR-155 - биомаркер ранней неоплазии поджелудочной железы». Биология и терапия рака. 8 (4): 340–346. Дои:10.4161 / cbt.8.4.7338. ЧВК 2692997. PMID 19106647.
- Юнг И., Агияр RC (январь 2009 г.). «Экспрессия MicroRNA-155 и исход при диффузной большой B-клеточной лимфоме». Британский журнал гематологии. 144 (1): 138–140. Дои:10.1111 / j.1365-2141.2008.07424.x. ЧВК 4654117. PMID 19016736.
- Румыния П., Лулли В., Пелоси Е., Биффони М., Пешле С., Марциали Г. (ноябрь 2008 г.). «МикроРНК 155 модулирует мегакариопоэз на уровне предшественников и предшественников, воздействуя на факторы транскрипции Ets-1 и Meis1». Британский журнал гематологии. 143 (4): 570–580. Дои:10.1111 / j.1365-2141.2008.07382.x. PMID 18950466. S2CID 9025761.
- Чжао Й, Яо Й, Сюй Х, Ламбет Л., Смит Л. П., Кгосана Л., Ван Х, Наир В. (январь 2009 г.). «Функциональный ортолог MicroRNA-155, кодируемый онкогенным вирусом болезни Марека». Журнал вирусологии. 83 (1): 489–492. Дои:10.1128 / JVI.01166-08. ЧВК 2612317. PMID 18945769.
- Гатто Г., Росси А., Росси Д., Кроенинг С., Бонатти С., Маллардо М. (ноябрь 2008 г.). «Латентный мембранный белок 1 вируса Эпштейна-Барра трансактивирует транскрипцию miR-155 через путь NF-kappaB». Исследования нуклеиновых кислот. 36 (20): 6608–6619. Дои:10.1093 / nar / gkn666. ЧВК 2582607. PMID 18940871.
- Рахадиани Н., Такакува Т., Треснасари К., Мори Е., Аозаса К. (декабрь 2008 г.). «Латентный мембранный белок-1 вируса Эпштейна-Барра индуцирует экспрессию кластера интеграции В-клеток, предшественника микроРНК-155, в клеточных линиях В-лимфомы». Сообщения о биохимических и биофизических исследованиях. 377 (2): 579–583. Дои:10.1016 / j.bbrc.2008.10.007. PMID 18926796.
- Конг В., Ян Х., Хе Л., Чжао Дж. Дж., Коппола Д., Далтон В. С., Ченг Дж. К. (ноябрь 2008 г.). «MicroRNA-155 регулируется путем трансформирующего фактора роста бета / Smad и способствует пластичности эпителиальных клеток, воздействуя на RhoA». Молекулярная и клеточная биология. 28 (22): 6773–6784. Дои:10.1128 / MCB.00941-08. ЧВК 2573297. PMID 18794355.
- Лу Ф., Вайдмер А., Лю К.Г., Волиния С., Кроче С.М., Либерман П.М. (ноябрь 2008 г.). «Вызванная вирусом Эпштейна-Барра miR-155 ослабляет передачу сигналов NF-kappaB и стабилизирует латентную устойчивость вируса». Журнал вирусологии. 82 (21): 10436–10443. Дои:10.1128 / JVI.00752-08. ЧВК 2573162. PMID 18753206.
- Дорсетт Y, Макбрайд К.М., Янкович М., Газумян А., Тай TH, Роббиани Д.Ф., Ди Вирджилио М., Рейна Сан-Мартин Б., Хайдкамп Г., Швикерт Т.А., Айзенрайх Т., Раевски К., Нуссенцвейг М.С. «MicroRNA-155 подавляет вызванную активацией цитидиндезаминазу-опосредованную транслокацию Myc-Igh». Иммунитет. 28 (5): 630–638. Дои:10.1016 / j.immuni.2008.04.002. ЧВК 2713656. PMID 18455451.
- Teng G, Hakimpour P, Landgraf P, Rice A, Tuschl T., Casellas R, Papavasiliou FN (май 2008 г.). «МикроРНК-155 - негативный регулятор цитидиндезаминазы, индуцированной активацией». Иммунитет. 28 (5): 621–629. Дои:10.1016 / j.immuni.2008.03.015. ЧВК 2430982. PMID 18450484.
- Инь Кью, Макбрайд Дж., Фьюэлл К., Лейси М., Ван Х, Линь З., Кэмерон Дж., Флемингтон Э.К. (июнь 2008 г.). «МикроРНК-155 представляет собой индуцированный вирусом Эпштейна-Барр ген, который модулирует пути экспрессии генов, регулируемые вирусом Эпштейна-Барра». Журнал вирусологии. 82 (11): 5295–5306. Дои:10.1128 / JVI.02380-07. ЧВК 2395216. PMID 18367535.
- Чжан Т., Не К., Там В. (сентябрь 2008 г.). «BIC эффективно преобразуется в микроРНК-155 в клетках лимфомы Беркитта». Лейкемия. 22 (9): 1795–1797. Дои:10.1038 / leu.2008.62. PMID 18354490.
- Ван М., Тан Л.П., Дейкстра М.К., ван Лом К., Робертус Дж.Л., Хармс Дж., Блокзейл Т., Куистра К., ван Тверь МБ, Розати С., Виссер Л., Йонген-Лавренчич М., Клюин П.М., ван ден Берг А. ( Май 2008 г.). «Анализ miRNA при В-клеточном хроническом лимфоцитарном лейкозе: центры пролиферации, характеризующиеся низкой экспрессией miR-150 и высокой экспрессией BIC / miR-155». Журнал патологии. 215 (1): 13–20. Дои:10.1002 / путь.2333. PMID 18348159. S2CID 29470560.
- О'Коннелл Р.М., Рао Д.С., Чаудхури А.А., Болдин М.П., Таганов К.Д., Николл Дж., Пакетт Р.Л., Балтимор Д. (март 2008 г.). «Устойчивая экспрессия микроРНК-155 в гемопоэтических стволовых клетках вызывает миелопролиферативное расстройство». Журнал экспериментальной медицины. 205 (3): 585–594. Дои:10.1084 / jem.20072108. ЧВК 2275382. PMID 18299402.
- Рай Д., Каранти С., Юнг И., Дахия П.Л., Агияр Р.К. (февраль 2008 г.). «Скоординированная экспрессия микроРНК-155 и предсказанные гены-мишени в диффузной большой B-клеточной лимфоме». Генетика и цитогенетика рака. 181 (1): 8–15. Дои:10.1016 / j.cancergencyto.2007.10.008. ЧВК 2276854. PMID 18262046.
- Gottwein E, Mukherjee N, Sachse C, Frenzel C, Majoros WH, Chi JT, Braich R, Manoharan M, Soutschek J, Ohler U, Cullen BR (декабрь 2007 г.). «Вирусная микроРНК действует как ортолог клеточной miR-155». Природа. 450 (7172): 1096–1099. Bibcode:2007 Натур.450.1096G. Дои:10.1038 / природа05992. ЧВК 2614920. PMID 18075594.
- Вигорито Э., Перкс К.Л., Абреу-Гуджер С., Бантинг С., Сян З., Кольхаас С., Дас П.П., Миска Э.А., Родригес А., Брэдли А., Смит К.Г., Рада С., Энрайт А.Дж., Толлнер К.М., Макленнан И.С., Тернер М. ( Декабрь 2007 г.). «микроРНК-155 регулирует образование плазматических клеток с переключением класса иммуноглобулинов». Иммунитет. 27 (6): 847–859. Дои:10.1016 / j.immuni.2007.10.009. ЧВК 4135426. PMID 18055230.
- Инь Кью, Ван Х, Макбрайд Дж., Фьюэлл С., Флемингтон Э. (февраль 2008 г.). «Активация В-клеточного рецептора вызывает экспрессию BIC / miR-155 через консервативный элемент AP-1». Журнал биологической химии. 283 (5): 2654–2662. Дои:10.1074 / jbc.M708218200. ЧВК 2810639. PMID 18048365.
- Тили Э., Мишай Дж. Дж., Чимино А., Костинян С., Думитру С. Д., Адаир Б., Фаббри М., Альдер Х., Лю К. Г., Калин Г. А., Кроче С. М. (октябрь 2007 г.). «Модуляция уровней miR-155 и miR-125b после стимуляции липополисахаридом / TNF-альфа и их возможная роль в регулировании ответа на эндотоксиновый шок». Журнал иммунологии. 179 (8): 5082–5089. Дои:10.4049 / jimmunol.179.8.5082. PMID 17911593.
- Gironella M, Seux M, Xie MJ, Cano C, Tomasini R, Gommeaux J, Garcia S, Nowak J, Yeung ML, Jeang KT, Chaix A, Fazli L, Motoo Y, Wang Q, Rocchi P, Russo A, Gleave M , Дагорн Дж. К., Иованна Дж. Л., Перевозчик А, Пебуск MJ, Дюзетти, штат Нью-Джерси (октябрь 2007 г.). «Экспрессия ядерного белка 1, индуцированная опухолевым белком 53, подавляется miR-155, и ее восстановление ингибирует развитие опухоли поджелудочной железы». Труды Национальной академии наук Соединенных Штатов Америки. 104 (41): 16170–16175. Bibcode:2007ПНАС..10416170Г. Дои:10.1073 / pnas.0703942104. ЧВК 2042180. PMID 17911264.
- Скальский Р.Л., Самолс М.А., Плезанс КБ, Босс И.В., Рива А., Лопес М.С., Бейкер Х.В., Ренне Р. (декабрь 2007 г.). «Связанный с саркомой герпесвирус Капоши кодирует ортолог miR-155». Журнал вирусологии. 81 (23): 12836–12845. Дои:10.1128 / JVI.01804-07. ЧВК 2169101. PMID 17881434.
- Сетупати П., Борел С., Гагнебин М., Грант Г.Р., Дойч С., Элтон Т.С., Хатцигеоргиу А.Г., Антонаракис С.Е. (август 2007 г.). «Человеческая микроРНК-155 на хромосоме 21 дифференциально взаимодействует со своей полиморфной мишенью в 3 'нетранслируемой области AGTR1: механизм функциональных однонуклеотидных полиморфизмов, связанных с фенотипами». Американский журнал генетики человека. 81 (2): 405–413. Дои:10.1086/519979. ЧВК 1950808. PMID 17668390.
- Мартин М.М., Бакенбергер Дж. А., Цзян Дж., Малана Г. Е., Нуово Дж. Дж., Чотани М., Фельдман Д. С., Шмитген Т. Д., Элтон Т. С. (август 2007 г.). «Полиморфизм A / C рецептора ангиотензина II типа 1 человека +1166 ослабляет связывание микроРНК-155». Журнал биологической химии. 282 (33): 24262–24269. Дои:10.1074 / jbc.M701050200. ЧВК 2413065. PMID 17588946.
- Родригес А., Вигорито Е., Клэр С., Уоррен М. В., Кутте П., Сонд Д. Р., ван Донген С., Грокок Р. Дж., Дас П. П., Миска Е. А., Ветри Д., Оккенхауг К., Энрайт А. Дж., Дуган Г., Тернер М., Брэдли А. (апр. 2007). «Потребность в bic / microRNA-155 для нормальной иммунной функции». Наука. 316 (5824): 608–611. Bibcode:2007Научный ... 316..608R. Дои:10.1126 / science.1139253. ЧВК 2610435. PMID 17463290.
- Thai TH, Calado DP, Casola S, Ansel KM, Xiao C, Xue Y, Murphy A, Frendewey D, Valenzuela D, Kutok JL, Schmidt-Supprian M, Rajewsky N, Yancopoulos G, Rao A, Rajewsky K (апрель 2007 г.) . «Регулирование ответа зародышевого центра с помощью микроРНК-155». Наука. 316 (5824): 604–608. Bibcode:2007Наука ... 316..604Т. Дои:10.1126 / science.1141229. PMID 17463289. S2CID 8174458.
- О'Коннелл Р.М., Таганов К.Д., Болдин М.П., Ченг Г., Балтимор Д. (январь 2007 г.). «МикроРНК-155 индуцируется во время воспалительной реакции макрофагов». Труды Национальной академии наук Соединенных Штатов Америки. 104 (5): 1604–1609. Bibcode:2007PNAS..104.1604O. Дои:10.1073 / pnas.0610731104. ЧВК 1780072. PMID 17242365.
- Мартин М.М., Ли Э.Дж., Бакенбергер Дж.А., Шмитген Т.Д., Элтон Т.С. (июль 2006 г.). «МикроРНК-155 регулирует экспрессию рецептора ангиотензина II типа 1 человека в фибробластах». Журнал биологической химии. 281 (27): 18277–18284. Дои:10.1074 / jbc.M601496200. PMID 16675453.
- Чунг К.Х., Харт С.С., Аль-Бассам С., Эйвери А., Тейлор Дж., Пател П.Д., Войтек А.Б., Тернер Д.Л. (2006). «Экспрессионные векторы полицистронной РНК-полимеразы II для РНК-интерференции на основе BIC / miR-155». Исследования нуклеиновых кислот. 34 (7): e53. Дои:10.1093 / нар / gkl143. ЧВК 1435982. PMID 16614444.
- Там В., Дальберг Дж. Э. (февраль 2006 г.). «miR-155 / BIC как онкогенная микроРНК». Гены, хромосомы и рак. 45 (2): 211–212. Дои:10.1002 / gcc.20282. PMID 16252262. S2CID 8513721.
- Клювер Дж., Хараламбиева Е., де Йонг Д., Блокзейл Т., Якобс С., Крузен Б. Дж., Поппема С., ван ден Берг А. (февраль 2006 г.). «Отсутствие экспрессии BIC и микроРНК miR-155 в первичных случаях лимфомы Беркитта». Гены, хромосомы и рак. 45 (2): 147–153. Дои:10.1002 / gcc.20273. PMID 16235244. S2CID 16897980.
- Цзян Дж., Ли Э.Дж., Шмитген Т.Д. (январь 2006 г.). «Повышенная экспрессия микроРНК-155 в линиях лимфобластоидных клеток, трансформированных вирусом Эпштейна-Барра». Гены, хромосомы и рак. 45 (1): 103–106. Дои:10.1002 / gcc.20264. PMID 16175574. S2CID 19138209.
- Kluiver J, Poppema S, de Jong D, Blokzijl T, Harms G, Jacobs S, Kroesen BJ, van den Berg A (октябрь 2005 г.). «BIC и miR-155 высоко экспрессируются в лимфомах Ходжкина, первичных средостения и диффузных больших В-клеточных лимфомах». Журнал патологии. 207 (2): 243–249. Дои:10.1002 / путь.1825. PMID 16041695. S2CID 14329069.
- Eis PS, Tam W, Sun L, Chadburn A, Li Z, Gomez MF, Lund E, Dahlberg JE (март 2005 г.). «Накопление miR-155 и BIC РНК в В-клеточных лимфомах человека». Труды Национальной академии наук Соединенных Штатов Америки. 102 (10): 3627–3632. Bibcode:2005PNAS..102.3627E. Дои:10.1073 / pnas.0500613102. ЧВК 552785. PMID 15738415.
- Мецлер М., Вильда М., Буш К., Фиманн С., Боркхардт А. (февраль 2004 г.). «Высокая экспрессия предшественника микроРНК-155 / BIC РНК у детей с лимфомой Беркитта». Гены, хромосомы и рак. 39 (2): 167–169. Дои:10.1002 / gcc.10316. PMID 14695998. S2CID 10009892.
внешняя ссылка
- miRBase
- Записи miRBase для всех известных Мир-155
- Страница семейства предшественников микроРНК mir-155 в Рфам