WikiDer > Морфеин
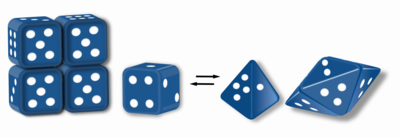
Морфеины находятся белки которые могут образовывать двух или более разных гомо-олигомеры (формы морфеина), но должны распадаться и менять форму для преобразования между формами. Альтернативная форма может быть повторно собрана с другим олигомером. Форма субъединицы определяет, какой олигомер образуется.[1][2] Каждый олигомер имеет конечное число субъединиц (стехиометрия). Морфеины могут преобразовываться между формами в физиологических условиях и могут существовать как равновесие различных олигомеров. Эти олигомеры физиологически релевантны и не являются неправильно свернутыми белками; это отличает морфеины от прионы и амилоид. Различные олигомеры обладают разными функциональными возможностями. Взаимопревращение форм морфеина может быть структурной основой для аллостерическая регуляция.[1][2][3][4] А мутация который сдвигает нормальное равновесие форм морфеина, может служить основой для конформационное заболевание.[5] Особенности морфеинов могут быть использованы для открытие лекарств.[1][3][6] Изображение в кости (рис. 1) представляет собой морфеиновое равновесие, содержащее две различные мономерные формы, которые определяют сборку тетрамера или пентамера. Один белок, который, как установлено, функционирует как морфеин, - это порфобилиногенсинтаза,[2][7][8] хотя в литературе есть предположения, что другие белки могут функционировать как морфеины (для получения дополнительной информации см. «Таблицу предполагаемых морфеинов» ниже).
Последствия для открытия лекарств
Конформационные различия между субъединицами разных олигомеров и связанные функциональные различия морфеина служат отправной точкой для открытия лекарств. Функция белка зависит от олигомерной формы; следовательно, функцию белка можно регулировать, сдвигая равновесие форм. Низкомолекулярное соединение может сдвинуть равновесие, блокируя или способствуя образованию одного из олигомеров. Равновесие можно сдвинуть с помощью небольшой молекулы, которая имеет преимущественное сродство связывания только с одной из альтернативных форм морфеина. Задокументирован ингибитор порфобилиногенсинтазы с таким механизмом действия.[3]
Последствия для аллостерической регуляции
Морфеиновая модель аллостерическая регуляция имеет сходство с другими моделями и отличия от них.[1][4][9] Согласованная модель (модель Monod, Wyman and Changeux (MWC)) аллостерической регуляции требует, чтобы все субъединицы находились в одной и той же конформации или состоянии внутри олигомера, такого как модель морфеина.[10][11] Однако ни эта модель, ни последовательная модель (модель Кошланда, Немети и Филмера) не учитывают, что белок может диссоциировать, чтобы взаимно преобразовываться между олигомерами.[10][11][12][13]
Значение для обучения взаимосвязям структура-функция белка
Обычно считается, что данная аминокислотная последовательность будет иметь только одну физиологически релевантную (нативную) четвертичная структура; морфеины бросают вызов этой концепции. Модель морфеина не требует серьезных изменений в основной белковой складке.[1] Конформационные различия, которые сопровождают превращение между олигомерами, могут быть похожи на движения белков, необходимые для функционирования некоторых белков.[14] Модель морфеина подчеркивает важность конформационной гибкости для функциональности белков и предлагает потенциальное объяснение белков, не являющихсяКинетика Михаэлиса-Ментен, гистерезис, и / или зависит от концентрации белка специфическая деятельность.[9]
Значение для понимания структурной основы болезни
Период, термин "конформационное заболевание"обычно включает мутации, которые приводят к неправильной укладке белков, которые агрегируются, например, болезни Альцгеймера и Крейтцфельдта – Якоба.[15] Однако в свете открытия морфеинов это определение может быть расширено, чтобы включить мутации, которые сдвигают равновесие альтернативных олигомерных форм белка. Примером такого конформационного заболевания является ALAD порфирия, который возникает в результате мутации порфобилиногенсинтаза что вызывает сдвиг в его морфеиновом равновесии.[5]
Таблица белков, опубликованное поведение которых согласуется с поведением морфеина
| Протеин | Примеры видов | E.C. номер | Количество CAS | Альтернативные олигомеры | Свидетельство |
|---|---|---|---|---|---|
| Ацетил-КоА карбоксилаза-1 | Gallus domesticus | EC 6.4.1.2 | 9023-93-2 | неактивный димер, активный димер, крупнее[16] | Эффекторные молекулы влияют на мультимеризацию,[17] Несколько/белок подрабатывает функции[16] |
| α-ацетилгалактозаминидаза | Bos taurus | EC 4.3.2.2 | 9027-81-0 | неактивный мономер, активный тетрамер[18] | Связывание / оборот субстрата влияет на мультимеризацию,[18] Удельная активность, зависящая от концентрации белка,[19] У разных сборок разные действия,[19] Конформационно отличные олигомерные формы.[18][19] |
| Аденилосукцинатлиаза | Bacillus subtilis | EC 4.3.2.2 | 9027-81-0 | мономер, димер, тример, тетрамер[20] | Мутации сдвигают равновесие олигомеров,[21] Олигомер-зависимые кинетические параметры,[21] Молекулярная масса, зависящая от концентрации белка[21] |
| Аристолохенсинтаза | Penicillium roqueforti | EC 4.2.3.9 | 94185-89-4 | мономер высшего порядка[22] | Удельная активность, зависящая от концентрации белка[23] |
| L-Аспарагиназа | Leptosphaeria michotii | EC 3.5.1.1 | 9015-68-3 | димер, тетрамер, неактивный октамер[24] | Связывание / оборот субстрата влияет на мультимеризацию[25] |
| Аспартокиназа | кишечная палочка | EC 2.7.2.4 & EC 1.1.1.3 | 9012-50-4 | мономер, димер, тетрамер[26][27] | Несколько/белок подрабатывает функции,[28] Конформационно отличные олигомерные формы[27] |
| АТФаза транспортера ABCA1 | Homo sapiens | димер, тетрамер[29] | Связывание / оборот субстрата влияет на мультимеризацию[29] | ||
| Биотин - (ацетил-КоА-карбоксилаза) лигаза холоэнзим синтетаза | кишечная палочка | EC 6.3.4.15 | 37340-95-7 | мономер, димер[30] | Несколько/белок подрабатывает функции,[30] Различные сборки имеют разные действия[31] |
| Хоризмат мутаза | кишечная палочка | EC 5.4.99.5 | 9068-30-8 | димер, тример, гексамер | Конформационно отличные олигомерные формы[32] |
| Цитрат-синтаза | кишечная палочка | EC 2.3.3.1 | 9027-96-7 | мономер, димер, тример, тетрамер, пентамер, гексамер, додекамер[33] | Связывание / оборот субстрата влияет на мультимеризацию,[33] Характеризуется равновесие олигомеров,[33] Удельная активность, зависящая от концентрации белка,[33] pH-зависимое олигомерное равновесие[33] |
| Циановирин-Н | Носток эллипсоспорум | 918555-82-5 | мономер и димер с заменой домена[34][35] | Характеризуется равновесие олигомеров,[36][37] Конформационно отличные олигомерные формы[36][37] | |
| 3-оксоацид КоА-трансфераза | Sus scrofa domestica | EC 2.8.3.5 | 9027-43-4 | димер, тетрамер[38] | Хроматографически разделяемые олигомеры,[38] Субстрат может предпочтительно стабилизировать одну форму[38] |
| Цистатионин бета-синтаза | Homo sapiens | EC 4.2.1.22 | 9023-99-8 | множественный - колеблется от димера до 16-мерного[39] | Эффекторные молекулы влияют на мультимеризацию,[40] Мутации сдвигают равновесие олигомеров,[41] У разных сборок разные действия,[40] болезнетворные мутации на сайтах, удаленных от активного сайта[42] |
| Оксидаза D-аминокислот | EC 1.4.3.3 | 9000-88-8 | мономеры, димеры, олигомеры высшего порядка[43][44] | Олигомер-зависимые кинетические параметры[43][44] | |
| Дигидролипоамиддегидрогеназа | Sus scrofa domestica | EC 1.8.1.4 | 9001-18-7 | мономер, две разные формы димера, тетрамер[45] | Несколько/белок подрабатывает функции,[45] У разных сборок разные действия,[45] pH-зависимое олигомерное равновесие,[45] Конформационно отличные олигомерные формы[46][47][48] |
| Дофамин бета-монооксигеназа | Bos taurus | EC 1.14.17.1 | 9013-38-1 | димеры, тетрамеры[49][50][51] | Эффекторные молекулы влияют на мультимеризацию,[49][50][51] Характеризуется равновесие олигомеров,[49][50][51] Олигомер-зависимые кинетические параметры[49][50][51] |
| Геранилгеранилпирофосфатсинтаза / Фарнезилтрантрансфераза | Homo sapiens | EC 2.5.1.29 | 9032-58-0 | гексамер, октамер[52][53][54] | Эффекторные молекулы влияют на мультимеризацию[53] |
| GDP-манноза 6-дегидрогеназа | Синегнойная палочка | EC 1.1.1.132 | 37250-63-8 | тример, 2 тетрамера и гексамер[55][56] | Удельная активность, зависящая от концентрации белка,[57] Кинетический гистерезис[57] |
| Глутаматдегидрогеназа | Bos taurus | EC 1.4.1.2 | 9001-46-1 | активные и неактивные гексамеры высшего порядка[58] | Эффекторные молекулы влияют на мультимеризацию,[59] Характеризованное равновесие олигомеров[58] |
| Глутамат рацемаза | Mycobacterium tuberculosis, Escherichia coli, Bacillus subtilis, Aquifex pyrophilus | EC 5.1.1.3 | 9024-08-02 | мономер, 2 димера, тетрамер[60][61][62][63][64] | Несколько/белок подрабатывает функции,[65][66][67] Характеризуется равновесие олигомеров,[63][64] Конформационно отличные олигомерные формы[60][61][62] |
| Глицеральдегид-3-фосфатдегидрогеназа | Oryctolagus cuniculas, Sus scrofa domestica | EC 1.2.1.12 | 9001-50-7 | мономер, димер, тетрамер[68] Характеризуется равновесие олигомеров,[69] Различные сборки имеют разные действия[70] | |
| Глицеринкиназа | кишечная палочка | EC 2.7.1.30 | 9030-66-4 | мономер и 2 тетрамера[71][72][73] | Характеризуется равновесие олигомеров,[71][72][73][74] Конформационно отличные олигомерные формы,[74][75] Эффекторные функции, предотвращая движение домена[75] |
| ВИЧ-Интеграза | Вирус иммунодефицита человека-1 | EC 2.7.7.- | мономер, димер, тетрамер, высший порядок[76][77][78] | Эффекторные молекулы влияют на мультимеризацию,[79] Несколько/белок подрабатывает функции,[76][77][78] Различные сборки имеют разные действия[78][79] | |
| HPr-киназа / фосфатаза | Bacillus subtilis, Lactobacillus casei, Mycoplasma pneumoniae, Staphylococcus xylosus | EC 2.7.1.-/EC 3.1.3.- | 9026-43-1 | мономеры, димеры, тримеры, гексамеры[80][81][82][83][84][85] | Эффекторные молекулы влияют на мультимеризацию,[84] Несколько/белок подрабатывает функции,[84] У разных сборок разные действия,[84] pH-зависимое олигомерное равновесие[84] |
| Лактатдегидрогеназа | Bacillus stearothermophilus | EC 1.1.1.27 | 9001-60-9 | 2 димера, тетрамер[86][87] | Эффекторные молекулы влияют на мультимеризацию,[87] Характеризуется равновесие олигомеров,[87] Удельная активность, зависящая от концентрации белка,[87] Мутации сдвигают равновесие олигомеров,[88] Олигомер-зависимые кинетические параметры,[87] Конформационно отличные олигомерные формы[89] |
| Lon протеаза | Escherichia coli, Mycobacterium smegmatis | EC 3.4.21.53 | 79818-35-2 | мономер, димер, тример, тетрамер[90][91] | Эффекторные молекулы влияют на мультимеризацию,[90][91] Связывание / оборот субстрата влияет на мультимеризацию,[90][91] Удельная активность, зависящая от концентрации белка,[92] Кинетический гистерезис[92] |
| Митохондриальный НАД (Ф) + яблочный фермент / малатдегидрогеназа (оксалоацетат-декарбоксилирование) (НАДФ +) | Homo sapiens | EC 1.1.1.40 | 9028-47-1 | мономер, 2 димера, тетрамер[93][94] | Эффекторные молекулы влияют на мультимеризацию,[93] Мутации сдвигают равновесие олигомеров,[95] Кинетический гистерезис,[94] |
| Пероксиредоксины | Сальмонелла тифимуриум | EC 1.6.4.- & EC 1.11.1.15 | 207137-51-7 | 2 димера, декамер | Конформационно отличные олигомерные формы,[96] Различные сборки имеют разные действия[97] |
| Фенилаланингидроксилаза | Homo sapiens | EC 1.14.16.1 | 9029-73-6 | тетрамер высокой активности, тетрамер низкой активности[98] | Связывание / оборот субстрата влияет на мультимеризацию,[99][100] Конформационно отличные олигомерные формы[101][102] |
| Фосфоенолпируваткарбоксилаза | Escherichia coli, Zea mays | EC 4.1.1.31 | 9067-77-0 | неактивный димер, активный тетрамер[103] | Эффекторные молекулы влияют на мультимеризацию, Характеризованное равновесие олигомеров,[103] Кинетический гистерезис,[103] Конформационно отличные олигомерные формы[104] |
| Фосфофруктокиназа | Bacillus stearothermophilus, Thermus thermophilus | EC 2.7.1.11 | 9001-80-3 | неактивный димер, активный тетрамер[103][105] | Эффекторные молекулы влияют на мультимеризацию,[103][105] Характеризованное равновесие олигомеров[103][105] |
| Полифенолоксидаза | Agaricus bisporus, Malus domestica, Lactuca sativa L. | EC 1.10.3.1 | 9002-10-2 | мономер, тример, тетрамер, октамер, додекамер[106][107] | Несколько/белок подрабатывает функции,[108] Связывание / оборот субстрата влияет на мультимеризацию,[109] У разных сборок разные действия,[110] Кинетический гистерезис[109] |
| Порфобилиногенсинтаза | Drosophila melanogaster, Danio rerio | EC 4.2.1.24 | 9036-37-7 | димер, гексамер, октамер[111][112] | PBGS - прототип морфеина.[111] |
| Пируваткиназа | Homo sapiens | EC 2.7.1.40 | 9001-59-6 | активные и неактивные димеры, активный тетрамер, мономер, тример, пентамер[113][114] | Конформационно отличные олигомерные формы[113][114] |
| Рибонуклеаза А | Bos taurus | EC 3.1.27.5 | 9901-99-4 | мономер, димер, тример, тетрамер, гексамер, пентамер, высший порядок[115][116][117][118][119] | Несколько/белок подрабатывает функции,[120][121][122] У разных сборок разные действия,[120][121][122] Конформационно отличные олигомерные формы[116][118][119] |
| Рибонуклеотидредуктаза | Mus musculus | EC 1.17.4.1 | 9047-64-7 | тетрамер, гексамер[123][124][125][126] | Эффекторные молекулы влияют на мультимеризацию[126] |
| S-аденозил-L-гомоцистеин гидролаза | Dictyostelium discoideum | EC 3.3.1.1 | 9025-54-1 | тетрамер и другие[127][128][129] | Эффекторные молекулы влияют на мультимеризацию[127] |
| Биодегративная треониндегидратаза / треонин-аммиак-лиаза | кишечная палочка | EC 4.3.1.19 | 774231-81-1 | 2 мономера, 2 тетрамера[130][131][132] | Эффекторные молекулы влияют на мультимеризацию,[132] Характеризуется равновесие олигомеров,[130][131] Различные сборки имеют разные действия[130][131][132] |
| β-Триптаза | Homo sapiens | EC 3.4.21.59 | 97501-93-4 | активные и неактивные мономеры, активные и неактивные тетрамеры[133][134][135][136][137][138][139][140][141][142] | Удельная активность, зависящая от концентрации белка,[143] Характеризованное равновесие олигомеров[143] |
| Фактор некроза опухоли альфа | Homo sapiens | 94948-61-5 | мономер, димер, тример[144][145] | Различные сборки имеют разные действия[146] | |
| Урацил фосфорибозилтрансфераза | кишечная палочка | EC 2.4.2.9 | 9030-24-4 | тример, пентамер[147] | Эффекторные молекулы влияют на мультимеризацию,[147] Связывание / оборот субстрата влияет на мультимеризацию,[147] Различные сборки имеют разные действия[147] |
Рекомендации
- ^ а б c d е Джаффе, Эйлин К. (2005). «Морфеины - новая структурная парадигма аллостерической регуляции». Тенденции в биохимических науках. 30 (9): 490–7. Дои:10.1016 / j.tibs.2005.07.003. PMID 16023348.
- ^ а б c Брейниг, Сабина; Кервинен, Юкка; Стит, Линда; Wasson, Andrew S; Фэрман, Роберт; Влодавер, Александр; Зданов Александр; Джаффе, Эйлин К. (2003). «Контроль биосинтеза тетрапирролов с помощью альтернативных четвертичных форм порфобилиногенсинтазы». Структурная биология природы. 10 (9): 757–63. Дои:10.1038 / nsb963. PMID 12897770. S2CID 24188785.
- ^ а б c Лоуренс, Сара Х .; Рамирес, Урсула Д .; Тан, Лэй; Фазлиез, Фарит; Кундрат, Ленка; Маркхэм, Джордж Д .; Джаффе, Эйлин К. (2008). «Изменение формы ведет к открытию аллостерических лекарств с малыми молекулами». Химия и биология. 15 (6): 586–96. Дои:10.1016 / j.chembiol.2008.04.012. ЧВК 2703447. PMID 18559269.
- ^ а б c Селвуд, Тревор; Джаффе, Эйлин К. (2012). «Динамические диссоциирующие гомоолигомеры и контроль функции белка». Архивы биохимии и биофизики. 519 (2): 131–43. Дои:10.1016 / j.abb.2011.11.020. ЧВК 3298769. PMID 22182754.
- ^ а б Jaffe, Eileen K .; Стит, Линда (2007). «Порфирия ALAD - конформационное заболевание». Американский журнал генетики человека. 80 (2): 329–37. Дои:10.1086/511444. ЧВК 1785348. PMID 17236137.
- ^ Джаффе, Эйлин К. (2010). «Морфеины - новый путь к открытию аллостерических лекарств». Труды открытой конференции. 1: 1–6. Дои:10.2174/2210289201001010001. ЧВК 3107518. PMID 21643557.
- ^ Tang, L .; Стит, L; Яффе, ЭК (2005). «Субстрат-индуцированное взаимное преобразование изоформ четвертичной структуры белка». Журнал биологической химии. 280 (16): 15786–93. Дои:10.1074 / jbc.M500218200. PMID 15710608.
- ^ Jaffe, Eileen K .; Лоуренс, Сара Х. (2012). «Аллостерия и динамическая олигомеризация порфобилиногенсинтазы». Архивы биохимии и биофизики. 519 (2): 144–53. Дои:10.1016 / j.abb.2011.10.010. ЧВК 3291741. PMID 22037356.
- ^ а б Лоуренс, Сара Х .; Джаффе, Эйлин К. (2008). «Расширение концепций взаимосвязи структуры и функции белка и кинетики ферментов: обучение с использованием морфеинов». Биохимия и молекулярная биология образование. 36 (4): 274–283. Дои:10.1002 / bmb.20211. ЧВК 2575429. PMID 19578473.
- ^ а б Моно, Жак; Changeux, Жан-Пьер; Якоб, Франсуа (1963). «Аллостерические белки и клеточные системы контроля». Журнал молекулярной биологии. 6 (4): 306–29. Дои:10.1016 / S0022-2836 (63) 80091-1. PMID 13936070.
- ^ а б Моно, Жак; Вайман, Джеффрис; Changeux, Жан-Пьер (1965). «О природе аллостерических переходов: правдоподобная модель». Журнал молекулярной биологии. 12: 88–118. Дои:10.1016 / S0022-2836 (65) 80285-6. PMID 14343300.
- ^ Кошланд, Д. (1970). «7 Молекулярная основа регуляции ферментов». Энзимы, том 1. Ферменты. 1. С. 341–396. Дои:10.1016 / S1874-6047 (08) 60170-5. ISBN 978-0-12-122701-2.
- ^ Koshland, D.E .; Неметий, G .; Филмер, Д. (1966). «Сравнение экспериментальных данных связывания и теоретических моделей в белках, содержащих субъединицы». Биохимия. 5 (1): 365–85. Дои:10.1021 / bi00865a047. PMID 5938952.
- ^ Герштейн, Марк; Эколс, Натаниэль (2004). «Изучение диапазона гибкости белка с точки зрения структурной протеомики». Современное мнение в области химической биологии. 8 (1): 14–9. Дои:10.1016 / j.cbpa.2003.12.006. PMID 15036151.
- ^ Каррелл, Робин В. Ломас, Дэвид А. (1997). «Конформационное заболевание». Ланцет. 350 (9071): 134–8. Дои:10.1016 / S0140-6736 (97) 02073-4. PMID 9228977. S2CID 39124185.
- ^ а б Boone, A.N .; Brownsey, R.W .; Elliott, J.E .; Kulpa, J.E .; Ли, W.M. (2006). «Регулирование ацетил-КоА карбоксилазы». Сделки Биохимического Общества. 34 (2): 223–7. Дои:10.1042 / BST20060223. PMID 16545081.
- ^ Шен, Ян; Volrath, Sandra L .; Уэтерли, Стефани С.; Elich, Tedd D .; Тонг, Лян (2004). «Механизм мощного ингибирования эукариотической ацетил-кофермента карбоксилазы сорафеном А, макроциклическим поликетидным природным продуктом». Молекулярная клетка. 16 (6): 881–91. Дои:10.1016 / j.molcel.2004.11.034. PMID 15610732.
- ^ а б c Вайсманн, Бернар; Ван, Цзин-Дэ (1971). «Ассоциация-диссоциация и аномальная кинетика бычьей α-ацетилгалактозаминидазы». Биохимия. 10 (6): 1067–72. Дои:10.1021 / bi00782a021. PMID 5550813.
- ^ а б c Вайсманн, Бернар; Хинрихсен, Доротея Ф. (1969). «Α-ацетилгалактозаминидаза млекопитающих. Возникновение, частичная очистка и действие на связи в подчелюстных муцинах». Биохимия. 8 (5): 2034–43. Дои:10.1021 / bi00833a038. PMID 5785223.
- ^ Де Зойса Ариянанда, Лушанти; Колман, Роберта Ф. (2008). «Оценка типов взаимодействий в ассоциации субъединиц в аденилосукцинат лиазе Bacillus subtilis». Биохимия. 47 (9): 2923–34. Дои:10.1021 / bi701400c. PMID 18237141.
- ^ а б c Паленчар, Дженнифер Брозиус; Колман, Роберта Ф. (2003). "Характеристика мутанта Bacillus subtilis Аденилосукцинатлиаза, эквивалентная мутантному ферменту, обнаруженному при дефиците аденилосукцинатлиазы человека: аспарагин 276 играет важную структурную роль ». Биохимия. 42 (7): 1831–41. Дои:10.1021 / bi020640 +. PMID 12590570.
- ^ Hohn, Thomas M .; Платтнер, Рональд Д. (1989). «Очистка и характеристика сесквитерпенциклазы аристолохенсинтазы из Penicillium roqueforti». Архивы биохимии и биофизики. 272 (1): 137–43. Дои:10.1016 / 0003-9861 (89) 90204-Х. PMID 2544140.
- ^ Caruthers, J.M .; Канг, я; Rynkiewicz, MJ; Cane, DE; Кристиансон, DW (2000). "Определение кристаллической структуры аристолохен-синтазы из плесени голубого сыра Penicillium roqueforti". Журнал биологической химии. 275 (33): 25533–9. Дои:10.1074 / jbc.M000433200. PMID 10825154.
- ^ Jerebzoff-Quintin, Simonne; Джеребцов, Стефан (1985). «Активность L-аспарагиназы в Leptosphaeria michotii. Выделение и свойства двух форм фермента». Physiologia Plantarum. 64: 74–80. Дои:10.1111 / j.1399-3054.1985.tb01215.x.
- ^ Юн, Ми-Кён; Нурс, Аманда; Уайт, Стивен У .; Rock, Charles O .; Хит, Ричард Дж. (2007). «Кристаллическая структура и аллостерическая регуляция цитоплазматической l-аспарагиназы I Escherichia coli». Журнал молекулярной биологии. 369 (3): 794–811. Дои:10.1016 / j.jmb.2007.03.061. ЧВК 1991333. PMID 17451745.
- ^ Гарель, Ж.-Р. (1980). «Последовательное сворачивание бифункционального аллостерического белка». Труды Национальной академии наук. 77 (6): 3379–3383. Bibcode:1980PNAS ... 77.3379G. Дои:10.1073 / pnas.77.6.3379. JSTOR 8892. ЧВК 349619. PMID 6774337.
- ^ а б Kotaka, M .; Ren, J .; Локьер, М .; Hawkins, A. R .; Заика, Д. К. (2006). «Структуры R- и T-состояний аспартокиназы III Escherichia coli: МЕХАНИЗМЫ АЛЛОСТЕРИЧЕСКОГО ПЕРЕХОДА И ИНГИБИРОВАНИЯ ЛИЗИНОМ». Журнал биологической химии. 281 (42): 31544–52. Дои:10.1074 / jbc.M605886200. PMID 16905770.
- ^ Огилви, JW; Викерс, LP; Кларк, РБ; Джонс, ММ (1975). «Аспартокиназа I-гомосериндегидрогеназа I Escherichia coli K12 (лямбда). Активация одновалентными катионами и анализ влияния комплекса аденозинтрифосфат-ион магния на этот процесс активации». Журнал биологической химии. 250 (4): 1242–50. PMID 163250.
- ^ а б Trompier, D .; Алиберт, М; Davanture, S; Хамон, Y; Пьер, М; Чимини, Г. (2006). «Переход от димеров к высшим олигомерным формам происходит во время АТФазного цикла транспортера ABCA1». Журнал биологической химии. 281 (29): 20283–90. Дои:10.1074 / jbc.M601072200. PMID 16709568.
- ^ а б Эйзенштейн, Эдвард; Беккет, Дороти (1999). «Димеризация репрессора EscherichiacoliBiotin: функция корепрессора в сборке белка». Биохимия. 38 (40): 13077–84. Дои:10.1021 / bi991241q. PMID 10529178.
- ^ Стрикер, Эмили Д .; Беккет, Дороти (1998). «Сцепление сайт-специфического связывания ДНК с димеризацией белка в сборке комплекса биотин-репрессор-биотин-оператор». Биохимия. 37 (9): 3210–9. Дои:10.1021 / bi9715019. PMID 9485476.
- ^ Вамвача, Катерина; Бутц, Марен; Уолтер, Кай У .; Тейлор, Шон В .; Хилверт, Дональд (2005). «Одновременная оптимизация активности ферментов и четвертичной структуры путем направленной эволюции». Белковая наука. 14 (8): 2103–14. Дои:10.1110 / пс. 051431605. ЧВК 2279322. PMID 15987889.
- ^ а б c d е Тонг, Э. К .; Дакворт, Гарри В. (1975). «Четвертичная структура цитратсинтазы из Escherichia coli K 12». Биохимия. 14 (2): 235–41. Дои:10.1021 / bi00673a007. PMID 1091285.
- ^ Бьюли, Кэрол А .; Gustafson, Kirk R .; Бойд, Майкл Р .; Ковелл, Дэвид Дж .; Bax, Ad; Клор, Г. Мариус; Гроненборн, Анджела М. (1998). «Структура раствора циановирина-N, мощного белка, инактивирующего ВИЧ». Структурная биология природы. 5 (7): 571–8. Дои:10.1038/828. PMID 9665171. S2CID 11367037.
- ^ Ян, Фань; Бьюли, Кэрол А; Луи, Джон М; Густафсон, Кирк Р.; Бойд, Майкл Р.; Гроненборн, Анджела М; Clore, G.Marius; Влодавер, Александр (1999). «Кристаллическая структура циановирина-N, мощного белка, инактивирующего ВИЧ, демонстрирует неожиданную замену домена». Журнал молекулярной биологии. 288 (3): 403–12. Дои:10.1006 / jmbi.1999.2693. PMID 10329150. S2CID 308708.
- ^ а б Барриентос, LG; Гроненборн, AM (2005). «Высокоспецифичный углевод-связывающий белок циановирин-N: структура, активность против ВИЧ / Эбола и возможности лечения». Мини-обзоры по медицинской химии. 5 (1): 21–31. Дои:10.2174/1389557053402783. PMID 15638789.
- ^ а б Барриентос, LG; Луи, JM; Ботос, я; Мори, Т; Хан, Z; О'Киф, Бразилия; Бойд, MR; Wlodawer, A; и другие. (2002). «Димер циановирина-N с замененным доменом находится в метастабильном свернутом состоянии: согласование структур рентгеновских лучей и ЯМР». Структура. 10 (5): 673–86. Дои:10.1016 / S0969-2126 (02) 00758-X. PMID 12015150.
- ^ а б c Роше, Жан-Кристоф; Брауни, Эдвард Р .; Оикава, Ким; Хикс, Лесли Д .; Fraser, Marie E .; Джеймс, Майкл Н.Г .; Кей, Сирил М .; Бриджер, Уильям А .; и другие. (2000). «Трансфераза CoA сердца свиньи существует в виде двух олигомерных форм, разделенных большим кинетическим барьером». Биохимия. 39 (37): 11291–302. Дои:10.1021 / bi0003184. PMID 10985774.
- ^ Франк, Нина; Кери, Владимир; MacLean, Kenneth N .; Краус, Ян П. (2006). «Доступные для растворителей цистеины в человеческой цистатионин-β-синтазе: решающая роль цистеина 431 в связывании S-аденозил-1-метионина». Биохимия. 45 (36): 11021–9. Дои:10.1021 / bi060737m. PMID 16953589.
- ^ а б Сен, Суваджит; Банерджи, Рума (2007). «Патогенная мутация в каталитическом ядре цистатионин-β-синтазы человека нарушает аллостерическую регуляцию и позволяет кинетическую характеристику полноразмерного димера». Биохимия. 46 (13): 4110–6. Дои:10.1021 / bi602617f. ЧВК 3204387. PMID 17352495.
- ^ Кери, Владимир; Poneleit, Loelle; Краус, Ян П. (1998). «Расщепление трипсином человеческой цистатионин-β-синтазы на эволюционно консервативное активное ядро: структурные и функциональные последствия». Архивы биохимии и биофизики. 355 (2): 222–32. Дои:10.1006 / abbi.1998.0723. PMID 9675031.
- ^ Шань, Сяоинь; Крюгер, Уоррен Д. (1998). «Коррекция болезнетворных мутаций CBS у дрожжей». Природа Генетика. 19 (1): 91–3. Дои:10.1038 / ng0598-91. PMID 9590298. S2CID 47102642.
- ^ а б Антонини, E; Brunori, M; Bruzzesi, R; Chiancone, E; Мэсси, V (1966). «Явления ассоциации-диссоциации оксидазы D-аминокислот». Журнал биологической химии. 241 (10): 2358–66. PMID 4380380.
- ^ а б Мэсси, V; Курти, Б; Гантер, H (1966). «Зависящее от температуры конформационное изменение оксидазы D-аминокислот и его влияние на катализ». Журнал биологической химии. 241 (10): 2347–57. PMID 5911617.
- ^ а б c d Бабади, Н.Е .; Pang, Y.-P .; Elpeleg, O .; Исая, Г. (2007). «Скрытая протеолитическая активность дигидролипоамиддегидрогеназы». Труды Национальной академии наук. 104 (15): 6158–63. Bibcode:2007ПНАС..104.6158Б. Дои:10.1073 / pnas.0610618104. ЧВК 1851069. PMID 17404228.
- ^ Muiswinkel-Voetberg, H .; Виссер, Яап; Вигер, Корнелис (1973). «Конформационные исследования липоамиддегидрогеназы из сердца свиньи. 1. Взаимопревращение диссоциативных и недиссоциативных форм». Европейский журнал биохимии. 33 (2): 265–70. Дои:10.1111 / j.1432-1033.1973.tb02679.x. PMID 4348439.
- ^ Клячко, Н.Л .; Щедрина, В.А.; Ефимов А.В.; Казаков С.В.; Газарян И.Г .; Kristal, BS; Браун, AM (2005). "PH-зависимое предпочтение субстрата липоамиддегидрогеназы сердца свиньи зависит от олигомерного состояния: реакция на подкисление митохондриальной матрицы". Журнал биологической химии. 280 (16): 16106–14. Дои:10.1074 / jbc.M414285200. PMID 15710613.
- ^ Muiswinkel-Voetberg, H .; Вигер, Корнелис (1973). «Конформационные исследования липоамиддегидрогеназы из сердца свиньи. 2. Спектроскопические исследования апофермента, мономерных и димерных форм». Европейский журнал биохимии. 33 (2): 271–8. Дои:10.1111 / j.1432-1033.1973.tb02680.x. PMID 4348440.
- ^ а б c d Саксена, Ашима; Хенсли, Престон; Осборн, Джеймс С.; Флеминг, Патрик Дж. (1985). «PH-зависимая диссоциация субъединиц и каталитическая активность бычьей дофамин-β-гидроксилазы». Журнал биологической химии. 260 (6): 3386–92. PMID 3972830.
- ^ а б c d Дхаван, S; Хенсли, П.; Осборн-младший, JC; Флеминг, П.Дж. (1986). «Аденозин-5'-дифосфат-зависимая диссоциация субъединицы дофамин-бета-гидроксилазы крупного рогатого скота». Журнал биологической химии. 261 (17): 7680–4. PMID 3711102.
- ^ а б c d Стюарт, L C; Клинман, Дж. П. (1988). «Дофамин-бета-гидроксилаза гранул хромаффина надпочечников: структура и функция». Ежегодный обзор биохимии. 57: 551–92. Дои:10.1146 / annurev.bi.57.070188.003003. PMID 3052283.
- ^ Кузугучи, Т .; Морита, Y; Сагами, я; Сагами, H; Огура, К. (1999). "Геранилгеранил дифосфат-синтаза человека. КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ КДНК". Журнал биологической химии. 274 (9): 5888–94. Дои:10.1074 / jbc.274.9.5888. PMID 10026212.
- ^ а б Kavanagh, K. L .; Данфорд, Дж. Э .; Bunkoczi, G; Рассел, Р.Г.; Опперманн, У (2006). «Кристаллическая структура геранилгеранилпирофосфатсинтазы человека обнаруживает новое гексамерное устройство и ингибирующее связывание продукта». Журнал биологической химии. 281 (31): 22004–12. Дои:10.1074 / jbc.M602603200. PMID 16698791.
- ^ Мияги, Й .; Matsumura, Y .; Сагами, Х. (2007). «Геранилгеранилдифосфат-синтаза человека представляет собой октамер в растворе». Журнал биохимии. 142 (3): 377–81. Дои:10.1093 / jb / mvm144. PMID 17646172.
- ^ Снук, Кристофер Ф .; Типтон, Питер А .; Бимер, Леса Дж. (2003). "Кристаллическая структура GDP-маннозодегидрогеназы: ключевой фермент биосинтеза альгината в P. Aeruginosa". Биохимия. 42 (16): 4658–68. Дои:10.1021 / bi027328k. PMID 12705829.
- ^ Ройчоудхури, S; Май, туберкулез; Gill, JF; Сингх, СК; Фейнгольд, Д.С. Чакрабарти, AM (1989). «Очистка и характеристика гуанозиндифосфо-D-маннозодегидрогеназы. Ключевой фермент в биосинтезе альгината Pseudomonas aeruginosa». Журнал биологической химии. 264 (16): 9380–5. PMID 2470755.
- ^ а б Naught, Laura E .; Гилберт, Санни; Имхофф, Ребекка; Снук, Кристофер; Бимер, Леса; Типтон, Питер (2002). «Аллостеризм и кооперативность в Pseudomonas aeruginosaGDP-маннозодегидрогеназа». Биохимия. 41 (30): 9637–45. Дои:10.1021 / bi025862m. PMID 12135385.
- ^ а б Фишер, Харви Ф. (2006). «Комплексы глутаматдегидрогеназа - лиганд и их связь с механизмом реакции». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 39. стр.369–417. Дои:10.1002 / 9780470122846.ch6. ISBN 978-0-470-12284-6. PMID 4147773.
- ^ Huang, CY; Frieden, C. (1972). «Механизм лиганд-индуцированных структурных изменений в глутаматдегидрогеназе. Исследования скорости деполимеризации и изомеризации под действием коферментов и гуаниновых нуклеотидов». Журнал биологической химии. 247 (11): 3638–46. PMID 4402280.
- ^ а б Ким, Санг Сок; Choi, I.-G .; Ким, Сун-Хоу; Ю., Ю. Г. (1999). «Молекулярное клонирование, экспрессия и характеристика термостабильной глутаматрацемазы из гипертермофильной бактерии Aquifex pyrophilus». Экстремофилов. 3 (3): 175–83. Дои:10.1007 / s007920050114. PMID 10484173. S2CID 709039.
- ^ а б Лундквист, Томас; Фишер, Стюарт Л .; Керн, Гюнтер; Folmer, Rutger H.A .; Сюэ, Яфэн; Ньютон, Д. Тревор; Китинг, Томас А .; Alm, Ричард А .; и другие. (2007). «Использование структурного и регуляторного разнообразия в глутамат рацемазах». Природа. 447 (7146): 817–22. Bibcode:2007Натура.447..817л. Дои:10.1038 / природа05689. PMID 17568739. S2CID 4408683.
- ^ а б Мэй, Мелисса; Мехбуб, Шахила; Малхерн, Дебби С.; Ван, Чжицян; Ю, Хуэйдун; Тэтчер, Грегори Р.Дж .; Santarsiero, Bernard D .; Джонсон, Майкл Э .; и другие. (2007). «Структурный и функциональный анализ двух изозимов глутамат рацемазы из Bacillus anthracis и их значение для разработки ингибиторов». Журнал молекулярной биологии. 371 (5): 1219–37. Дои:10.1016 / j.jmb.2007.05.093. ЧВК 2736553. PMID 17610893.
- ^ а б Taal, Makie A .; Седельникова, Светлана Е .; Ружейников, Сергей Н .; Бейкер, Патрик Дж .; Райс, Дэвид В. (2004). «Экспрессия, очистка и предварительный рентгеноструктурный анализ кристаллов Bacillus subtilisglutamateracemase». Acta Crystallographica Раздел D. 60 (11): 2031–4. Дои:10.1107 / S0907444904021134. PMID 15502318.
- ^ а б Ким, Кук-Хан; Бонг, Янг-Джонг; Пак, Джун Гю; Шин, Ки-Юнг; Хван, Кван Ён; Ким, Юнис Ынкён (2007). «Структурная основа ингибирования глутамат рацемазы». Журнал молекулярной биологии. 372 (2): 434–43. Дои:10.1016 / j.jmb.2007.05.003. PMID 17658548.
- ^ Ashiuchi, M .; Kuwana, E; Ямамото, Т; Komatsu, K; Сода, К; Мисоно, Х (2002). «Глутамат рацемаза - ингибитор эндогенной ДНК-гиразы». Журнал биологической химии. 277 (42): 39070–3. Дои:10.1074 / jbc.C200253200. PMID 12213801.
- ^ Ashiuchi, M .; Tani, K .; Сода, К .; Мисоно, Х. (1998). «Свойства глутамат рацемазы из Bacillus subtilis IFO 3336, продуцирующего поли-глутамат». Журнал биохимии. 123 (6): 1156–63. Дои:10.1093 / oxfordjournals.jbchem.a022055. PMID 9604005.
- ^ Sengupta, S .; Ghosh, S .; Нагараджа, В. (2008). «Подработка глутаматрацемазы из Mycobacterium tuberculosis: ингибирование рацемизации и ДНК-гиразы - два независимых действия фермента». Микробиология. 154 (9): 2796–803. Дои:10.1099 / мик.0.2008 / 020933-0. PMID 18757813.
- ^ Сировер, Майкл А (1999). «Новые взгляды на старый белок: функциональное разнообразие глицеральдегид-3-фосфатдегидрогеназы млекопитающих». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1432 (2): 159–84. Дои:10.1016 / S0167-4838 (99) 00119-3. PMID 10407139.
- ^ Константинидес, С.М. Дело-младший, WC (1969). «Обратимая диссоциация тетрамерной мышечной глицеральдегид-3-фосфатдегидрогеназы кролика на димеры или мономеры аденозинтрифосфатом». Журнал биологической химии. 244 (20): 5695–702. PMID 4312250.
- ^ Кумагаи, H; Сакаи, H (1983). «Белок головного мозга свиньи (белок 35 K), который связывает микротрубочки, и его идентификация как глицеральдегид-3-фосфатдегидрогеназа». Журнал биохимии. 93 (5): 1259–69. Дои:10.1093 / oxfordjournals.jbchem.a134260. PMID 6885722.
- ^ а б Де Риэль, Джон К .; Паулюс, Генри (1978). «Диссоциация субъединиц в аллостерической регуляции глицеринкиназы из Escherichia coli. 2. Физические доказательства». Биохимия. 17 (24): 5141–6. Дои:10.1021 / bi00617a011. PMID 215195.
- ^ а б Де Риэль, Джон К .; Паулюс, Генри (1978). «Субъединичная диссоциация в аллостерической регуляции глицеринкиназы из Escherichia coli. 1. Кинетические доказательства». Биохимия. 17 (24): 5134–40. Дои:10.1021 / bi00617a010. PMID 215194.
- ^ а б Де Риэль, Джон К .; Паулюс, Генри (1978). «Диссоциация субъединиц в аллостерической регуляции глицеринкиназы из Escherichia coli. 3. Роль в десенсибилизации». Биохимия. 17 (24): 5146–50. Дои:10.1021 / bi00617a012. PMID 31903.
- ^ а б Feese, Майкл Д; Фабер, Х. Рик; Bystrom, Cory E; Петтигрю, Дональд В; Ремингтон, С. Джеймс (1998). «Глицеринкиназа из Escherichia coli и мутанта Ala65 → Thr: кристаллические структуры выявляют конформационные изменения с последствиями для аллостерической регуляции». Структура. 6 (11): 1407–18. Дои:10.1016 / S0969-2126 (98) 00140-3. PMID 9817843.
- ^ а б Bystrom, Cory E .; Петтигрю, Дональд У .; Браншо, Брюс П .; О'Брайен, Патрик; Ремингтон, С. Джеймс (1999). «Кристаллические структуры варианта S58 - глицерин киназы Escherichia coli → W в комплексе с негидролизуемыми аналогами АТФ обнаруживают предполагаемую активную конформацию фермента в результате движения домена». Биохимия. 38 (12): 3508–18. Дои:10.1021 / bi982460z. PMID 10090737.
- ^ а б Депрез, Эрик; Таук, Патрик; Лех, Эрве; Мускаде, Жан-Франсуа; Оклер, Кристиан; Брошон, Жан-Клод (2000). «Олигомерные состояния интегразы ВИЧ-1, измеренные с помощью временной флуоресцентной анизотропии». Биохимия. 39 (31): 9275–84. Дои:10.1021 / bi000397j. PMID 10924120.
- ^ а б Deprez, E .; Tauc, P .; Leh, H .; Mouscadet, J.-F .; Auclair, C .; Хокинс, М. Э .; Брошон, Ж.-К. (2001). «Связывание ДНК вызывает диссоциацию мультимерной формы интегразы ВИЧ-1: исследование анизотропии флуоресценции с временным разрешением». Труды Национальной академии наук. 98 (18): 10090–5. Bibcode:2001PNAS ... 9810090D. Дои:10.1073 / pnas.181024498. ЧВК 56920. PMID 11504911.
- ^ а б c Faure, A. l .; Calmels, C; Desjobert, C; Castroviejo, M; Комон-Саркос, А; Тарраго-Литвак, Л; Литвак, С; Париси, V (2005). «Сшитые интегразой олигомеры ВИЧ-1 активны in vitro». Исследования нуклеиновых кислот. 33 (3): 977–86. Дои:10.1093 / нар / gki241. ЧВК 549407. PMID 15718297.
- ^ а б Guiot, E .; Карайон, К; Делелис, О; Саймон, Ф; Tauc, P; Зубин, Э; Готтих, М; Mouscadet, JF; и другие. (2006). «Взаимосвязь между олигомерным статусом интегразы ВИЧ-1 на ДНК и ферментативной активностью». Журнал биологической химии. 281 (32): 22707–19. Дои:10.1074 / jbc.M602198200. PMID 16774912.
- ^ Fieulaine, S .; Морера, S; Понсе, S; Monedero, V; Gueguen-Chaignon, V; Галинье, А; Джанин, Дж; Deutscher, J; и другие. (2001). «Рентгеновская структура киназы HPr: бактериальная протеинкиназа с нуклеотид-связывающим доменом P-петли». Журнал EMBO. 20 (15): 3917–27. Дои:10.1093 / emboj / 20.15.3917. ЧВК 149164. PMID 11483495.
- ^ Маркес, Хосе Антонио; Хасенбейн, Соня; Кох, Бриджит; Фьёлен, Соня; Несслер, Сильви; Рассел, Роберт Б .; Хенгстенберг, Вольфганг; Шеффзек, Клаус (2002). "Структура полноразмерной киназы / фосфатазы HPr из Ксилозный стафилококк с разрешением 1,95 Å: имитирует продукт / субстрат реакций переноса фосфора ». Труды Национальной академии наук. 99 (6): 3458–63. Bibcode:2002ПНАС ... 99.3458М. Дои:10.1073 / pnas.052461499. JSTOR 3058148. ЧВК 122545. PMID 11904409.
- ^ Аллен, Грегори С .; Штайнхауэр, Катрин; Хиллен, Вольфганг; Штюльке, Йорг; Бреннан, Ричард Г. (2003). «Кристаллическая структура киназы / фосфатазы HPr из Mycoplasma pneumoniae». Журнал молекулярной биологии. 326 (4): 1203–17. Дои:10.1016 / S0022-2836 (02) 01378-5. PMID 12589763.
- ^ Понсе, Сандрин; Миякович, Иван; Несслер, Сильви; Геген-Шеньон, Вирджиния; Чапталь, Винсент; Галинье, Анна; Боэль, Грегори; Мазе, Ален; и другие. (2004). «HPr-киназа / фосфорилаза, бифункциональный сенсорный фермент, содержащий мотив Уокера А, контролирующий репрессию катаболита в грамположительных бактериях». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1697 (1–2): 123–35. Дои:10.1016 / j.bbapap.2003.11.018. PMID 15023355.
- ^ а б c d е Ramstrom, H .; Санглир, S; Лейзе-Вагнер, Э; Филипп, C; Ван Дорсселер, А; Хайех, Дж (2002). «Свойства и регуляция бифункциональной ферментной киназы HPr / фосфатазы в Bacillus subtilis». Журнал биологической химии. 278 (2): 1174–85. Дои:10.1074 / jbc.M209052200. PMID 12411438.
- ^ Jault, J.-M .; Fieulaine, S; Несслер, S; Gonzalo, P; Ди Пьетро, А; Deutscher, J; Галинье, А (2000). «Киназа HPr из Bacillus subtilis представляет собой гомоолигомерный фермент, который проявляет сильную положительную кооперативность в отношении связывания нуклеотидов и 1,6-бисфосфата фруктозы». Журнал биологической химии. 275 (3): 1773–80. Дои:10.1074 / jbc.275.3.1773. PMID 10636874.
- ^ Кларк, Энтони Р .; Waldman, Adam D.B .; Манро, Ян; Холбрук, Дж. Джон (1985). «Изменения в состоянии субъединичной ассоциации лактатдегидрогеназы из Bacillus stearothermophilus». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 828 (3): 375–9. Дои:10.1016 / 0167-4838 (85) 90319-Х. PMID 3986214.
- ^ а б c d е Кларк, Энтони Р .; Waldman, Adam D.B .; Харт, Кейт У .; Джон Холбрук, Дж. (1985). «Скорость определенных изменений в структуре белка во время каталитического цикла лактатдегидрогеназы». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 829 (3): 397–407. Дои:10.1016 / 0167-4838 (85) 90250-Х. PMID 4005269.
- ^ Кларк, Энтони Р .; Wigley, Dale B .; Барстоу, Дэвид А .; Чиа, Уильям Н .; Аткинсон, Тони; Холбрук, Дж. Джон (1987). «Замена одной аминокислоты нарушает регуляцию бактериальной лактатдегидрогеназы и стабилизирует ее тетрамерную структуру». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 913 (1): 72–80. Дои:10.1016/0167-4838(87)90234-2. PMID 3580377.
- ^ Кэмерон, Александр Д .; Ропер, Дэвид I .; Мортон, Кэтлин М .; Мюрхед, Хилари; Холбрук, Дж. Джон; Уигли, Дейл Б. (1994). «Аллостерическая активация лактатдегидрогеназы Bacillus stearothermophilus, исследованная с помощью рентгеновского кристаллографического анализа мутанта, предназначенного для предотвращения тетрамеризации фермента». Журнал молекулярной биологии. 238 (4): 615–25. Дои:10.1006 / jmbi.1994.1318. PMID 8176749.
- ^ а б c Рудяк, Станислав Г .; Шрейдер, Томас Э. (1998). «Функциональная роль N-концевой области протеазы Lon из Mycobacterium smegmatis». Биохимия. 37 (32): 11255–63. Дои:10.1021 / bi980945h. PMID 9698372.
- ^ а б c Рудяк, Станислав Г .; Бреновиц, Майкл; Шрейдер, Томас Э. (2001). «Mg2 + -связанная олигомеризация модулирует каталитическую активность протеазы Lon (La) из Mycobacterium smegmatis». Биохимия. 40 (31): 9317–23. Дои:10.1021 / bi0102508. PMID 11478899.
- ^ а б Виноградник, Диана; Паттерсон-Уорд, Джессика; Ли, Ирэн (2006). «Однооборотные кинетические эксперименты подтверждают существование сайтов АТФазы с высоким и низким сродством в протеазе Escherichia coliLon». Биохимия. 45 (14): 4602–10. Дои:10.1021 / bi052377t. ЧВК 2515378. PMID 16584195.
- ^ а б Ян, Чжиру; Лэнкс, Чарльз У .; Тонг, Лян (2002). «Молекулярный механизм регуляции человеческого митохондриального NAD (P) + - зависимого яблочного фермента с помощью АТФ и фумарата». Структура. 10 (7): 951–60. Дои:10.1016 / S0969-2126 (02) 00788-8. PMID 12121650.
- ^ а б Джеральд Э, Эдвардс; Карлос с, Андрео (1992). «НАДФ-яблочный фермент из растений». Фитохимия. 31 (6): 1845–57. Дои:10.1016/0031-9422(92)80322-6. PMID 1368216.
- ^ Hsieh, J.-Y .; Chen, S.-H .; Hung, H.-C. (2009). «Функциональные роли тетрамерной организации яблочного фермента». Журнал биологической химии. 284 (27): 18096–105. Дои:10.1074 / jbc.M109.005082. ЧВК 2709377. PMID 19416979.
- ^ Пул, Лесли Б. (2005). «Бактериальная защита против оксидантов: механические особенности цистеиновых пероксидаз и их флавопротеинредуктаз». Архивы биохимии и биофизики. 433 (1): 240–54. Дои:10.1016 / j.abb.2004.09.006. PMID 15581580.
- ^ Аран, Мартин; Ферреро, Диего С .; Пагано, Эдуардо; Волосюк, Рикардо А. (2009). «Типичные 2-Cys пероксиредоксины - модуляция ковалентными превращениями и нековалентными взаимодействиями». Журнал FEBS. 276 (9): 2478–93. Дои:10.1111 / j.1742-4658.2009.06984.x. PMID 19476489.
- ^ Бьёрго, Элиза; Де Карвалью, Ракель Маргарида Неграо; Флэтмарк, Торгейр (2001). «Сравнение кинетических и регуляторных свойств тетрамерной и димерной форм дикого типа и мутантной Thr427 → Pro фенилаланингидроксилазы человека». Европейский журнал биохимии. 268 (4): 997–1005. Дои:10.1046 / j.1432-1327.2001.01958.x. PMID 11179966.
- ^ Мартинес, Аврора; Кнаппског, Пер М .; Олафсдоттир, Сигридур; Døskeland, Anne P .; Эйкен, Ханс Гейр; Свебак, Рэнди Мирсет; Боззини, МериЛиза; Аполд, Джаран; и другие. (1995). «Экспрессия рекомбинантной фенилаланингидроксилазы человека в виде слитого белка в кишечная палочка предотвращает протеолитическую деградацию протеазами клетки-хозяина. Выделение и характеристика фермента дикого типа ». Биохимический журнал. 306 (2): 589–97. Дои:10.1042 / bj3060589. ЧВК 1136558. PMID 7887915.
- ^ Кнаппског, Пер М .; Флэтмарк, Торгейр; Aarden, Johanna M .; Хаавик, Ян; Мартинес, Аврора (1996). «Структура / функциональные отношения в человеческой фенилаланингидроксилазе. Влияние концевых делеций на олигомеризацию, активацию и кооперативность связывания субстрата с ферментом». Европейский журнал биохимии. 242 (3): 813–21. Дои:10.1111 / j.1432-1033.1996.0813r.x. PMID 9022714.
- ^ Филлипс, Роберт С .; Парняк, Майкл А .; Кауфман, Сеймур (1984). «Спектроскопическое исследование взаимодействия лиганда с печеночной фенилаланингидроксилазой: свидетельства конформационных изменений, связанных с активацией». Биохимия. 23 (17): 3836–42. Дои:10.1021 / bi00312a007. PMID 6487579.
- ^ Fusetti, F .; Erlandsen, H; Flatmark, T; Стивенс, Р. К. (1998). «Структура тетрамерной фенилаланингидроксилазы человека и ее значение для фенилкетонурии». Журнал биологической химии. 273 (27): 16962–7. Дои:10.1074 / jbc.273.27.16962. PMID 9642259.
- ^ а б c d е ж Wohl, RC; Маркус, G (1972). «Фосфоенолпируваткарбоксилаза Escherichia coli. Очистка и некоторые свойства». Журнал биологической химии. 247 (18): 5785–92. PMID 4560418.
- ^ Кай, Ясуши; Мацумура, Хироёши; Идзуи, Кацура (2003). «Фосфоенолпируваткарбоксилаза: трехмерная структура и молекулярные механизмы». Архивы биохимии и биофизики. 414 (2): 170–9. Дои:10.1016 / S0003-9861 (03) 00170-X. PMID 12781768.
- ^ а б c Сюй, Цзин; Осима, Тайро; Ёсида, Масасукэ (1990). «Тетрамер-димерное превращение фосфофруктокиназы из Thermus thermophilus, индуцированное его аллостерическими эффекторами». Журнал молекулярной биологии. 215 (4): 597–606. Дои:10.1016 / S0022-2836 (05) 80171-8. PMID 2146397.
- ^ Джолли-младший, RL; Мейсон, HS (1965). "Множественные формы грибной тирозиназы. Взаимопревращение". Журнал биологической химии. 240: PC1489–91. PMID 14284774.
- ^ Джолли-младший, RL; Робб, DA; Мейсон, HS (1969). «Множественные формы грибной тирозиназы. Явления ассоциации-диссоциации». Журнал биологической химии. 244 (6): 1593–9. PMID 4975157.
- ^ Mallette, MF; Доусон, CR (1949). «О природе высокоочищенных препаратов грибной тирозиназы». Архивы биохимии. 23 (1): 29–44. PMID 18135760.
- ^ а б Хазарра, Соледад; Гарсиа-Кармона, Франсиско; Кабанес, Хуана (2001). «Гистерезис и положительная кооперативность полифенолоксидазы салата айсберг». Сообщения о биохимических и биофизических исследованиях. 289 (3): 769–75. Дои:10.1006 / bbrc.2001.6014. PMID 11726215.
- ^ Harel, E .; Майер, А. (1968). «Взаимопревращение субъединиц катехолоксидазы из хлоропластов яблони». Фитохимия. 7 (2): 199–204. Дои:10.1016 / S0031-9422 (00) 86315-3.
- ^ а б Джаффе Е.К., Лоуренс С.Х. (март 2012 г.). «Аллостерия и динамическая олигомеризация порфобилиногенсинтазы». Arch. Biochem. Биофизы. 519 (2): 144–53. Дои:10.1016 / j.abb.2011.10.010. ЧВК 3291741. PMID 22037356.
- ^ Брейниг С., Кервинен Дж., Стит Л., Уоссон А.С., Фэрман Р., Влодавер А., Зданов А., Яффе Е.К. (сентябрь 2003 г.). «Контроль биосинтеза тетрапирролов с помощью альтернативных четвертичных форм порфобилиногенсинтазы». Nat. Struct. Биол. 10 (9): 757–63. Дои:10.1038 / nsb963. PMID 12897770. S2CID 24188785.
- ^ а б Schulz, Ju¨Rgen; Спарманн, Гизела; Хофманн, Эберхард (1975). «Опосредованная аланином обратимая инактивация пируваткиназы опухоли, вызванная переходом тетрамер-димер». Письма FEBS. 50 (3): 346–50. Дои:10.1016/0014-5793(75)90064-2. PMID 1116605. S2CID 5665440.
- ^ а б Ибсен, KH; Шиллер, кВт; Хаас, Т.А. (1971). «Взаимопревращаемые кинетические и физические формы пируваткиназы эритроцитов человека». Журнал биологической химии. 246 (5): 1233–40. PMID 5545066.
- ^ Лю, Яншунь; Готте, Джованни; Либонати, Массимо; Айзенберг, Дэвид (2009). «Структуры двух трехмерных тримеров РНКазы а с заменой доменов». Белковая наука. 11 (2): 371–80. Дои:10.1110 / пс. 36602. ЧВК 2373430. PMID 11790847.
- ^ а б Готте, Джованни; Бертольди, Мариарита; Либонати, Массимо (1999). «Структурная универсальность бычьей рибонуклеазы А. Разные конформеры тримерных и тетрамерных агрегатов фермента». Европейский журнал биохимии. 265 (2): 680–7. Дои:10.1046 / j.1432-1327.1999.00761.x. PMID 10504400.
- ^ Готте, Джованни; Laurents, Douglas V .; Либонати, Массимо (2006). «Трехмерные олигомеры рибонуклеазы А с заменой домена: идентификация пятого тетрамера, пентамеров и гексамеров, а также обнаружение следов гептамерных, октамерных и неамерных разновидностей». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1764 (1): 44–54. Дои:10.1016 / j.bbapap.2005.10.011. PMID 16310422.
- ^ а б Готте, Джованни; Либонати, Массимо (1998). «Две разные формы агрегированных димеров рибонуклеазы А». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1386 (1): 106–112. Дои:10.1016 / S0167-4838 (98) 00087-9. PMID 9675255.
- ^ а б Либонати, Массимо; Готте, Джованни (2004). «Олигомеризация бычьей рибонуклеазы А: структурные и функциональные особенности ее мультимеров». Биохимический журнал. 380 (2): 311–27. Дои:10.1042 / BJ20031922. ЧВК 1224197. PMID 15104538.
- ^ а б Либонати, М. (2004). «Биологические действия олигомеров рибонуклеазы А». Клеточные и молекулярные науки о жизни. 61 (19–20): 2431–6. Дои:10.1007 / s00018-004-4302-х. PMID 15526151. S2CID 8769502.
- ^ а б Либонати, М; Бертольди, М; Соррентино, S (1996). «Активность двухцепочечной РНК агрегатов рибонуклеазы выше, чем у димеров, увеличивается в зависимости от размера агрегатов». Биохимический журнал. 318 (1): 287–90. Дои:10.1042 / bj3180287. ЧВК 1217620. PMID 8761484.
- ^ а б Libonati, M .; Gotte, G .; Воттариелло, Ф. (2008). «Новые биологические действия, приобретаемые рибонуклеазой посредством олигомеризации». Текущая фармацевтическая биотехнология. 9 (3): 200–9. Дои:10.2174/138920108784567308. PMID 18673285.
- ^ Кашлан, Оссама Б .; Куперман, Барри С. (2003). «Комплексная модель аллостерической регуляции рибонуклеотидредуктазы млекопитающих: уточнения и последствия †». Биохимия. 42 (6): 1696–706. Дои:10.1021 / bi020634d. PMID 12578384.
- ^ Кашлан, Оссама Б .; Скотт, Чарльз П .; Лир, Джеймс Д .; Куперман, Барри С. (2002). «Комплексная модель аллостерической регуляции рибонуклеотидредуктазы млекопитающих. Функциональные последствия олигомеризации большой субъединицы, индуцированной АТФ и дАТФ †». Биохимия. 41 (2): 462–74. Дои:10.1021 / bi011653a. PMID 11781084.
- ^ Эрикссон, Матиас; Улин, Улла; Рамасвами, S; Экберг, Моника; Регнстрём, Карин; Шёберг, Бритт-Мари; Эклунд, Ханс (1997). «Связывание аллостерических эффекторов с белком рибонуклеотидредуктазы R1: уменьшение цистеинов активного центра способствует связыванию субстрата». Структура. 5 (8): 1077–92. Дои:10.1016 / S0969-2126 (97) 00259-1. PMID 9309223.
- ^ а б Фэрман, Джеймс Уэсли; Виджератна, Санат Ранджан; Ахмад, М. Фаиз; Сюй, Хай; Накано, Ре; Джха, Шалини; Прендергаст, Джей; Велин, Р. Мартин; и другие. (2011). «Структурная основа аллостерической регуляции рибонуклеотидредуктазы человека путем нуклеотид-индуцированной олигомеризации». Структурная и молекулярная биология природы. 18 (3): 316–22. Дои:10.1038 / nsmb.2007. ЧВК 3101628. PMID 21336276.
- ^ а б Hohman, R.J .; Guitton, M.C .; Верон М. (1984). «Очистка S-аденозил-1-гомоцистеин гидролазы из Dictyostelium discoideum: обратимая инактивация цАМФ и 2'-дезоксиаденозином». Архивы биохимии и биофизики. 233 (2): 785–95. Дои:10.1016/0003-9861(84)90507-1. PMID 6091559.
- ^ Гурановски, Анджей; Павелкевич, Ежи (1977). «Аденозилгомоцистеиназа из семян желтого люпина. Очистка и свойства». Европейский журнал биохимии. 80 (2): 517–23. Дои:10.1111 / j.1432-1033.1977.tb11907.x. PMID 923592.
- ^ Kajander, EO; Райна, AM (1981). «Аффинно-хроматографическая очистка S-аденозил-L-гомоцистеингидролазы. Некоторые свойства фермента из печени крысы». Биохимический журнал. 193 (2): 503–12. Дои:10.1042 / bj1930503. ЧВК 1162632. PMID 7305945.
- ^ а б c Саэки, Й; Ито, S; Шизута, Y; Hayaishi, O; Кагамияма, H; Вада, H (1977). «Субъединичная структура биодеградационной треониндезаминазы». Журнал биологической химии. 252 (7): 2206–8. PMID 321452.
- ^ а б c Филлипс, A.T .; Вуд, W.A. (1964). «Основа для активации АМФ« биоразлагаемой »треониндегидразы из». Сообщения о биохимических и биофизических исследованиях. 15 (6): 530–535. Дои:10.1016 / 0006-291X (64) 90499-1.
- ^ а б c Герлт, JA; Рабинович, KW; Данн, CP; Вуд, Вашингтон (1973). «Механизм действия активируемой 5'-адениловой кислотой треониндегидразы. V. Связь между лиганд-индуцированной аллостерической активацией и взаимопревращением протомеролигомера». Журнал биологической химии. 248 (23): 8200–6. PMID 4584826.
- ^ Аддингтон, Адель К .; Джонсон, Дэвид А. (1996). «Инактивация триптазы легких человека: данные о повторно активируемых тетрамерных промежуточных и активных мономерах». Биохимия. 35 (42): 13511–8. Дои:10.1021 / bi960042t. PMID 8885830.
- ^ Фахардо, Игнасио; Пейлер, Гуннар (2003). «Образование активных мономеров из тетрамерной β-триптазы человека». Биохимический журнал. 369 (3): 603–10. Дои:10.1042 / BJ20021418. ЧВК 1223112. PMID 12387726.
- ^ Фукуока, Ёсихиро; Шварц, Лоуренс Б. (2004). "Человеческая β-триптаза: обнаружение и характеристика активного мономера и предотвращение восстановления тетрамера ингибиторами протеазы". Биохимия. 43 (33): 10757–64. Дои:10.1021 / bi049486c. PMID 15311937.
- ^ Фукуока, Y; Шварц, LB (2006). «Моноклональное антитело против триптазы B12 разрушает тетрамерную структуру бета-триптазы, стабилизированной гепарином, с образованием мономеров, которые неактивны при нейтральном pH и активны при кислом pH». Журнал иммунологии. 176 (5): 3165–72. Дои:10.4049 / jimmunol.176.5.3165. ЧВК 1810230. PMID 16493076.
- ^ Фукуока, Ёсихиро; Шварц, Лоуренс Б. (2007). «Активные мономеры β-триптазы человека обладают повышенной субстратной специфичностью». Международная иммунофармакология. 7 (14): 1900–8. Дои:10.1016 / j.intimp.2007.07.007. ЧВК 2278033. PMID 18039527.
- ^ Hallgren, J .; Спиллманн, Д; Пейлер, Г. (2001). «Структурные требования и механизм для индуцированной гепарином активации рекомбинантной триптазы тучных клеток мыши, протеазы тучных клеток мыши-6. ОБРАЗОВАНИЕ АКТИВНЫХ МОНОМЕРОВ ТРИПТАЗЫ В ПРИСУТСТВИИ НИЗКОГО МОЛЕКУЛЯРНОГО ГЕПАРИНА». Журнал биологической химии. 276 (46): 42774–81. Дои:10.1074 / jbc.M105531200. PMID 11533057.
- ^ Schechter, Norman M .; Чой, Ын-Юнг; Селвуд, Тревор; МакКаслин, Даррелл Р. (2007). «Характеристика трех различных каталитических форм человеческой триптазы-β: их взаимосвязь и актуальность». Биохимия. 46 (33): 9615–29. Дои:10.1021 / bi7004625. PMID 17655281.
- ^ Schechter, Norman M .; Eng, Grace Y .; Селвуд, Тревор; МакКаслин, Даррелл Р. (1995). «Структурные изменения, связанные со спонтанной инактивацией сериновой протеиназы человеческой триптазы». Биохимия. 34 (33): 10628–38. Дои:10.1021 / bi00033a038. PMID 7654717.
- ^ Шварц, Лоуренс Б. (1994). «[6] Триптаза: сериновая протеаза тучных клеток». Протеолитические ферменты: сериновые и цистеиновые пептидазы. Методы в энзимологии. 244. стр.88–100. Дои:10.1016/0076-6879(94)44008-5. ISBN 978-0-12-182145-6. PMID 7845247.
- ^ Strik, Merel C.M .; Вольбинк, Анджела; Воутерс, Дорин; Bladergroen, Bellinda A .; Verlaan, Angelique R .; van Houdt, Inge S .; Хиджлкема, Санне; Хак, К. Эрик; и другие. (2004). «Внутриклеточный серпин SERPINB6 (PI6) обильно экспрессируется тучными клетками человека и образует комплексы с мономерами β-триптазы». Кровь. 103 (7): 2710–7. Дои:10.1182 / кровь-2003-08-2981. PMID 14670919.
- ^ а б Козик, Анджей; Потемпа, Ян; Трэвис, Джеймс (1998). «Самопроизвольная инактивация триптазы легких человека по результатам анализа методом эксклюзионной хроматографии и химического сшивания: диссоциация активного тетрамерного фермента на неактивные мономеры является основным событием всего процесса». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1385 (1): 139–48. Дои:10.1016 / S0167-4838 (98) 00053-3. PMID 9630576.
- ^ Alzani, R .; Cozzi, E .; Corti, A .; Temponi, M .; Trizio, D .; Gigli, M .; Риццо, В. (1995). «Механизм индуцированной сурамином деолигомеризации фактора некроза опухоли альфа». Биохимия. 34 (19): 6344–50. Дои:10.1021 / bi00019a012. PMID 7756262.
- ^ Корти, А; Фассина, G; Marcucci, F; Barbanti, E; Кассани, G (1992). «Олигомерный фактор некроза опухоли альфа медленно превращается в неактивные формы на биологически активных уровнях». Биохимический журнал. 284 (3): 905–10. Дои:10.1042 / bj2840905. ЧВК 1132625. PMID 1622406.
- ^ Хлодан, Роман; Боль, Роджер Х. (1995). «Путь складывания и сборки фактора некроза опухоли TNFalpha, глобулярного тримерного белка». Европейский журнал биохимии. 231 (2): 381–7. Дои:10.1111 / j.1432-1033.1995.tb20710.x. PMID 7635149.
- ^ а б c d Дженсен, Кай Франк; Mygind, Бенте (1996). «Различные олигомерные состояния участвуют в аллостерическом поведении урацилфосфорибозилтрансферазы из Escherichia Coli». Европейский журнал биохимии. 240 (3): 637–45. Дои:10.1111 / j.1432-1033.1996.0637h.x. PMID 8856065.