WikiDer > Нанооболочка
| Часть серии статей о |
| Наномедицина |
|---|
| Смотрите также |
А нанооболочка, а точнее нанооболочка плазмон, представляет собой тип сферической наночастицы, состоящей из диэлектрического ядра, которое покрыто тонкой металлической оболочкой (обычно золото).[1] Эти нанооболочки включают квазичастица называется плазмон которое представляет собой коллективное возбуждение или квантовые плазменные колебания, при которых электроны колеблются одновременно относительно всех ионов.
Одновременное колебание можно назвать гибридизацией плазмонов, где настраиваемость колебаний связана со смесью внутренней и внешней оболочки, где они гибридизируются, чтобы дать более низкую или более высокую энергию. Эта более низкая энергия сильно влияет на падающий свет, тогда как более высокая энергия препятствует связыванию и слабо сочетается с падающим светом. Взаимодействие гибридизации сильнее для более тонких слоев оболочки, следовательно, толщина оболочки и общий радиус частицы определяют, с какой длиной волны света она взаимодействует.[2] Нанооболочки можно варьировать в широком диапазоне световой спектр который охватывает видимый и ближний инфракрасный диапазоны. Взаимодействие света и наночастиц влияет на размещение зарядов, что влияет на прочность связи. Падающий свет, поляризованный параллельно подложке, дает s-поляризацию (рис. 1b), следовательно, заряды находятся дальше от поверхности подложки, что дает более сильное взаимодействие между оболочкой и сердечником. В противном случае образуется p-поляризация, которая дает более сильно смещенную энергию плазмона, вызывая более слабое взаимодействие и связь.
Открытие
Открытие нанооболочки сделал профессор Наоми Дж. Халас и ее команда из Университета Райса в 2003 году. Когда она и ее команда открыли нанооболочки, они изначально не были уверены, какой потенциал у таких нанооболочек. «Мы сказали:« Ну и что в этом хорошего? »- сказал Халас CNN. После множества предложений терапия рака возникла в результате продолжающегося сотрудничества с биоинженерами, ищущими различные виды биомедицинских приложений.[3] «Одно из наших видений», - заявил Халас, - «не меньше, чем диагностика и лечение рака за один визит».[4] В 2003 году Халас был награжден за лучшее открытие 2003 года. Нанотехнологии сейчас.[4]
Производство
Современным методом синтеза золотых нанооболочек является использование микрофлюидных композитных пен. Этот метод может заменить стандартный литографический метод синтеза плазмонных нанооболочек. Описанный ниже производственный процесс был экспериментом, проведенным Суханьей Дурайсвами и Саифом А. Ханом из Департамента химической и биомолекулярной инженерии в Сингапуре. Хотя этот метод был экспериментом, он представляет будущее синтеза нанооболочек.
Материалы, необходимые для производства нанооболочек, следующие: Тетраэтилортосиликат, гидроксид аммония, гидроксиламина гидрохлорид, 3-аминопропилтрис, тригидрат тетрахлораурата (III), тетракис (гидроксиметил) фосфония хлорид, гидроксид натрия, карбонат калия, этанол, сверхчистая вода и стеклянная посуда, промытая в царской водке и тщательно промытая в воде.[5])
Первым шагом в синтезе нанооболочек в этом методе является создание устройства, внутри которого происходит реакция. Узоры микрожидкостных устройств были изготовлены на кремниевых пластинах с помощью стандартной фотолитографии с использованием негативного фоторезиста SU-8 2050. Затем устройства были отлиты в поли (диметилсилоксан) (ПДМС) с использованием техники мягкой литографии. (40) Вкратце, ПДМС был отлит на SU- 8 мастеров при 70 ° C в течение 4 часов, очищенных, нарезанных и очищенных. Впускные и выпускные отверстия (наружный диаметр 1/16 дюйма) были пробиты в устройстве. Микроканалы необратимо связывались с предметным стеклом, предварительно покрытым тонким слоем PDMS после короткой 35-секундной обработки воздушной плазмой. Микроканалы имеют прямоугольное поперечное сечение, ширину 300 мкм, глубину 155 мкм и длину 0,45 м.[5]
Фактическое производство наночастиц включает закачку «силиконового масла, смеси частиц диоксида кремния с золотыми затравками и раствора для золочения и раствора восстанавливающего агента в микрофлюидное устройство, в то время как газообразный азот подавался из баллона».[5] Затем раствор для нанесения покрытий оставляли для старения в контролируемой среде более чем на 24 часа. После процесса старения жидкость собирается из микрофлюидного устройства и помещается в центрифугу. Полученная жидкость имеет слой масла на поверхности, а под ним раствор, содержащий нанооболочки.
Причина, по которой этот метод является революционным, заключается в том, что размер и относительную толщину золотой нанооболочки можно контролировать, изменяя время, в течение которого может происходить реакция, а также концентрацию раствора для покрытия. Таким образом, исследователи могут адаптировать частицы к своим потребностям. Хотя для лечения оптики или рака.
Лечение рака
Наночастицы с золотой оболочкой, которые представляют собой сферические наночастицы с диоксидом кремния и / или ядрами липосом.[6] и золотые ракушки используются в терапии рака и улучшении биовизуализации.Тераностические зонды - способны обнаруживать и лечить рак за один прием - наночастицы которые имеют участки связывания на своей оболочке, которые позволяют им прикрепляться к желаемому месту (обычно раковые клетки), затем могут быть визуализированы через двойная модальность изображений (стратегия визуализации с использованием рентгеновских лучей и радионуклидная визуализация) и с помощью флуоресценции в ближнем инфракрасном диапазоне.[7] Причина, по которой наночастицы золота используются, связана с их яркими оптическими свойствами, которые контролируются их размером, геометрией и их поверхностными плазмонами. Золотые наночастицы (такие как AuNP) обладают преимуществом биосовместимости и гибкости, позволяющей иметь несколько различных молекул и основных материалов, прикрепленных к их оболочке (почти все, что обычно может быть прикреплено к золоту, может быть прикреплено к золотой наноболочке, которые можно использовать при выявлении и лечении рака). Лечение рака возможно только благодаря рассеянию и поглощению, которое происходит при плазмоника. При рассеянии позолоченные наночастицы становятся видимыми для процессов визуализации, которые настроены на правильную длину волны, которая зависит от размера и геометрии частиц. При абсорбции фототермическая абляция происходит, что нагревает наночастицы и их ближайшее окружение до температур, способных убить раковые клетки. Это достигается с минимальным повреждением клеток в организме за счет использования «водяного окна» (спектральный диапазон от 800 до 1300 нм).[1] Поскольку человеческое тело состоит в основном из воды, это позволяет оптимизировать используемый свет по сравнению с визуализируемыми эффектами.
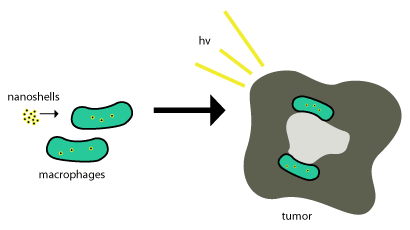
Эти золотые нанооболочки перемещаются в опухоли с помощью фагоцитоз, где фагоциты поглощают нанооболочки через клеточную мембрану с образованием внутренней фагосомы, или макрофаг. После этого его отправляют в камеру и ферменты обычно используются для его метаболизма и вывоза обратно из клетки. Эти нанооболочки не метаболизируются, поэтому для того, чтобы они были эффективными, они просто должны находиться в пределах опухолевые клетки и фотоиндуцированная гибель клеток (как описано выше) используется для уничтожения опухолевых клеток. Эта схема представлена на рисунке 2.
Терапевтические средства на основе наночастиц успешно применяются в опухолях за счет использования эффекта повышенной проницаемости и удерживания, свойства, которое позволяет наноразмерным структурам пассивно внедряться в опухоли без помощи антител [4]. Доставка нанооболочек в важные области опухолей может быть очень сложной. Именно здесь большинство нанооболочек пытаются использовать естественный набор опухоли моноциты для доставки, как показано на рисунке выше. Эта система доставки называется «троянский конь».[8]
Этот процесс работает так хорошо, так как опухоли состоят из ¾ макрофагов, и как только моноциты попадают в опухоль, они дифференцируются в макрофаги, которые также будут необходимы для поддержания груза. наночастицы. Как только нанооболочки оказываются в некротическом центре, используется ближнее инфракрасное освещение для разрушения связанных с опухолью макрофагов.
Кроме того, эти наночастицы можно заставить высвобождать олигонуклеотиды антисмысловой ДНК при фотоактивации. Эти олигонуклеотиды используются в сочетании с процедурами фототермической абляции для проведения генной терапии. Это достигается за счет того, что комплексы наночастиц доставляются внутрь клеток, а затем подвергаются индуцированному светом высвобождению ДНК с их поверхности. Это позволит осуществлять внутренние манипуляции с ячейкой и предоставит средства для наблюдения за возвращением групповых ячеек в состояние равновесия.[9]
Другой пример плазмоники нанооболочек в лечении рака включает размещение лекарств внутри наночастицы и использование ее в качестве средства доставки токсичных лекарств только к злокачественным участкам.[10] Это достигается путем покрытия наночастицы снаружи оксида железа (что позволяет легко отслеживать с помощью Аппарат МРТ), затем, как только область опухоли покрывается наночастицами, наполненными лекарством, наночастицы могут быть активированы с помощью резонансных световых волн для высвобождения лекарства.
Смотрите также
Рекомендации
- ^ а б Loo, C; Линь, А; Hirsch, L; Ли, Mh; Бартон, Дж; Халас, N; Запад, Дж; Дрезек, Р. (февраль 2004 г.). «Визуализация и терапия рака на основе фотоники с помощью наноболочек». Технологии в исследовании и лечении рака. 3 (1): 33–40. Дои:10.1177/153303460400300104. PMID 14750891. Архивировано из оригинал (Бесплатный полный текст) 23 октября 2007 г.. Получено 6 августа 2009.
- ^ Бринсон, Ве; Ласситер, Jb; Левин, Кс; Бардхан, Р; Мирин, Н; Халас, Нью-Джерси (ноябрь 2008 г.). «Наночастицы стали проще: улучшение роста слоя Au на поверхности наночастиц». Langmuir. 24 (24): 14166–14171. Дои:10.1021 / la802049p. ЧВК 5922771. PMID 19360963.
- ^ CNN. «Биография: Наоми Халас». CNN. Сеть кабельных новостей, 11 марта 2008 г. Интернет. 7 мая 2012 года. <http://edition.cnn.com/2007/TECH/science/06/11/halas.biog/>.
- ^ а б «Лучшие открытия». - Лучшее из нанотехнологий. Нанотехнологии сейчас, 29 марта 2008 г. Web. 7 мая 2012 года. <http://www.nanotech-now.com/2003-Awards/Best-Discoveries-2003.htm>.
- ^ а б c Дурайсвами, Суханья; Хан, Саиф (23 августа 2010 г.). «Плазмонный синтез наноболочек в микрожидкостных композитных пенах». Нано буквы. 9. 10 (9): 3757–3763. Bibcode:2010NanoL..10.3757D. Дои:10.1021 / nl102478q. PMID 20731386.
- ^ Аббаси, Акрам; Парк, Кеунхан; Бозе, Ариджит; Ботун, Джеффри Д. (30 мая 2017 г.). "Чувствительные в ближнем инфракрасном диапазоне - слоистые золотые наноболочки". Langmuir. 33 (21): 5321–5327. Дои:10.1021 / acs.langmuir.7b01273. ISSN 0743-7463. PMID 28486807.
- ^ Бардхан, Р; Grady, Nk; Халас, Нью-Джерси (сентябрь 2008 г.). «Наноразмерное управление усилением флуоресценции в ближнем инфракрасном диапазоне с использованием наноболочек Au». Нано Микро Малый. 4 (10): 1716–1722. Дои:10.1002 / smll.200800405. PMID 18819167.
- ^ Чой, мистер; Стэнтон-Макси, Кейджи; Стэнли, Дж. Левин, Кс; Бардхан, Р; Сорт; Badve, S; Стерджис, Дж; Робинсон, Дж. П.; Башир, Р; Халас, штат Нью-Джерси; Клэр, Се (декабрь 2007 г.). «Клеточный троян для доставки терапевтических наночастиц в опухоли». Нано буквы. 7 (12): 3759–65. Bibcode:2007NanoL ... 7.3759C. Дои:10.1021 / nl072209h. PMID 17979310.
- ^ Бардан, Р; Лал, S; Джоши, А; Халас, Нью-Джерси (май 2011 г.). «Тераностические нанооболочки: от дизайна зонда до визуализации и лечения рака». Отчеты о химических исследованиях. 44 (10): 936–946. Дои:10.1021 / ar200023x. ЧВК 3888233. PMID 21612199.
- ^ https://www.sciencedaily.com/releases/2006/11/061115085736.htm