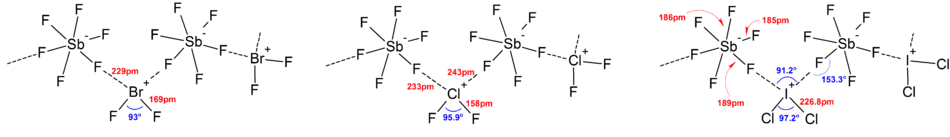WikiDer > Ионы полигалогенов - Википедия
Ионы полигалогенов являются группой многоатомных катионы и анионы содержащий галогены Только. Ионы можно разделить на два класса: ионы изополигалогена, которые содержат только один тип галогена, и ионы гетерополигалогена с более чем одним типом галогена.
Вступление
Были обнаружены многочисленные ионы полигалогенов, их соли изолированы в твердом состоянии и структурно охарактеризованы. В следующих таблицах представлены виды, обнаруженные на данный момент.[1][2][3][4][5]
Катионы изополигалогенов Диатомовые виды * [Cl2]+, [Br2]+, [Я2]+ Трехатомные виды [Cl3]+, [Br3]+, [Я3]+ Тетраатомные виды [Cl4]+, [Я4]2+ Пентаатомные виды [Br5]+, [Я5]+ Гептаатомные виды †[Я7]+ Высшие виды [Я15]3+
- * [Cl2]+ может существовать только как [Cl2О2]2+ при низких температурах зарядно-переносной комплекс из О2 к [Cl2]+.[2] Свободный [Cl2]+ известен только из его электронного зонного спектра, полученного в разрядной трубке низкого давления.[3]
- † Существование [Я7]+ возможно, но все еще сомнительно.[1]
Катионы гетерополигалогенов Трехатомные виды [ClF2]+, [Cl2F]+, [BrF2]+, [ЕСЛИ2]+, [ICl2]+, [IBrCl]+, [IBr2]+, [Я2Cl]+, [Я2Br]+ Пентаатомные виды [ClF4]+, [BrF4]+, [ЕСЛИ4]+, [Я3Cl2]+ Гептаатомные виды [ClF6]+, [BrF6]+, [ЕСЛИ6]+
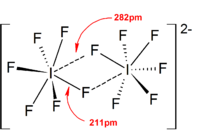
Изополигалогеновые анионы Трехатомные виды [Cl3]−, [Br3]−, [Я3]− Тетраатомные виды [Br4]2−, [Я4]2− Пентаатомные виды [Я5]− Гептаатомные виды [Я7]− Октаатомные виды [Br8]2−, [Я8]2− Высшие виды [Я9]−, [Я10]2−, [Я10]4−, [Я11]−, [Я12]2−, [Я13]3−, [Я16]2−, [Я22]4−, [Я26]3−, [Я26]4−, [Я28]4−, [Я29]3−
Гетерополигалогеновые анионы Трехатомные виды [ClF2]−, [BrF2]−, [BrCl2]−, [ЕСЛИ2]−, [ICl2]−, [IBrF]−, [IBrCl]−, [IBr2]−, [Я2Cl]−, [Я2Br]−, [AtBrCl]−, [AtBr2]−, [AtICl]−, [AtIBr]−, [AtI2]− Пентаатомные виды [ClF4]−, [BrF4]−, [ЕСЛИ4]−, [ICl3F]−, [ICl4]−, [IBrCl3]−, [Я2Cl3]−, [Я2BrCl2]−, [Я2Br2Cl]−, [Я2Br3]−,[Я4Cl]−, [Я4Br]− Гексаатомные виды [ЕСЛИ5]2− Гептаатомные виды [ClF6]−, [BrF6]−, [ЕСЛИ6]−, [Я3Br4]− Неатомные виды [ЕСЛИ8]−
Структура
Большинство структур ионов было определено ИК спектроскопия, Рамановская спектроскопия и Рентгеновская кристаллография. Ионы полигалогенов всегда имеют самый тяжелый и наименее электроотрицательный галоген, присутствующий в ионе в качестве центрального атома, что в некоторых случаях делает ион асимметричным. Например, [Cl2F]+ имеет структуру [Cl – Cl – F]− но нет [Cl – F – Cl]−.
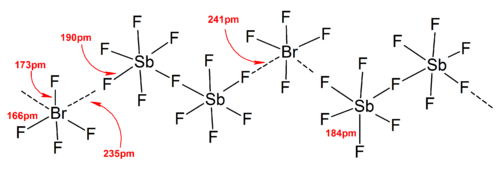
В целом структуры большинства ионов гетерополигалогена и низших ионов изополигалогена соответствовали Модель VSEPR. Однако были исключительные случаи. Например, когда центральный атом тяжелый и имеет семь одинокие пары, Такие как [BrF6]− и [ЕСЛИ6]−, они имеют правильное октаэдрическое расположение фторидных лигандов вместо искаженного из-за наличия стереохимически инертная неподеленная пара. Больше отклонений от идеальной модели VSEPR было обнаружено в твердотельных структурах из-за сильных катион-анионных взаимодействий, что также затрудняет интерпретацию колебательный спектроскопический данные. Во всех известных структурах анионных солей полигалогенов анионы находятся в очень тесном контакте, через галогенные мостики с противокатионами.[4] Например, в твердом состоянии, [ЕСЛИ6]− не является правильно октаэдрическим, поскольку твердотельная структура [Мне4N]+[ЕСЛИ6]− показывает слабо связанный [Я2F11]2− димеры. Значительные катион-анионные взаимодействия были также обнаружены в [BrF2]+[SbF6]−, [ClF2]+[SbF6]−, [BrF4]+[Sb6F11]−.[2]
Общие структуры выбранных ионов гетерополигалогена Линейный (или почти линейный) [ClF2]−, [BrF2]−, [BrCl2]−, [ЕСЛИ2]−, [ICl2]−, [IBr2]−, [Я2Cl]−, [Я2Br]− Согнутый [ClF2]+, [Cl2F]+, [BrF2]+, [ЕСЛИ2]+, [ICl2]+, [Я2Cl]+, [IBr2]+, [Я2Br]+, [IBrCl]+ Квадратный плоский [ClF4]−, [BrF4]−, [ЕСЛИ4]−, [ICl4]− Дисфеноидальный (или качели) [ClF4]+, [BrF4]+, [ЕСЛИ4]+ Пятиугольный плоский ‡[ЕСЛИ5]2− Восьмигранный [ClF6]+, [BrF6]+, [ЕСЛИ6]+, § [ClF6]−, [BrF6]−, [ЕСЛИ6]− Квадратный антипризматический [ЕСЛИ8]−
- ‡ [ЕСЛИ5]2− является одним из двух XYп-типы, известные своей редкой пятиугольной плоской геометрией, другой - [XeF5]−. § [ClF6]− искаженный октаэдрический, так как стереохимический эффект инертной пары несущественен в атоме хлора.
В [Я3Cl2]+ и [Я3Br2]+ ионы имеют транс-Z-типная структура, аналогичная структуре [Я5]+.
Высшие полииодиды
В полииодид ионы имеют гораздо более сложную структуру. Дискретные полииодиды обычно имеют линейную последовательность атомов йода и иодид-ионов и описываются в терминах ассоциации между I2, Я− и я−
3 единиц, что отражает происхождение полииодида. В твердом состоянии полииодиды могут взаимодействовать друг с другом, образуя цепочки, кольца или даже сложные двумерные и трехмерные сети.
Склеивание
Связывание в ионах полигалогенов в основном вызывает преимущественное использование р-орбиталей. Существенное участие d-орбиты в связывании маловероятно, поскольку потребуется много рекламной энергии, в то время как у йодсодержащих видов ожидается скудное участие s-орбиты из-за эффект инертной пары, предположительно по данным Мессбауэровская спектроскопия. Однако ни одна модель связывания не была способна воспроизвести такой широкий диапазон длин и углов связи, наблюдаемых до сих пор.[3]
Как и следовало ожидать из того факта, что электрон удален из разрыхляющая орбиталь когда X2 ионизируется до [X2]+, порядок связи, а также прочность связи в [X2]+ становится больше, следовательно, межатомные расстояния в молекулярном ионе меньше, чем в X2.
Линейные или почти линейные трехатомные полигалогениды имеют более слабые и длинные связи по сравнению со связями в соответствующем двухатомном межгалогене или галогене, что согласуется с дополнительным отталкиванием между атомами при добавлении галогенид-иона к нейтральной молекуле. Другая модель, предполагающая использование теория резонанса существует, например, [ICl2]− можно рассматривать как резонансный гибрид из следующих канонические формы:
Доказательства, подтверждающие эту теорию, исходят из длин облигаций (255 пм в [ICl2]− и 232 вечера в ICl(грамм)) и растяжение связи волновые числа (267 и 222 см−1 для симметричного и асимметричного растяжения в [ICl2]− по сравнению с 384 см−1 в ICl), что предполагает порядок облигаций примерно 1/2 для каждого I – Cl облигации в [ICl2]−, что согласуется с интерпретацией с использованием теории резонанса. Другие трехатомные виды [XY2]− можно интерпретировать аналогичным образом.[2]
Синтез
Образование полигалоген-ионов можно рассматривать как самодиссоциация своего родителя интергалогены или же галогены:
- 2 XYп ⇌ [XYп−1]+ + [XYп+1]−
- 3 х2 ⇌ [X3]+ + [X3]−
- 4 х2 ⇌ [X5]+ + [X3]−
- 5 х2 ⇌ 2 [X2]+ + 2 [X3]−
Катионы полигалогенов
Есть две общие стратегии получения катионов полигалогенов:
- Реагируя на соответствующие межгалогенный с Кислота Льюиса (например, галогениды B, Al, п, В качестве, Sb) либо в инертном, либо в окисляющем растворителе (таком как безводный HF) или без такового с образованием катиона гетерополигалогена.
- XYп + МОЙм → [XYп−1]+ + [МОЙм+1]−
- Посредством окислительного процесса, в котором галоген или межгалоген реагирует с окислителем и кислотой Льюиса с образованием катиона:
- Cl2 + ClF + AsF5 → [Cl3]+[AsF6]−
- В некоторых случаях кислота Льюиса ( фторид акцептор) сам действует как окислитель:
- 3 я2 + 3 SbF5 → 2 [I3]+[SbF6]− + SbF3
Обычно для получения гетерополигалогеновых катионов используют первый метод, а второй применим к обоим. Окислительный процесс полезен при получении катионов. [IBr2]+, [ClF6]+, [BrF6]+, как их родительские интергалогены, IBr3, ClF7, BrF7 соответственно никогда не выделяли:
- Br2 + IOSO2F → [IBr2]+[ТАК3F]−
- 2 ClF5 + 2 птф6 → [ClF6]+[PtF6]− + [ClF4]+[PtF6]−
- BrF5 + [KrF]+[AsF6]− → [BrF6]+[AsF6]− + Kr
Подготовка некоторых отдельных видов кратко описана в таблице ниже с уравнениями:[1][2][3][4]
Синтез некоторых полигалогеновых катионов Разновидность Соответствующее химическое уравнение Требуются дополнительные условия [Cl2]+ (как [Cl2О2]+) Cl2 + [O2]+[SbF6]− → [Cl2О2]+[SbF6]− в безводном HF при низких температурах [Br2]+ Br2 (в БрСО3F) + 3 сбн5 → [Br2]+[Sb3F16]− (не сбалансировано) при комнатной температуре [Я2]+ 2 я2 + S2О6F2 → 2 [I2]+[ТАК3F]− в HSO3F [Cl3]+ Cl2 + ClF + AsF5 → [Cl3]+[AsF6]− при температуре 195К (-78 ° C) [Br3]+ 3 руб.2 + 2 [O2]+[AsF6]− → 2 [Br3]+[AsF6]− + 2 O2 [Я3]+ 3 я2 + S2О6F2 → 2 [I3]+[ТАК3F]− [Cl4]+ 2 Cl2 + IrF6 → [Cl4]+[IrF6]− в безводном HF, при температуре ниже 193 К (-80 ° С) [Я4]2+ 2 я2 + 3 AsF5 → [I4]2+[AsF6−]2 + AsF3 в жидкой SO2 [Br5]+ 8 руб.2 + 3 [XeF]+[AsF6]− → 3 [Br5]+[AsF6]− + 3 Xe + BrF3 [Я5]+ 2 я2 + ICl + AlCl3 → [I5]+[AlCl4]− [Я7]+ 7 я2 + S2О6F2 → 2 я7ТАК3F [ClF2]+ ClF3 + AsF5 → [ClF2]+[AsF6]− [Cl2F]+ 2 ClF + AsF5 → [Cl2F]+[AsF6]− при температуре ниже 197 К [BrF2]+ 5 рублей3 + 2 Au → 3 BrF + 2 [BrF2]+[AuF4]− с избытком BrF3 требуется [ЕСЛИ2]+ ЕСЛИ3 + AsF5 → [ЕСЛИ2]+[AsF6]− [ICl2]+ ICl3 + SbCl5 → [ICl2]+[SbCl6]− [IBr2]+ Br2 + IOSO2F → [IBr2]+[ТАК3F]− [ClF4]+ ClF5 + SbF5 → [ClF4]+[SbF6]− [BrF4]+ BrF5 + AsF5 → [BrF4]+[AsF6]− [ЕСЛИ4]+ ЕСЛИ5 + 2 SbF5 → [ЕСЛИ4]+[Sb2F11]− [ClF6]+ ‡ Cs2NiF6 + 5 AsF5 + ClF5 → [ClF6]+[AsF6]− + Ni [AsF6]2 + 2 CsAsF6 [BrF6]+ [KrF]+[AsF6]− + BrF5 → [BrF6]+[AsF6]− + Kr [ЕСЛИ6]+ ЕСЛИ7 + BrF3 → [ЕСЛИ6]+[BrF4]−
- ‡ В этой реакции активным окислителем является [NiF3]+, который формируется на месте в Cs2NiF6/ AsF5/ ВЧ система. Это еще более мощный окислитель и фторирующий агент, чем PtF6.
Полигалогеновые анионы
Для полигалоген-анионов также существуют две общие стратегии получения:
- Путем реакции межгалогена или галогена с База Льюиса, скорее всего фторид:
- [Et4N]+Y− + XYп → [Et4N]+[XYп+1]−
- Икс2 + X− → Икс−
3
- Путем окисления простых галогениды:
- KI + Cl2 → K+[ICl2]−
Подготовка некоторых отдельных видов кратко описана в таблице ниже с уравнениями:[1][2][3][4]
Синтез некоторых анионов полигалогенов Разновидность Соответствующее химическое уравнение Требуются дополнительные условия [Cl3]−, [Br3]−, [Я3]− Икс2 + X− → [X3]− (X = Cl, Br, I) [Br3]− Br2 + [пБу4N]+Br− → [пБу4N]+[Br3]− в 1,2-дихлорэтан или жидкость диоксид серы. [Br3]− не существует в растворе и образуется только при кристаллизации соли. [Br5]− 2 руб.2 + [пБу4N]+Br− → [пБу4N]+[Br5]− в 1,2-дихлорэтане или жидком диоксиде серы с избытком Br2 [ClF2]− ClF + CsF → Cs+[ClF2]− [BrCl2]−[6]:v1p294 Br2 + Cl2 + 2 CsCl → 2 Cs+[BrCl2]− [ICl2]−[6]:v1p295 KI + Cl2 → K+[ICl2]− [IBr2]−[6]:v1p297 CsI + Br2 → Cs+[IBr2]− [AtBr2]−, [AtICl]−, [AtIBr]−, [AtI2]− ВY + X− → [AtXY]− (X = I, Br, Cl; Y = I, Br) [ClF4]− NOF + ClF3 → [НЕТ]+[ClF4]− [BrF4]− 6 KCl + 8 BrF3 → 6 тыс.+[BrF4]− + 3 Cl2 + Br2 избыток BrF5 нужный [ЕСЛИ4]− 2 XeF2 + [Я4N]+я− → [Я4N]+[ЕСЛИ4]− + 2 Xe реагенты смешивали при 242 K, затем нагревали до 298 K для протекания реакции. [ICl4]−[6]:v1p298 KI + ICl3 → K+[ICl4]− [ЕСЛИ5]2− ЕСЛИ3 + 2 [Я4N]+F− → [Я4N+]2[ЕСЛИ5]2− [ЕСЛИ6]− ЕСЛИ5 + CsF → Cs+[ЕСЛИ6]− [Я3Br4]− [PPh4]+Br− + 3 IBr → [PPh4]+[Я3Br4]− [ЕСЛИ8]− ЕСЛИ7 + [Я4N]+F− → [Я4N]+[ЕСЛИ8]− в ацетонитрил
Высшие полииодиды образуются при кристаллизации растворов, содержащих различные концентрации I− и я2. Например, моногидрат KI3 кристаллизуется, когда насыщенный раствор, содержащий соответствующие количества I2 и KI охлаждается.[6]:v1p294
Характеристики
Стабильность
В общем, большой противокатион или анион (например, CS+, [SbF6]−) может помочь стабилизировать ионы полигалогенов, образующиеся в твердом состоянии из энергия решетки соображений, поскольку эффективность упаковки была увеличена.
Катионы полигалогенов являются сильными окислителями, на что указывает тот факт, что они могут быть получены только в окислительных жидкостях в качестве растворителей, таких как олеум. Наиболее окисляющими и, следовательно, наиболее нестабильными являются виды [X2]+ и [XF6]+ (X = Cl, Br), за которым следует [X3]+ и если6]+.
Стабильность [X2]+ соли (X = Br, I) термодинамически достаточно стабильны. Однако их устойчивость в растворе зависит от суперкислотный растворитель. Например, [I2]+ стабильно в фторантимоновая кислота (ВЧ с 0,2 Н SbF5, ЧАС0 = −20,65), но непропорционально [I3]+, [Я5]+ и я2 когда более слабые акцепторы фтора, например NbF5, TaF5 или же NaF, добавляются вместо SbF5.[4]
- 14 [I2]+ + 5 Ж− → 9 [I3]+ + ЕСЛИ5
Для полигалоген-анионов с одним и тем же катионом более стабильными являются анионы с более тяжелым галогеном в центре, симметричные ионы также более стабильны, чем асимметричные. следовательно, стабильность анионов уменьшается в следующем порядке:
- [Я3]− > [IBr2]− > [ICl2]− > [Я2Br]− > [Br3]− > [BrCl2]− > [Br2Cl]−
Ионы гетерополигалогена с координационным числом, большим или равным четырем, могут существовать только с фторидными лигандами.
Цвет
Большинство полигалоген-ионов имеют интенсивную окраску, которая становится более насыщенной по мере увеличения атомной массы составляющего элемента. Известный крахмал- комплекс йода имеет темно-синий цвет за счет линейного [Я5]− ионы, присутствующие в амилоза спираль.[4] Некоторые цвета обычных видов перечислены ниже:[3]
- флюорокации имеют тенденцию быть бесцветными или бледно-желтыми, другие ионы гетерополигалогена оранжевые, красные или темно-фиолетовые[4]
- соединения [ICl2]+ от винно-красного до ярко-оранжевого; в то время как [Я2Cl]+ от темно-коричневого до пурпурно-черного
- [Cl3]+ желтый
- [Cl4]+ синий[2]
- [Br2]+ вишнево-красный
- [Br3]+ коричневый
- [Br5]+ темно-коричневый
- [Я2]+ ярко-синий
- [Я3]+ от темно-коричневого до черного
- [Я4]2+ от красного до коричневого
- [Я5]+ зеленый или черный, соль [Я5]+[AlCl4]− существует в виде зеленовато-черных игл, но на шлифах выглядит коричнево-красной
- [Я7]+ черный, если его наличие в составе я7ТАК3F был твердо установлен
- [Я15]3+ черный[5]
- [ICl2]− алый красный
- [ICl4]− золотисто-желтый
- полииодиды имеют очень темные цвета, темно-коричневый или темно-синий
Химические свойства
Катионы гетерополигалогенов являются окислителями, способными к взрывной реакции, и катионы часто обладают более высокой реакционной способностью, чем их родительские межгалогеновые соединения, и разлагаются восстановительными путями. Как и ожидалось от максимальной степени окисления +7 в [ClF6]+, [BrF6]+ и [ЕСЛИ6]+, эти частицы являются чрезвычайно сильными окислителями, что демонстрируют реакции, показанные ниже:
Катионы полигалогенов с более низкой степенью окисления имеют тенденцию к непропорционально. Например, [Cl2F]+ нестабильно в растворе и полностью непропорционально HF / SbF5 даже при 197К:
- 2 [Cl2F]+ → [ClF2]+ + [Cl3]+
[Я2]+ обратимо димеризуется при 193 К и наблюдается как синий цвет парамагнитный [Я2]+ резко переходит в красно-коричневый цвет диамагнитный [Я2]+, вместе с каплей в парамагнитная восприимчивость и электрическая проводимость при охлаждении раствора до температуры ниже 193 К:[2]
- 2 [I2]+ ⇌ [I4]2+
Димеризацию можно объяснить перекрытием наполовину заполненных π * -орбиталей в двух [Я2]+.
[Cl4]+ в [Cl4]+[IrF6]− структурно аналогичен [I4]2+, но разлагается при 195 К с образованием солей [Cl3]+ вместо [Cl2]+ и Cl2.[2]
Попытки подготовить ClF7 и BrF7 фторированием [ClF6]+ и [BrF6]+ с помощью NOF потерпели неудачу, вместо этого произошли следующие реакции:[3]
- [ClF6]+[PtF6]− + NOF → [NO]+[PtF6]− + ClF5 + F2
- [BrF6]+[AsF6]− + 2 NOF → [NO]+[AsF6]− + [НЕТ]+[BrF6]− + F2
Анионы менее реакционноспособны по сравнению с катионами и обычно являются более слабыми окислителями, чем их родительские межгалогенные соединения. Они менее реакционны по отношению к органическим соединениям, а некоторые соли обладают довольно высокой термической стабильностью. Соли, содержащие анионы полигалогенов типа М+[ИКСмYпZп]− (куда м + п + п = 3, 5, 7, 9...) имеют тенденцию к диссоциации на простые моногалогенидные соли между M+ и самый электроотрицательный галоген, так что моногалогенид имеет самую высокую энергию решетки. Интергалоген обычно образуется как другой продукт. Соль [Мне4N]+[ClF4]− разлагается при температуре около 100 ° C, и соли [ClF6]− термически нестабильны и могут взорваться даже при −31 ° C.[4]
Рекомендации
- ^ а б c d Кинг, Р. Брюс (2005). «Хлор, бром, йод и астат: неорганическая химия». Энциклопедия неорганической химии (2-е изд.). Вайли. п. 747. ISBN 9780470862100.
- ^ а б c d е ж грамм час я Housecroft, Catherine E .; Шарп, Алан Г. (2008). «Глава 17: Группа 17 элементов». Неорганическая химия (3-е изд.). Пирсон. п. 547. ISBN 978-0-13-175553-6.
- ^ а б c d е ж грамм Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 835. ISBN 978-0-08-037941-8.
- ^ а б c d е ж грамм час Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999). Продвинутая неорганическая химия (6-е изд.). Вайли. ISBN 978-0471199571.
- ^ а б Виберг, Эгон; Виберг, Нильс; Холлеман, Арнольд Фредерик (2001). Неорганическая химия. Академическая пресса. С. 419–420. ISBN 0-12-352651-5.
- ^ а б c d е Брауэр, Г., изд. (1963). Справочник по препаративной неорганической химии (2-е изд.). Нью-Йорк: Academic Press.