WikiDer > Протокадгерин
| Протокадгерин, цитоплазматический | |||||||||
|---|---|---|---|---|---|---|---|---|---|
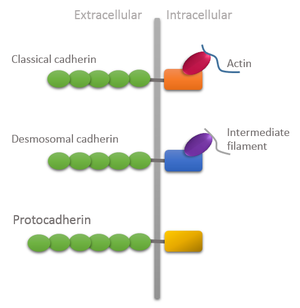 Доменная организация различных типов кадгеринов, демонстрирующая уникальные особенности протокадгеринов: внеклеточный домен длиннее, а внутриклеточный домен не прикреплен к цитоскелету. | |||||||||
| Идентификаторы | |||||||||
| Символ | PDCH | ||||||||
| Pfam | PF08374 | ||||||||
| ИнтерПро | IPR013585 | ||||||||
| Мембранома | 114 | ||||||||
| |||||||||
Протокадгерины (ПК) являются крупнейшей подгруппой млекопитающих кадгерин суперсемейство гомофильных белков клеточной адгезии.[1] Они были обнаружены группой Синтаро Судзуки, когда они использовали ПЦР для поиска новых членов семейства кадгеринов. Фрагменты ПЦР, соответствующие протокадгеринам, были обнаружены у позвоночных и беспозвоночных.[2] Такое преобладание среди широкого круга видов предполагает, что фрагменты были частью древнего кадгерин и поэтому были названы «протокадгеринами» как «первые кадгерины». Из примерно 70 генов Pcdh, идентифицированных в геномах млекопитающих, более 50 расположены в тесно связанных кластерах генов на одной хромосоме.[3] До недавнего времени считалось, что подобная организация может быть найдена только у позвоночных,[3] но Осьминог бимакулоидный имеет 168 генов, из которых почти три четверти находятся в тандемных кластерах, причем два самых больших кластера компрометируют 31 и 17 генов соответственно.[4]
Классификация
У млекопитающих были определены два типа генов Pcdh: некластеризованные Pcdh, которые разбросаны по всему геному; и сгруппированные Pcdhs, организованные в три кластера генов, обозначенных α, β, γ, которые в геноме мыши включают 14, 22 и 22, соответственно, большие вариабельные экзоны, расположенные в тандеме. Каждый экзон транскрибируется с промотора-хозяина и кодирует: весь внеклеточный домен, трансмембранный домен и короткий и вариабельный внутриклеточный домен соответствующего белка Pcdh, который отличается от внутриклеточного домена кадгерина из-за отсутствия прикрепления к цитоскелет через катенины.[5]
Более того, эти сгруппированные гены Pcdh преимущественно экспрессируются в развивающейся нервной системе.[2] и поскольку разные подмножества генов Pcdhs по-разному экспрессируются в отдельных нейронах, огромное разнообразие клеточной поверхности может возникать из-за этой комбинаторной экспрессии.[5] Это привело к предположениям и далее к предположению, что Pcdhs могут предоставлять код синаптического адреса для нейронной связи или штрих-код одной клетки для самопознания / самопознания, аналогичный тому, который приписывается DSCAM белки беспозвоночных. Хотя DSCAM позвоночных лишены разнообразия своих собратьев у беспозвоночных, селективная транскрипция отдельных изоформ Pcdh может быть достигнута путем выбора промотора с последующим альтернативным цис-сплайсингом пре-мРНК, таким образом увеличивая количество возможных комбинаций.
Функция
Гомофильные взаимодействия и внутриклеточная передача сигналов
Кластерные белки Pcdhs обнаруживаются повсюду в соме, дендритах и аксонах нейронов и наблюдаются в синапсах и конусах роста.[6][7][8][9][10] Как и классические кадгерины, члены семейства Pcdhs также опосредуют клеточную адгезию в анализах на основе клеток.[11][12][13] и большинство из них участвовали в гомофильных транс-взаимодействиях.[14] Шрайнер и Вайнер [14] показали, что белки Pcdhα и γ могут образовывать мультимерные комплексы. Если бы все три класса Pcdhs могли участвовать в мультимеризации стохастически экспрессируемых изоформ Pcdhs, тогда нейроны могли бы продуцировать большое количество различных единиц гомофильного взаимодействия, значительно увеличивая разнообразие клеточной поверхности больше, чем то, которое обеспечивается только стохастической экспрессией генов.
Что касается цитоплазматического домена, все три класса кластерных белков Pcdhs не похожи, хотя они строго консервативны в эволюции позвоночных, что указывает на консервативную клеточную функцию.[5] Это подтверждается большим количеством других взаимодействующих белков, включая фосфатазы, киназы, молекулы адгезии и синаптические белки.[15] Цитоплазматический домен также обеспечивает внутриклеточную ретенцию, свойство, которое отличает сгруппированные протокадгерины от родственных классических кадгеринов.[16] Кроме того, было показано, что Pcdh протеолитически обрабатываются γ-секретаза сложный,[17][18] который высвобождает растворимые внутриклеточные фрагменты в цитоплазму, которые могут иметь широкий диапазон функций, поскольку действуют локально в цитоплазме и / или даже регулируют экспрессию генов аналогично другим поверхностным белкам клетки, таким как Notch и N-кадгерин. Поскольку эти молекулы участвуют во многих процессах развития, таких как наведение аксонов и ветвление дендритов, мутации в генах Pcdhs и их экспрессия могут играть роль в Вниз, Rett а также Синдром ломкой Х-хромосомы,[19] шизофрения,[20] и нейродегенеративный болезни[21]
Цитоплазматический домен Pcdh-альфа можно разделить на два конкретных типа. Оба они усиливают гомофильные взаимодействия. Они связаны с нейрофилламент M и очаровывать соответственно.[22]
Гены человека
- PCDH1
- PCDH7
- PCDH8
- PCDH9
- PCDH10
- PCDH11X/11лет
- PCDH12
- PCDH15
- PCDH17
- PCDH18
- PCDH19
- PCDH20
- PCDHA1
- PCDHA2
- PCDHA3
- PCDHA4
- PCDHA5
- PCDHA6
- PCDHA7
- PCDHA8
- PCDHA9
- PCDHA10
- PCDHA11
- PCDHA12
- PCDHA13
- PCDHAC1
- PCDHAC2
- PCDHB1
- PCDHB2
- PCDHB3
- PCDHB4
- PCDHB5
- PCDHB6
- PCDHB7
- PCDHB8
- PCDHB9
- PCDHB10
- PCDHB11
- PCDHB12
- PCDHB13
- PCDHB14
- PCDHB15
- PCDHB16
- PCDHB17
- PCDHB18
- PCDHGA1
- PCDHGA2
- PCDHGA3
- PCDHGA4
- PCDHGA5
- PCDHGA6
- PCDHGA7
- PCDHGA8
- PCDHGA9
- PCDHGA10
- PCDHGA11
- PCDHGA12
- PCDHGB1
- PCDHGB2
- PCDHGB3
- PCDHGB4
- PCDHGB5
- PCDHGB6
- PCDHGB7
- PCDHGC3
- PCDHGC4
- PCDHGC5
- ТОЛСТЫЙ
- FAT2
- FAT4
Смотрите также
- Кадгерин
- PCDH11X
- Нейронное избегание себя
- Эпилептическая энцефалопатия, раннее младенчество, 9 лет, вызванный мутацией в гене, кодирующем протокадгерин-19
Рекомендации
- ^ Hulpiau P, van Roy F (февраль 2009 г.). «Молекулярная эволюция суперсемейства кадгеринов». Международный журнал биохимии и клеточной биологии. 41 (2): 349–69. Дои:10.1016 / j.biocel.2008.09.027. PMID 18848899.
- ^ а б Сано К., Танихара Х., Хеймарк Р.Л., Обата С., Дэвидсон М., Сент-Джон Т., Такетани С., Сузуки С. (июнь 1993 г.). «Протокадгерины: большое семейство молекул, связанных с кадгерином, в центральной нервной системе». Журнал EMBO. 12 (6): 2249–56. Дои:10.1002 / j.1460-2075.1993.tb05878.x. ЧВК 413453. PMID 8508762.
- ^ а б Чен В.В., Альварес Ф.Дж., Лефевр Дж.Л., Фридман Б., Нвакезе К., Гейман Е., Смит С., Чт, Калифорния, Тапиа Дж. К., Ташич Б., Санес Дж. Р., Маниатис Т. (август 2012 г.). «Функциональное значение диверсификации изоформ в кластере генов протокадгерина гамма». Нейрон. 75 (3): 402–9. Дои:10.1016 / j.neuron.2012.06.039. ЧВК 3426296. PMID 22884324.
- ^ Альбертин, Кэролайн Б .; Симаков Олег; Митрос, Тереза; Ван, З. Ян; Pungor, Judit R .; Эдсингер-Гонсалес, Эрик; Бреннер, Сидней; Ragsdale, Клифтон В .; Рохсар, Даниэль С. (август 2015 г.). «Геном осьминога и эволюция нейронных и морфологических новинок головоногих моллюсков». Природа. 524 (7564): 220–224. Bibcode:2015Натура.524..220А. Дои:10.1038 / природа14668. ISSN 0028-0836. ЧВК 4795812. PMID 26268193.
- ^ а б c Чен В.В., Маниатис Т. (август 2013 г.). «Кластерные протокадгерины». Разработка. 140 (16): 3297–302. Дои:10.1242 / dev.090621. ЧВК 3737714. PMID 23900538.
- ^ Кохмура Н., Сендзаки К., Хамада С., Кай Н., Ясуда Р., Ватанабэ М., Исии Х., Ясуда М., Мишина М., Яги Т. (июнь 1998 г.). «Разнообразие, обнаруженное новым семейством кадгеринов, экспрессируемых в нейронах синаптического комплекса». Нейрон. 20 (6): 1137–51. Дои:10.1016 / s0896-6273 (00) 80495-х. PMID 9655502.
- ^ Ван Х, Вайнер Дж. А., Леви С., Крейг А. М., Брэдли А., Санес Дж. Р. (декабрь 2002 г.). «Гамма-протокадгерины необходимы для выживания интернейронов спинного мозга». Нейрон. 36 (5): 843–54. Дои:10.1016 / s0896-6273 (02) 01090-5. PMID 12467588.
- ^ Калленбах С., Хантане С., Кэрролл П., Гайет О., Алонсо С., Хендерсон С.Э., Дадли К. (июнь 2003 г.). «Изменения в субклеточном распределении белков протокадгерина гамма сопровождают созревание спинномозговых нейронов». Журнал неврологических исследований. 72 (5): 549–56. Дои:10.1002 / jnr.10618. PMID 12749019.
- ^ Филлипс Г.Р., Танака Х., Франк М., Эльсте А., Фидлер Л., Бенсон Д.Л., Колман Д.Р. (июнь 2003 г.). «Гамма-протокадгерины нацелены на подмножества синапсов и внутриклеточных органелл в нейронах». Журнал неврологии. 23 (12): 5096–104. Дои:10.1523 / JNEUROSCI.23-12-05096.2003. PMID 12832533.
- ^ Junghans D, Heidenreich M, Hack I, Taylor V, Frotscher M, Kemler R (февраль 2008 г.). «Постсинаптическая и дифференциальная локализация нейрональных подтипов протокадгерина бета16 в центральной нервной системе млекопитающих». Европейский журнал нейробиологии. 27 (3): 559–71. Дои:10.1111 / j.1460-9568.2008.06052.x. PMID 18279309.
- ^ Обата С., Саго Х., Мори Н., Рошель Дж. М., Селдин М. Ф., Дэвидсон М., Сент-Джон Т., Такетани С., Сузуки СТ (декабрь 1995 г.). «Protocadherin Pcdh2 проявляет свойства, аналогичные, но отличные от свойств классических кадгеринов». Журнал клеточной науки. 108 (Pt 12): 3765–73. PMID 8719883.
- ^ Франк М., Эберт М., Шан В., Филлипс Г.Р., Арндт К., Колман Д.Р., Кемлер Р. (август 2005 г.). «Дифференциальная экспрессия отдельных гамма-протокадгеринов во время развития мозга мышей». Молекулярная и клеточная нейронауки. 29 (4): 603–16. Дои:10.1016 / j.mcn.2005.05.001. PMID 15964765.
- ^ Рейсс К., Марецки Т., Хаас И.Г., Шульте М., Людвиг А., Франк М., Сафтиг П. (август 2006 г.). «Регулируемое ADAM10-зависимое отщепление эктодомена гамма-протокадгерина C3 модулирует клеточную адгезию». Журнал биологической химии. 281 (31): 21735–44. Дои:10.1074 / jbc.M602663200. PMID 16751190.
- ^ а б Шрайнер Д., Вайнер Дж. А. (август 2010 г.). «Комбинаторное гомофильное взаимодействие между мультимерами гамма-протокадгерина значительно расширяет молекулярное разнообразие клеточной адгезии». Труды Национальной академии наук Соединенных Штатов Америки. 107 (33): 14893–8. Дои:10.1073 / pnas.1004526107. ЧВК 2930437. PMID 20679223.
- ^ Шальм С.С., Баллиф Б.А., Бьюкенен С.М., Филлипс Г.Р., Маниатис Т. (август 2010 г.). «Фосфорилирование протокадгериновых белков рецепторной тирозинкиназой Ret». Труды Национальной академии наук Соединенных Штатов Америки. 107 (31): 13894–9. Дои:10.1073 / pnas.1007182107. ЧВК 2922223. PMID 20616001.
- ^ Фернандес-Монреаль М., Канг С., Филлипс Г.Р. (март 2009 г.). «Гомофильное взаимодействие гамма-протокадгерина и внутриклеточный трафик контролируется цитоплазматическим доменом в нейронах». Молекулярная и клеточная нейронауки. 40 (3): 344–53. Дои:10.1016 / j.mcn.2008.12.002. ЧВК 2646808. PMID 19136062.
- ^ Bonn S, Seeburg PH, Schwarz MK (июнь 2007 г.). «Комбинаторная экспрессия альфа- и гамма-протокадгеринов изменяет их пресенилин-зависимый процессинг». Молекулярная и клеточная биология. 27 (11): 4121–32. Дои:10.1128 / MCB.01708-06. ЧВК 1900011. PMID 17403907.
- ^ Бьюкенен С.М., Шальм С.С., Маниатис Т. (октябрь 2010 г.). «Протеолитический процессинг белков протокадгерина требует эндоцитоза». Труды Национальной академии наук Соединенных Штатов Америки. 107 (41): 17774–9. Bibcode:2010PNAS..10717774B. Дои:10.1073 / pnas.1013105107. ЧВК 2955128. PMID 20876099.
- ^ Кауфманн В.Е., Мозер Х.В. (октябрь 2000 г.). «Дендритные аномалии при расстройствах, связанных с умственной отсталостью». Кора головного мозга. 10 (10): 981–91. Дои:10.1093 / cercor / 10.10.981. PMID 11007549.
- ^ Калмады С.В., Венкатасубраманян Г. (март 2009 г.). «Доказательства положительного отбора на ген Protocadherin Y в Homo sapiens: последствия для шизофрении». Исследование шизофрении. 108 (1–3): 299–300. Дои:10.1016 / j.schres.2008.09.015. PMID 18938061.
- ^ Андертон Б. Х., Каллахан Л., Коулман П., Дэвис П., Флад Д., Джича Г. А., Ом Т., Уивер С. (август 1998 г.). «Дендритные изменения при болезни Альцгеймера и факторы, которые могут лежать в основе этих изменений». Прогресс в нейробиологии. 55 (6): 595–609. Дои:10.1016 / s0301-0082 (98) 00022-7. PMID 9670220.
- ^ Триана-Бальцер ГБ, Бланк М (март 2006 г.). «Цитоплазматический домен протокадгерина-альфа усиливает гомофильные взаимодействия и распознает элементы цитоскелета». Журнал нейробиологии. 66 (4): 393–407. Дои:10.1002 / neu.20228. PMID 16408303.
дальнейшее чтение
- Хан М.Х., Линь С., Мэн С., Ван Х (январь 2010 г.). «Протеомический анализ показывает перекрывающиеся функции сгруппированных протокадгеринов». Молекулярная и клеточная протеомика. 9 (1): 71–83. Дои:10.1074 / mcp.M900343-MCP200. ЧВК 2808268. PMID 19843561.
- Сотомайор М., Годе Р., Кори Д.П. (сентябрь 2014 г.). «Разбор беспорядочного суперсемейства: к коннектомике кадгерина». Тенденции в клеточной биологии. 24 (9): 524–36. Дои:10.1016 / j.tcb.2014.03.007. ЧВК 4294768. PMID 24794279.