WikiDer > Реакция Шолля
| Реакция Шолля | |
|---|---|
| Названный в честь | Роланд Шолль |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000377 |
В Реакция Шолля это реакция сочетания между двумя ареновые соединения с помощью Кислота Льюиса и протонная кислота.[1][2] Он назван в честь его первооткрывателя, Роланд Шолль, швейцарский химик.
В 1910 году Шолль сообщил о синтезе хинона. [3] и из перилен из нафталин [4] как с хлорид алюминия. Перилен также был синтезирован из 1,1’-бинафталина в 1913 году.[5] Синтез Бензантрон было сообщено в 1912 году.[6]
Протонная кислота в реакции Шолля часто является примесью кислоты Льюиса, а также образуется в ходе реакции Шолля. Реагенты хлорид железа (III) в дихлорметан, хлорид меди (II), PIFA и трифторид бора эфират в дихлорметане, Хлорид молибдена (V) и тетраацетат свинца с BF3 в ацетонитрил.[7]
Учитывая высокую температуру реакции и потребность в сильнокислой катализаторы то химический выход часто низкий, и метод не пользуется популярностью. Внутримолекулярные реакции лучше, чем межмолекулярные, например, в органический синтез из 9-фенилфлуорен:
Или формирование пирен дибензо- (a.1) -пирен от антрацен 1-фенилбенз (а) антрацен (Выход 66%).[8]
Одно исследование показало, что реакция поддается каскадные реакции формировать более сложные полициклические ароматические углеводороды [9]
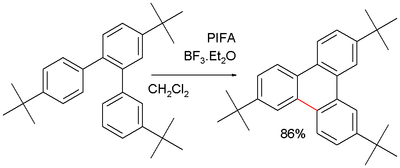
В некоторых приложениях, таких как трифенилен синтез эта реакция выступает в качестве альтернативы для Сузуки реакция. Повторяющаяся проблема олигомеризация продукта, что можно предотвратить, заблокировав трет-бутил заместители:[7]
Механизм реакции
Точный механизм реакции не известно, но вполне может пройти через арений ион. Как и в электрофильное ароматическое замещение, Активация групп Такие как метокси повысить урожайность и селективность:[7]
Могут соревноваться два механизма. На первом этапе катион-радикальный механизм а катион-радикал образуется из одного партнера реакции путем окисления, на второй стадии ион-радикал атакует второго нейтрального партнера в реакции замещения, и образуется новый ион-радикал, одно кольцо которого несет положительный заряд, а другое - положение радикала. На третьем этапе дигидроген отщепляется реоматизация к биарильному соединению. в арениевый ионный механизм один партнер реакции протонируется до арений ион который затем атакует второго партнера реакции. Ион арения также может быть образован при атаке кислоты Льюиса. Механизмы трудно различить, потому что многие кислоты Льюиса могут вести себя как окислители. Реакции, происходящие при комнатной температуре с хорошо известными одноэлектронными окислителями, вероятно, протекают по механизму катион-радикала, а реакции, требующие повышенных температур, вероятно, протекают по механизму ионов арения.[2]
Рекомендации
- ^ М. Б. Смит, Дж. Марч. Мартовская продвинутая органическая химия (Wiley, 2001) (ISBN 0-471-58589-0)
- ^ а б Grzybowski, M., Skonieczny, K., Butenschön, H. и Gryko, D. T. (2013), Сравнение окислительного ароматического связывания и реакции Шолля.. Энгью. Chem. Int. Ред., 52: 9900–9930. Дои:10.1002 / anie.201210238
- ^ Scholl, R. и Mansfeld, J. (1910), мезо-бенздиантрон (гелиантрон), мезо-нафтодиантрон, und ein neuer Weg zum Flavanthren. Бер. Dtsch. Chem. Ges., 43: 1734–1746. Дои:10.1002 / cber.19100430288
- ^ Scholl, R., Seer, Chr. и Weitzenböck, R. (1910), Perylen, ein hoch kondensierter aromatischer Kohlenwasserstoff C20H12. Бер. Dtsch. Chem. Ges., 43: 2202–2209. Дои:10.1002 / cber.191004302175
- ^ Weitzenböck, R. и Seer, C. (1913), Zur Kenntnis des Perylens und seiner Derivate. (2. Mitteilung). Бер. Dtsch. Chem. Гес., 46: 1994–2000. Дои:10.1002 / cber.191304602115
- ^ Scholl, R. и Seer, C. (1912), Abspaltung aromatisch gebundenen Wasserstoffs und Verknüpfung aromatischer Kerne durch Aluminiumchlorid. Justus Liebigs Ann. Chem., 394: 111–177. Дои:10.1002 / jlac.19123940202
- ^ а б c Управление реакцией Шолля Бенджамин Т. Кинг, Джии Кроулик, Чарльз Р. Робертсон, Павел Ремпала, Кэмерон Л. Хилтон, Джастин Д. Коринек и Лиза М. Гортари J. Org. Chem.; 2007; 72 (7), стр. 2279–2288; (Статья) Дои:10.1021 / jo061515x
- ^ Vingiello, F.A .; Yanez, J .; Кэмпбелл, Дж. А. J. Org. Chem. 1971, 36, 2053-2056. (Дои:10.1021 / jo00814a005)
- ^ Наноразмерные молекулярные пропеллеры путем циклодегидрирования дендримеров полифенилена Кристофер Д. Симпсон, Гюнтер Маттерштайг, Кай Мартин, Лилета Гергель, Роланд Э. Бауэр, Ханс Йоахим Радер и Клаус Мюллен Варенье. Chem. Soc.; 2004; 126 (10), стр. 3139–3147; (Статья) Дои:10.1021 / ja036732j