WikiDer > Одномолекулярный эксперимент
А одномолекулярный эксперимент это эксперимент, который исследует свойства отдельных молекулы. Исследования отдельных молекул можно противопоставить измерениям ансамбля или совокупности молекул, где невозможно различить индивидуальное поведение молекул, и только средний характеристики можно измерить. Поскольку многие методы измерения в биологии, химии и физике недостаточно чувствительны, чтобы наблюдать одиночные молекулы, одиночные молекулы флуоресценция методы (которые появились с 1990-х годов для исследования различных процессов на уровне отдельных молекул) вызвали большой ажиотаж, поскольку они предоставили много новых деталей об измеряемых процессах, которые были недоступны в прошлом. Действительно, с 1990-х годов было разработано множество методов исследования отдельных молекул.[2]
Первые эксперименты с одной молекулой были патч зажим эксперименты, проведенные в 1970-х годах, но они ограничивались изучением ионные каналы. Сегодня системы, исследуемые с использованием методов одиночных молекул, включают движение миозина по актиновым филаментам в мышечной ткани и спектроскопические детали отдельных локальных сред в твердых телах. Конформации биологических полимеров были измерены с использованием атомно-силовая микроскопия (АСМ). С помощью силовая спектроскопия, одиночные молекулы (или пары взаимодействующих молекул), обычно полимеры, могут быть механически растянуты, а их упругий отклик записывается в реальном времени.
История
В газовой фазе при сверхнизких давлениях эксперименты с одиночными молекулами проводились десятилетиями, а в конденсированной фазе только с 1989 г. W. E. Moerner и Лотар Кадор.[3] Год спустя Мишель Оррит и Джеки Бернард также смогли продемонстрировать обнаружение поглощения одиночных молекул по их флуоресценции.[4]
Многие методы позволяют наблюдать по одной молекуле за раз, в первую очередь масс-спектрометрии, где регистрируются одиночные ионы. Вдобавок один из первых способов обнаружения одиночных молекул появился в области ионные каналы с развитием патч зажим техника Эрвин Неер и Берт Сакманн (которые позже получили Нобелевскую премию за свой основополагающий вклад). Однако идея измерения проводимости для наблюдения за отдельными молекулами наложила серьезное ограничение на вид систем, которые можно было наблюдать.
Флуоресценция это удобный способ наблюдения за одной молекулой за раз, в основном из-за чувствительности коммерческих оптических детекторов, способных считать одиночные фотоны. Однако спектроскопически наблюдение одной молекулы требует, чтобы молекула находилась в изолированном окружении и чтобы она испускала фотоны при возбуждении, что благодаря технологии обнаружения одиночных фотонов с помощью фотоумножителей (ФЭУ) или лавинных фотодиодов (ЛФД), позволяет регистрировать события эмиссии фотонов с большой чувствительностью и временным разрешением.
В последнее время флуоресценция одиночных молекул является предметом повышенного интереса для биологической визуализации благодаря маркировке биомолекул, таких как белки и нуклеотиды, для изучения ферментативной функции, которую нелегко изучить в массовом масштабе из-за тонких зависящих от времени движений в катализе. и структурная реорганизация. Наиболее изученным белком был класс ферментов миозин / актин, обнаруженных в мышечных тканях. С помощью методов с одной молекулой ступенчатый механизм был обнаружен и охарактеризован во многих из этих белков.
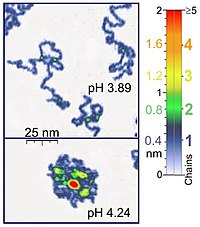
Наноманипуляторы, такие как атомно-силовой микроскоп также подходят для экспериментов с одной молекулой, имеющих биологическое значение, поскольку они работают в той же шкале длины, что и большинство биологических полимеров. Кроме того, атомно-силовая микроскопия (АСМ) подходит для исследования молекул синтетических полимеров. АСМ предоставляет уникальную возможность трехмерной визуализации полимерных цепей. Например, режим постукивания АСМ достаточно щадящий для регистрации адсорбированных молекул полиэлектролита (например, цепей поли (2-винилпиридина) толщиной 0,4 нм) в жидкой среде. Расположение двухцепочечной суперпозиции соответствует в этих экспериментах двойной толщине одиночной цепи (0,8 нм в случае упомянутого примера). При применении правильных параметров сканирования конформация таких молекул остается неизменной в течение нескольких часов, что позволяет проводить эксперименты в жидких средах с различными свойствами.,[1] Кроме того, контролируя силу между наконечником и образцом, можно получить изображения с высоким разрешением.[5][6] Оптический пинцет также использовались для изучения и количественной оценки ДНК-белковых взаимодействий.[5][6]
Об экспериментах
Концепция
Флуоресцентная спектроскопия одиночных молекул использует флуоресценцию молекулы для получения информации о ее окружении, структуре и положении. Этот метод дает возможность получать информацию, которая иначе была бы недоступна из-за усреднения по ансамблю (то есть сигнал, полученный при одновременной записи множества молекул, представляет собой усредненное свойство динамики молекул). Результаты многих экспериментов с отдельными молекулами траектории с двумя состояниями.
Одноканальная запись

Как и в случае флуоресцентной спектроскопии одиночных молекул, метод, известный как одноканальная запись, может использоваться для получения конкретной кинетической информации - в данном случае о функции ионного канала, - которая недоступна, когда выполняется ансамблевой записи, такой как запись всей клетки. выполнила.[7] В частности, ионные каналы чередуются между проводящими и непроводящими классами, которые различаются по конформации. Следовательно, функциональное состояние ионных каналов может быть непосредственно измерено с помощью достаточно чувствительной электроники при условии принятия надлежащих мер предосторожности для минимизации шума. В свою очередь, каждый из этих классов можно разделить на одно или несколько кинетических состояний, имеющих прямое отношение к основной функции ионного канала. Выполнение этих типов исследований отдельных молекул в систематически меняющихся условиях (например, концентрация и структура агониста, проникающий ион и / или блокатор каналов, мутации в аминокислотах ионного канала) может предоставить информацию относительно взаимного преобразования различных кинетических состояний ионного канала. В минимальной модели ионного канала есть два государства: открытые и закрытые. Однако для точного представления данных часто требуются другие состояния, включая несколько закрытых состояний, а также неактивные и / или десенсибилизированные состояния, которые являются непроводящими состояниями, которые могут возникать даже при наличии стимула.[7]
Маркировка биомолекул
не замужем флуорофоры могут быть химически присоединены к биомолекулам, таким как белки или ДНК, а динамику отдельных молекул можно отслеживать, отслеживая флуоресцентный зонд. Пространственные движения внутри Предел Рэлея можно отслеживать вместе с изменениями интенсивности излучения и / или радиационного времени жизни, которые часто указывают на изменения в местной окружающей среде. Например, мечение одиночных молекул дало огромное количество информации о том, как кинезин моторные белки движутся микротрубочка тяжи в мышечных клетках.
Резонансный перенос энергии флуоресценции одиночных молекул (FRET)
основная статья smFRET.
В одной молекуле флуоресцентный резонансный перенос энергии, молекула помечена (как минимум) в двух местах. Луч лазера фокусируется на молекуле, возбуждающей первый зонд. Когда этот зонд расслабляется и излучает фотон, у него есть шанс возбудить другой зонд. Эффективность поглощения фотона, испускаемого первым датчиком, во втором датчике зависит от расстояния между этими датчиками. Поскольку расстояние меняется со временем, этот эксперимент исследует внутреннюю динамику молекулы.
Одномолекулярные эксперименты против ансамблевых экспериментов
При рассмотрении данных, относящихся к отдельным молекулам, обычно можно построить пропагаторы и функции плотности вероятности времени скачка первого порядка, второго порядка и т. Д., Тогда как из массовых экспериментов обычно получают затухание корреляционной функции.[8] Из информации, содержащейся в этих уникальных функциях (полученных от отдельных молекул), можно извлечь относительно ясную картину поведения системы; например его кинетическая схема,[9] или его потенциал деятельности, или его форма уменьшенных размеров.[10][11] В частности, можно построить (многие свойства) путь реакции фермента при мониторинге активности отдельного фермента.[12] Кроме того, некоторые авторы описали важные аспекты, касающиеся анализа данных по отдельным молекулам, такие как методы подбора и тесты для гомогенных популяций.[7] С другой стороны, есть несколько проблем, связанных с анализом данных по отдельным молекулам, включая создание среды с низким уровнем шума и изолированные наконечники пипеток, фильтрацию некоторых оставшихся нежелательных компонентов (шум), обнаруженных в записях, и продолжительность времени, необходимого для сбора данных. анализ (предварительная обработка, однозначное обнаружение событий, построение данных, подгонка кинетических схем и т. д.).
Влияние
Одномолекулярные методы повлияли на оптику, электронику, биологию и химию. В биологических науках изучение белков и других сложных биологических механизмов ограничивалось ансамблевыми экспериментами, что делало почти невозможным прямое наблюдение их кинетики. Например, только после того, как для изучения пар кинезин-миозин в мышечной ткани была использована флуоресцентная микроскопия одиночных молекул, стало возможным прямое наблюдение за механизмами ходьбы. Эти эксперименты, однако, по большей части ограничивались исследованиями in vitro, поскольку полезные методы визуализации живых клеток еще не были полностью реализованы. Перспективы визуализации одиночных молекул in vivo,[13] тем не менее, это дает огромный потенциал для непосредственного наблюдения биомолекул в природных процессах. Эти методы часто используются для исследований с участием белков с низким содержанием копий, многие из которых все еще открываются. Эти методы также были расширены для изучения областей химии, включая отображение неоднородных поверхностей.[14]
Смотрите также
- Одномолекулярный магнит
- Силовая спектроскопия
- Магнитный пинцет
- Оптический пинцет
- Одночастичное слежение
- Рамановская спектроскопия
- Сканирующая зондовая микроскопия
- Электронная микроскопия
- Привязанное движение частицы (TPM)
- Микроскопия сверхвысокого разрешения
- Зажим напряжения
- Настраиваемый резистивный датчик импульсов
- Секвенирование отдельной молекулы в реальном времени
использованная литература
- ^ а б Ю. Ройтер, С. Минько, АСМ эксперименты с одиночными молекулами на границе твердое тело-жидкость: конформация адсорбированных гибких полиэлектролитных цепей in situ, Журнал Американского химического общества, вып. 127, вып. 45, стр. 15688–15689 (2005).
- ^ Juette, MF; Терри, DS; Вассерман, MR; Чжоу, Z; Альтман, РБ; Чжэн, Q; Бланшар, Южная Каролина (июнь 2014 г.). «Светлое будущее флюоресцентной визуализации одиночных молекул». Curr Opin Chem Biol. 20: 103–11. Дои:10.1016 / j.cbpa.2014.05.010. ЧВК 4123530. PMID 24956235.
- ^ В. Э. Моернер и Л. Кадор, Оптическое обнаружение и спектроскопия одиночных молекул в твердом теле, Phys. Rev. Lett. 62, 2535 - 2538 (1989)
- ^ М. Оррит и Дж. Бернар, Одиночные молекулы пентацена, детектируемые по возбуждению флуоресценции в п-терфенил кристалл, Phys. Rev. Lett. 65, 2716–2719 (1990).
- ^ а б Д. Муругесапиллай и другие, Соединение ДНК и образование петель с помощью HMO1 обеспечивает механизм стабилизации свободного от нуклеосом хроматина, Nucleic Acids Res (2014) 42 (14): 8996-9004.
- ^ а б Murugesapillai, D .; и другие. (2016). «Одномолекулярные исследования белков, изгибающих архитектурную ДНК группы B с высокой подвижностью». Biophys Rev. 9 (1): 17–40. Дои:10.1007 / s12551-016-0236-4. ЧВК 5331113. PMID 28303166.
- ^ а б c Б. Сакманн и Э. Неер, Одноканальная запись, ISBN 9780306414190 (1995).
- ^ О. Фломенбом, Дж. Клафтер и А. Сабо, Что можно узнать из траекторий одной молекулы с двумя состояниями? В архиве 14 января 2012 г. Wayback Machine, Биофиз. J. 88, 3780–3783 (2005); arXiv:q-bio / 0502006
- ^ Шринивасан, Бхарат (08.10.2020). «Явное лечение не Михаэлиса-Ментена и атипичной кинетики при раннем открытии лекарств». dx.doi.org. Получено 2020-11-09.
- ^ О. Фломенбом и Р. Дж. Силби, Использование информационного содержания в траекториях с двумя состояниями В архиве 14 января 2012 г. Wayback Machine, Proc. Natl. Акад. Sci. США 103, 10907–10910 (2006).
- ^ О. Фломенбом, Р. Дж. Силбей, Набор инструментов для анализа конечных траекторий с двумя состояниями. Phys. Ред. E 78, 066105 (2008).; arXiv: 0802.1520.
- ^ О. Фломенбом, К. Велония, Д. Лоос и др., Растянутый экспоненциальный спад и корреляции каталитической активности флуктуирующих одиночных молекул липазы В архиве 14 января 2012 г. Wayback Machine, Proc. Natl. Акад. Sci. США 102, 2368–2372 (2005).
- ^ Чжан, Хун; Станчаускас, Рамунас; Стиглохер, Кристиан; Дизон, Кевин К .; Жоспен, Мэлль; Бессеро, Жан-Луи; Пино, Фабьен (2014). «Визуализация одной молекулы in vivo выявляет измененную динамику кальциевых каналов у мутантных по дистрофину C. elegans». Nature Communications. 5: ncomms5974. Bibcode:2014 НатКо ... 5.4974Z. Дои:10.1038 / ncomms5974. ЧВК 4199201. PMID 25232639.
- ^ Walder, R .; Nelson, N .; Шварц, Д. К. (2011). «Картирование поверхности сверхвысокого разрешения с использованием траекторий молекулярных зондов». Nature Communications. 2: 515. Bibcode:2011 НатКо ... 2..515 Вт. Дои:10.1038 / ncomms1530. PMID 22044994.