WikiDer > Стереоспецифичность
В химия, стереоспецифичность является собственностью реакция механизм, приводящий к разным стереоизомерный продукты реакции из разных стереоизомерный реагенты, или который действует только на один (или подмножество) стереоизомеров.[1][2][3]
В отличие, стереоселективность[1][2] является свойством смеси реагентов, в которой нестереоспецифический механизм допускает образование множества продуктов, но где один (или подмножество) продуктов поддерживается такими факторами, как стерический доступ, которые не зависят от механизма.
Стереоспецифический механизм указывает стереохимический результат данного реагента, тогда как стереоселективная реакция выбирает продукты из тех, которые доступны по тому же неспецифическому механизму, действующему на данный реагент. Учитывая единственный стереоизомерно чистый исходный материал, стереоспецифический механизм даст 100% определенного стереоизомера (или отсутствие реакции), хотя потеря стереохимической целостности может легко происходить через конкурирующие механизмы с различными стереохимическими результатами. Стереоселективный процесс обычно дает несколько продуктов, даже если только один механизм работает с изомерно чистым исходным материалом.
Период, термин стереоспецифическая реакция неоднозначно, так как термин реакция сам по себе может означать преобразование с одним механизмом (например, Реакция Дильса – Альдера), которые могут быть стереоспецифичными, или результатом смеси реагентов, которая может действовать через несколько конкурирующих механизмов, специфических и неспецифических. В последнем смысле термин стереоспецифическая реакция обычно неправильно используется для обозначения высокостереоселективная реакция.
Хиральный синтез построен на сочетании стереоспецифических преобразований (для взаимного преобразования существующих стереоцентров) и стереоселективных (для создания новых стереоцентров), где также оптическая активность химического соединения сохраняется.
Качество стереоспецифичность сосредоточен на реагентах и их стереохимии; это касается и продуктов, но только потому, что они свидетельствуют о различии в поведении реагентов. Из стереоизомерных реагентов каждый ведет себя по-своему. специфический путь. Стереоспецифичность по отношению к энантиомеры называется энантиоспецифичностью.
Примеры
Нуклеофильное замещение в зр3 центры могут исходить из стереоспецифических SN2 механизм, вызывающий только инверсию, или неспецифическим SN1 механизм, результат которого может показывать умеренную селективность к инверсии, в зависимости от реагентов и условий реакции, к которым механизм не относится. Выбор механизма, принятого для конкретной комбинации реагентов, зависит от других факторов (стерический доступ к реакционному центру в субстрате, нуклеофил, растворитель, температура).
| Стереоспецифичность реакций замещения | |
|---|---|
 | 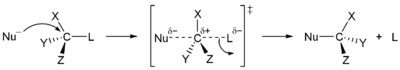 |
| SN1 механизм нестереоспецифический | SN2 механизм стереоспецифический |
Например, третичные центры реагируют почти исключительно на SN1, тогда как первичные центры (кроме неопентильных) реагируют почти исключительно за счет SN2 механизм. Когда нуклеофильное замещение приводит к неполной инверсии, это происходит из-за конкуренции между двумя механизмами, как это часто происходит на вторичных центрах, или из-за двойной инверсии (например, когда йодид является нуклеофилом).
Добавление синглетных карбенов к алкенам является стереоспецифичным в том смысле, что геометрия алкена сохраняется в продукте. Например, дибромокарбен и СНГ-2-бутен выход СНГ-2,3-диметил-1,1-дибромциклопропан, тогда как транс изомер дает исключительно транс циклопропан.[4]
Это добавление остается стереоспецифическим, даже если исходный алкен не является изомерно чистым, поскольку стереохимия продуктов будет соответствовать реагентам.
В отвратительный реакция замыкания кольца сопряженных триенов является стереоспецифическим в том смысле, что изомерные реагенты будут давать изомерные продукты. Например, транс, цис, транс-2,4,6-октатриен дает СНГ-диметилциклогексадиен, тогда как транс, цис, цис изомер реагента дает транс продукт и транс, транс, транс изомер реагента таким образом не реагирует.
Смотрите также
Рекомендации
- ^ а б «Контроль перекрытия карбанионоидных реакций. I. Стереоселективность при щелочном эпоксидировании», Zimmerman, H.E .; Певица, Л .; Thyagarajan, B. S. J. Am. Chem. Soc., 1959, 81, 108-116.
- ^ а б Элиэль, Э., "Стереохимия углеродного соединения", McGraw-Hill, 1962, стр. 434-436.
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Скелл, П.С. И Гарнер, А. (1956). «Стереохимия реакций карбен-олефин. Реакции дибромокарбена с цис- и транс-2-бутенами». Журнал Американского химического общества. 78 (14): 3409–3411. Дои:10.1021 / ja01595a040.

