WikiDer > Тетрафторид титана
 | |
| Имена | |
|---|---|
| Название ИЮПАК Фторид титана (IV) | |
| Другие имена Тетрафторид титана | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.106 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| TiF4 | |
| Молярная масса | 123,861 г / моль |
| Внешность | белый порошок гигроскопичный |
| Плотность | 2,798 г / см3 |
| Температура плавления | 377 ° С (711 ° F, 650 К) |
| Точка кипения | возвышенный |
| Опасности | |
Классификация ЕС (DSD) (устарело) | нет в списке |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другой анионы | Бромид титана (IV) Хлорид титана (IV) Иодид титана (IV) |
Родственные соединения | Фторид титана (III) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
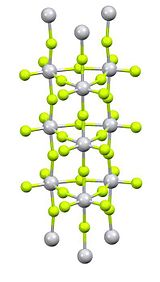
Фторид титана (IV) это неорганическое соединение с формула TiF4. Это белый гигроскопичный твердый. В отличие от других тетрагалогенидов титана, он имеет полимерную структуру.[1] Как и другие тетрагалогениды, TiF4 сильный Кислота Льюиса.
Приготовление, структура, реакции
Традиционный метод предполагает обработку тетрахлоридом титана с избытком фтороводород:
- TiCl4 + 4 HF → TiF4 + 4 HCl
Очистка осуществляется путем сублимации, которая включает обратимое растрескивание полимерной структуры.[2]Рентгеновская кристаллография показывает, что центры Ti являются октаэдрическими, но соединены в необычную столбчатую структуру.[3]
TiF4 образует аддукты со многими лигандами. Одним из примеров является СНГ-TiF4(MeCN)2, который образуется при обработке ацетонитрил.[4]
Рекомендации
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Справочник по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1. п. 200.
- ^ Bialowons, H .; Мюллер, М .; Мюллер, Б. (1995). «Титантетрафторид - Eine Überraschend einfache Kolumnarstruktur». Zeitschrift für Anorganische und Allgemeine Chemie. 621: 1227–1231. Дои:10.1002 / zaac.19956210720.
- ^ Никифоров, Григорий Б .; Роески, Герберт В .; Колей, Дебасис (2014). «Обзор комплексов фторида титана, их получение, реакционная способность и применение». Обзоры координационной химии. 258-259: 16–57. Дои:10.1016 / j.ccr.2013.09.002.
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |
