WikiDer > Трогоцитоз
Трогоцитоз (Греческий: трого; грызть) - это процесс, посредством которого лимфоциты (B, Т и NK клетки), сопряженный с антигенпрезентирующие клетки извлекать поверхностные молекулы из этих клеток и выражают их на своей собственной поверхности.[1] Молекулярная реорганизация, происходящая на границе между лимфоцитом и антигенпрезентирующей клеткой во время конъюгации, также называется "иммунологический синапс".
Шаги в открытии трогоцитоза
Первое указание на существование этого процесса относится к концу 70-х годов, когда несколько исследовательских групп сообщили о присутствии неожиданных молекул, таких как молекулы главного комплекса гистосовместимости (MHC), на Т-клетках. Представление о том, что фрагменты мембраны, а не изолированные молекулы, могут быть захвачены Т-клетками на антигенпрезентирующих клетках, было предложено путем захвата молекул MHC, слитых с зеленым флуоресцентным белком (GFP) в их внутриклеточной части.[2] Демонстрация того, что фрагменты мембраны участвуют в этом процессе переноса, была обнаружена, когда было обнаружено, что флуоресцентные зонды, включенные в плазматическую мембрану антигенпрезентирующей клетки, а также молекулы, не являющиеся молекулами MHC, захватываются Т-клетками вместе с антигеном.[3][4]
Типы клеток, осуществляющие трогоцитоз
Первоначально трогоцитоз был зарегистрирован в T-, B- и NK-клетках. in vivo и in vitro. На Т-клетках и В-клетках трогоцитоз запускается, когда Т-клеточный рецептор (TCR) на Т-клетках или В-клеточный рецептор (BCR) на В-клетках взаимодействует с антигеном, распознаваемым на антигенпрезентирующих клетках. Как и в лимфоцитах, трогоцитоз возникает при PMN (полиморфноядерный лейкоциты, также известный как гранулоциты) и связан с эффективным ADCC (Зависимая от антител цитотоксичность, опосредованная клетками).
Было показано, что для того, чтобы инициировать ADCC in vitro, PMN должны прикрепляться к своим клеткам-мишеням и образовывать плотные контакты с антителами. опсонизированный опухолевые клетки. Этот кластеризация ячеек предшествует взаимному мембранному липидному обмену между эффектор и целевая ячейка во время ADCC и не происходит в отсутствие опсонизирующих антител.[5] Трогоцитоз также встречается в моноцитах и дендритных клетках. Вне иммунной системы подобный перенос мембранных фрагментов был зарегистрирован между спермой и ооцитами, процесс, который, как считается, способствует слиянию гамет.[6]
В последнее время этот термин приписывают макрофагам, таким как микроглия, резидентная в ЦНС, которые способны частично фагоцитировать части синапсов в процессе ремоделирования.[7]
Механизмы трогоцитоза
Трогоцитоз предполагает передачу плазматическая мембрана фрагменты от представляющей клетки к лимфоциту. Трогоцитоз специфически запускается антигеном рецепторная сигнализация на Т- и В-клетки, ингибирующим киллером и киллером активирующим рецептором на NK-клетках и различными рецепторами на других клетках, включая рецептор Fc и рецептор скавенджера класса А. Вероятно, что трогоцитоз не включает захват везикул, таких как экзосомы, секретируемые антигенпрезентирующими клетками. Скорее, молекулы могут перемещаться от антигенпрезентирующих клеток к лимфоцитам, транспортируемым мембранными нанотрубками, или фрагменты мембран могут быть разорваны Т-клетками из-за физических сил, необходимых для образования и деформации иммунологических синапсов. В зависимости от двух типов клеток, участвующих в конъюгатах, трогоцитоз может быть однонаправленным или двунаправленным. Белков, переносимых посредством трогоцитоза, много, и в основном они включают белки, встроенные в плазматическую мембрану или тесно связанные с ней (белки, охватывающие липидный бислой или вставленные во внеклеточные или внутриклеточные листочки). Например, недавно было показано, что лимфоциты человека приобретают внутренняя мембрана белок H-Ras, а G-белок жизненно важно для общего функции лимфоцитов и видный участник человеческого рак, из ячеек, которые они сканируют.[8] Перенос был зависимым от клеточного контакта и происходил в контексте образования клеточного конъюгата. Более того, приобретение онкогенных H-RasG12V NK- и T-лимфоцитами выполняли важные биологические функции в усваивающих лимфоцитах: перенесенный H-RasG12V индуцировал ERK фосфорилирование, повысился интерферон-γ и фактор некроза опухоли-α секреция, усиление пролиферации лимфоцитов и усиление NK-опосредованного уничтожения клеток-мишеней.
Физиологические последствия
Трогоцитоз может иметь физиологические последствия двумя способами: либо потому, что клетки-реципиенты приобретают и используют молекулы, которые они обычно не экспрессируют, либо потому, что «донорские» клетки лишены молекул, что может изменить их взаимодействие с клеточными партнерами. Приобретенные молекулы, такие как регуляторные молекулы с внеклеточный или же внутриклеточный компоненты могут изменять активность лимфоцитов и управлять несколькими функциями лимфоцитов, такими как миграция к адекватному поврежденному ткани. Такие полученные фрагменты плазматической мембраны также могут способствовать способности к размножаться, потому что липиды очень энергичный требующие компоненты для установки. Трогоцитоз мог появиться впервые в очень примитивные организмы Чтобы питаться другими клетками. Большинство биологических функций, идентифицированных для трогоцитоза, было зарегистрировано для лимфоцитов и дендритных клеток. Основные выводы в этом направлении:
- цитотоксические Т-лимфоциты, имеющие захваченные комплексы антигенный пептид-MHC, могут быть убиты CTL, специфичными для этого антигена (процесс, называемый братоубийство)
- хелперные Т-лимфоциты, имеющие захваченные комплексы антигенный пептид-МНС, вовлечены в отрицательную регуляторную петлю обратной связи, что приводит к их инактивации[9]
- дендритные клетки, лишенные Т-клетками комплексов антигенный пептид-MHC посредством трогоцитоза, способствуют созреванию аффинности Т-клеточного ответа путем отбора высокоаффинных Т-клеток[10]
- понижающая модуляция костимулирующих молекул на дендритных клетках, опосредованная Т-клетками, приводит к регуляции ответа Т-клеток[11]
- перенос антигена между дендритными клетками путем трогоцитоза способствует реактивации Т-клеток памяти за счет наивных Т-клеток[12]
- перенос антигена между дендритными клетками путем трогоцитоза способствует отторжению аллотрансплантата[13]
Влияние трогоцитоза на серотерапевтические подходы
Терапевтические антитела можно использовать для лечения рака. Примером является ритуксимаб, терапевтическое антитело, используемое для лечения хронический лимфолейкоз, распознает молекулу CD20, экспрессируемую опухолевыми клетками, и приводит к их устранению.[14] Однако использование слишком большого количества антитела частично связано с удалением комплексов ритуксимаб-CD20 с поверхности опухолевых клеток моноцитами посредством трогоцитоза. Этот эффект приводит к побегу опухолевых клеток антигенная модуляция. Снижение дозы терапевтических антител для ограничения степени трогоцитоза может улучшить их терапевтическую эффективность.[15]
Эпратузумаб (Mab CD22) действует, используя трогоцитоз, для переноса CD22 и других белков B-клеток от B-клеток к эффекторным клеткам.[16]
Анализы на основе трогоцитоза как инструменты иммуномониторинга
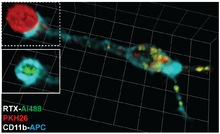
Анализы TRAP (протокол анализа TRogocytosis) позволяют идентифицировать, характеризовать и очищать Т- и В-клетки, распознающие свой специфический антиген, на основе их способности извлекать молекулы (в данном случае флуоресцентные зонды) из плазматической мембраны антигенпрезентирующих клеток.[17] Для этих анализов требуется такое оборудование, как проточный цитометр, но в остальном они очень дешевы, просты в исполнении, быстрые (можно провести в течение 3 часов) и применимы к любой популяции Т- или В-клеток. Анализы TRAP успешно использовались для обнаружения Т-клеточного ответа против вирусных инфекций,[18] рак,[19] аутоиммунные заболевания[20] и вакцины.[21]
Смотрите также
Процесс трогоцитоза считается отличным от несвязанных процессов, известных как Фагоцитоз и Парацитофагия.
Рекомендации
- ^ Жоли, Этьен; Худризье, Дени (сентябрь 2003 г.). «Что такое трогоцитоз и каково его предназначение?». Иммунология природы. 4 (9): 815. Дои:10.1038 / ni0903-815. PMID 12942076.
- ^ Huang, J .; Ян, Y; Sepulveda, H; Ши, Вт; Хван, я; Петерсон, Пенсильвания; Джексон, MR; Спрент, Дж; Цай, З. (29 октября 1999 г.). «TCR-опосредованная интернализация комплексов пептид-MHC, приобретенных Т-клетками». Наука. 286 (5441): 952–954. Дои:10.1126 / science.286.5441.952. PMID 10542149.
- ^ Patel, Dhaval M .; Арнольд, Паула Й .; Белый, Грегори А .; Нарделла, Джон П .; Манни, Марк Д. (15 ноября 1999 г.). «Комплексы MHC / пептид класса II высвобождаются из APC и приобретаются Т-клеточными респондерами во время распознавания специфического антигена». Журнал иммунологии. 163 (10): 5201–5210. PMID 10553040.
- ^ Худрисье, Дени; Рионд, Джоэлль; Мазаргуил, Оноре; Гэрин, Жан Эдуард; Жоли, Этьен (15 марта 2001 г.). «Передний край: CTL быстро захватывают фрагменты мембраны из клеток-мишеней зависимым от сигналов TCR способом». Журнал иммунологии. 166 (6): 3645–3649. Дои:10.4049 / jimmunol.166.6.3645. PMID 11238601.
- ^ Хорнер, Хайке; Фрэнк, Карола; Dechant, Клаудия; Репп, Роланд; Гленни, Мартин; Херрманн, Мартин; Штокмейер, Бернхард (1 июля 2007 г.). «Образование конъюгата интимных клеток и обмен мембранных липидов предшествуют индукции апоптоза в клетках-мишенях во время антителозависимой, опосредованной гранулоцитами цитотоксичности». Журнал иммунологии. 179 (1): 337–345. Дои:10.4049 / jimmunol.179.1.337. PMID 17579054.
- ^ Барро-Ланж, Вирджиния; Науд-Барриан, Натали; Бомсель, Морган; Вольф, Жан-Филипп; Зийят, Ахмед (15 июня 2007 г.). «Перенос фрагментов мембран ооцита на оплодотворяющие сперматозоиды». Журнал FASEB. 21 (13): 3446–3449. Дои:10.1096 / fj.06-8035hyp. PMID 17575263.
- ^ Вайнхард, Летиция; ди Бартоломей, Джулия; Боласко, Джулия; Мачадо, Педро; Schieber, Nicole L .; Нениските, Урте; Эксига, Мелани; Вадисиуте, Огюст; Раджоли, Анджело; Шертель, Андреас; Шваб, Янник; Гросс, Корнелиус Т. (26 марта 2018 г.). «Микроглия ремоделирует синапсы путем пресинаптического трогоцитоза и индукции филоподий головы позвоночника». Nature Communications. 9 (1): 1228. Bibcode:2018NatCo ... 9.1228 Вт. Дои:10.1038 / s41467-018-03566-5. ЧВК 5964317. PMID 29581545.
- ^ Рехави, Одед; Гольдштейн, Итамар; Верницкий, Хелли; Ротблат, Барак; Клоог, Йоэль; Канеллопулос, Жан (21 ноября 2007 г.). «Межклеточная передача онкогенных H-Ras в иммунологическом синапсе». PLOS One. 2 (11): e1204. Bibcode:2007PLoSO ... 2.1204R. Дои:10.1371 / journal.pone.0001204. ЧВК 2065899. PMID 18030338.
- ^ Хелфт, Джули; Жаке, Александра; Джонкер, Натали Т .; Гранжан, Изабель; Дороти, Гийом; Киссенпфенниг, Адриан; Малиссен, Бернар; Матцингер, Полли; Ланц, Оливье (15 августа 2008 г.). «Антиген-специфические Т-Т взаимодействия регулируют рост Т-лимфоцитов CD4». Кровь. 112 (4): 1249–1258. Дои:10.1182 / кровь-2007-09-114389. ЧВК 2515122. PMID 18539897.
- ^ Kedl, Ross M .; Шефер, Брайан Ч .; Капплер, Джон В .; Маррак, Филиппа (3 декабря 2001 г.). «Т-клетки подавляют комплексы пептид-MHC на APC in vivo». Иммунология природы. 3 (1): 27–32. Дои:10.1038 / ni742. PMID 11731800.
- ^ Куреши, Омар С .; Чжэн, Юн; Накамура, Киоко; Аттридж, Кесли; Манзотти, Клэр; Шмидт, Эмили М .; Бейкер, Дженнифер; Джеффри, Луиза Э .; Каур, Сатдип; Бриггс, Зоя; Hou, Tie Z .; Футтер, Клэр Э .; Андерсон, Грэм; Уокер, Люси С.К .; Сансом, Дэвид М. (29 апреля 2011 г.). «Трансэндоцитоз CD80 и CD86: молекулярная основа внешней функции клетки CTLA-4». Наука. 332 (6029): 600–603. Bibcode:2011Sci ... 332..600Q. Дои:10.1126 / science.1202947. ЧВК 3198051. PMID 21474713.
- ^ Оаким, Линда М .; Беван, Майкл Дж. (31 марта 2011 г.). «Перекрестно одетые дендритные клетки управляют активацией CD8 + Т-клеток памяти после вирусной инфекции». Природа. 471 (7340): 629–632. Bibcode:2011Натура 471..629Вт. Дои:10.1038 / природа09863. ЧВК 3423191. PMID 21455179.
- ^ Эррера, Оскель Баррозу; Гольшаян, Дела; Тибботт, Ребекка; Очоа, Франсиско Сальсидо; Джеймс, Марта Дж .; Marelli-Berg, Federica M .; Лехлер, Роберт И. (15 октября 2004 г.). «Новый путь презентации аллоантигена дендритными клетками». Журнал иммунологии. 173 (8): 4828–4837. Дои:10.4049 / jimmunol.173.8.4828. PMID 15470023.
- ^ Беум, Пол V .; Кеннеди, Адам Д .; Уильямс, Майкл Э .; Линдорфер, Маргарет А .; Тейлор, Рональд П. (15 февраля 2006 г.). «Реакция на бритье: комплексы ритуксимаб / CD20 удаляются из клеток лимфомы из клеток мантии и клеток хронического лимфоцитарного лейкоза моноцитами THP-1». Журнал иммунологии. 176 (4): 2600–2609. Дои:10.4049 / jimmunol.176.4.2600. PMID 16456022.
- ^ Уильямс, Майкл Э .; Денсмор, Джон Дж .; Pawluczkowycz, Andrew W .; Беум, Пол V .; Кеннеди, Адам Д .; Линдорфер, Маргарет А .; Hamil, Susan H .; Eggleton, Jane C .; Тейлор, Рональд П. (15 ноября 2006 г.). «Низкая доза ритуксимаба трижды в неделю снижает потерю CD20 при бритье и способствует усиленному лечению хронического лимфолейкоза». Журнал иммунологии. 177 (10): 7435–7443. Дои:10.4049 / jimmunol.177.10.7435. PMID 17082663.
- ^ «Эпратузумаб». Иммуномедика.
- ^ Добёф, Сандрин; Пуо, Анн-Лор; Жоли, Этьен; Худрисье, Дени (29 декабря 2006 г.). «Простой метод, основанный на трогоцитозе, для обнаружения, количественной оценки, характеристики и очистки антигенспецифических живых лимфоцитов с помощью проточной цитометрии путем захвата ими мембранных фрагментов антигенпрезентирующих клеток». Протоколы природы. 1 (6): 2536–2542. Дои:10.1038 / nprot.2006.400. PMID 17406507.
- ^ Бидлинг, Кэрол; Слифка, Марк К. (1 октября 2006 г.). «Количественная оценка жизнеспособных вирус-специфических Т-клеток без априорного знания тонкой специфичности эпитопа». Природа Медицина. 12 (10): 1208–1212. Дои:10,1038 / нм 1413. PMID 17013384.
- ^ Махленкин, Артур; Узана, Ронни; Франкенбург, Шошана; Айзенберг, Галит; Айзенбах, Леа; Питковски, Джейкоб; Городецкий, Рафаэль; Ниссан, Авирам; Перец, Тамар; Лотем, Михал (15 марта 2008 г.). «Захват мембран опухолевых клеток с помощью трогоцитоза облегчает обнаружение и выделение опухолеспецифических функциональных CTL». Исследования рака. 68 (6): 2006–2013. Дои:10.1158 / 0008-5472.CAN-07-3119. PMID 18339883.
- ^ Bahbouhi, Bouchaib; Петре, Сеголен; Бертело, Лорелин; Гарсия, Александра; Элонг Нгоно, Энни; Дегаук, Николас; Мишель, Лор; Вертлевски, Сандрин; Лефрер, Фабьен; Мейниэль, Клэр; Делькруа, Екатерина; Бруар, Софи; Лаплауд, Давид-Аксель; Soulillou, Жан-Поль (июнь 2010 г.). «Распознавание Т-клетками аутоантигенпредставляющих клеток с помощью анализа переноса белка показывает высокую частоту появления антимиелиновых Т-клеток при рассеянном склерозе». Мозг. 133 (6): 1622–1636. Дои:10.1093 / мозг / awq074. PMID 20435630.
- ^ Добёф, Сандрин; Превиль, Ксавье; Момот, Мари; Миссери, Иоланда; Жоли, Этьен; Худрисье, Дени (сентябрь 2009 г.). «Улучшение схем введения вакцин на основе CyaA с использованием анализов TRAP для обнаружения антиген-специфических CD8 + Т-клеток непосредственно ex vivo». Вакцина. 27 (41): 5565–5573. Дои:10.1016 / j.vaccine.2009.07.035. PMID 19647811.