WikiDer > Реакция декарбонилирования Цуджи – Уилкинсона - Википедия
| Декарбонилирование Цуджи-Уилкинсона | |
|---|---|
| Названный в честь | Дзиро Цудзи Джеффри Уилкинсон |
| Тип реакции | Декарбонилирование |
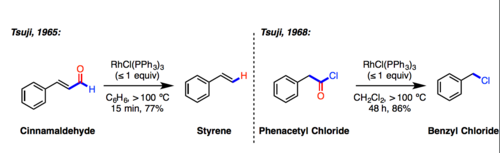
В Реакция декарбонилирования Цуджи-Уилкинсона это метод для декарбонилирование из альдегиды и немного ацилхлориды. В название реакции признает Дзиро Цудзи, команда которого впервые сообщила об использовании Катализатор Уилкинсона (RhCl (PPh3)3) для этих реакций:
- RC (O) X + RhCl (PPh3)3 → RX + RhCl (CO) (PPh3)2 + PPh3
Хотя декарбонилирование может осуществляться несколькими способами. переходный металл комплексов катализатор Уилкинсона оказался наиболее эффективным.[1]
Механизм реакции
Строго говоря, эта реакция приводит к образованию карбонильного комплекса родия, а не свободного монооксида углерода.
Предполагается, что каталитический цикл включает: окислительная добавка альдегида (или хлорангидрида) с получением промежуточного соединения 16e-ацил Rh (III) -гидрида, которое подвергается миграционная экструзия CO переходят с образованием 18-электронного карбонильного комплекса d6 Rh (III). Восстановительное удаление дает декарбонилированный продукт. В каталитическом варианте декарбонилирования Цуджи – Уилкинсона RhCl (CO) (PPh3)2 выделяет CO выше 200 ° C, тем самым регенерируя RhCl (PPh3)п. В противном случае механизм реакции останавливается за счет образования этого термодинамически стабильного карбонильного комплекса.[2]
Синтетические приложения
Декарбонилирование Цуджи-Уилкинсона протекает в мягких условиях и сильно стереоспецифический. Помимо алифатических, ароматических и α, β-ненасыщенных альдегидов, ацил нитрилы и 1,2-дикетоны также являются подходящими субстратами. Существует несколько методов декарбонилирования.
Одним из иллюстративных приложений является синтез ядра ядра FR-900482.[3] Обратите внимание, что родиевый реагент не влияет на сложный эфир.
Декарбонилирование Цуджи-Уилкинсона используется на предпоследней стадии синтеза (-) - пресильфиперфолан-8-ола.[4] Они комментируют: «Следует отметить, что на этих заключительных этапах отдельные этапы восстановления и окисления проходили с меньшим выходом при получении 38 (70% против 93%), в то время как Rh (PPh3)3Операция с Cl протекала гладко при проведении в малых масштабах (~ 15 мг). В общей сложности для синтеза потребовалось 13 стадий из коммерческого [исходного материала], и было получено около 15 мг [(-) - пресильфиперфолан-8-ола] со спектральными свойствами и оптическим вращением, соответствующими таковому у природного изолята ».
Попытки осуществить низкотемпературное каталитическое декарбонилирование Цуджи-Уилкинсона
К сожалению, декарбонилирование Цуджи – Уилкинсона является стехиометрическим. Продукт бис (трифенилфосфин) карбонилхлорид родия с трудом превращается обратно в реагент, не содержащий CO. Выше 200 ° C, монооксид углерода RhCl (CO) (PPh3)2 декарбонилат,[2] однако эти высокие температуры часто недопустимы. Идеальное декарбонилирование Цуджи-Уилкинона было бы каталитическим, близким к температуре окружающей среды.
Реакция проводилась в проточных условиях при низких температурах, в которых было разработано декарбонилирование в двухфазном потоке жидкость-газ с использованием N2 как газовоз.[5] Однако температура, необходимая для этой реакции, составляет 200 ° C.
Значительные улучшения декарбонилирования Цуджи-Уилкинсона были достигнуты при использовании катионных комплексов родия с хелатирующими бисфосфинами.[6]
Исторические ссылки
- Цудзи, Дзиро; Оно, Киётака (январь 1965 г.). «Органический синтез с помощью соединений благородных металлов XXI. Декарбонилирование альдегидов с использованием комплекса родия». Буквы Тетраэдра. 6 (44): 3969–3971. Дои:10.1016 / S0040-4039 (01) 89127-9.
- Цудзи, Дзиро; Оно, Киётака; Кадзимото, Цунэске (январь 1965 г.). «Органический синтез с помощью соединений благородных металлов XX. Декарбонилирование ацилхлорида и альдегида, катализируемое палладием, и его связь с восстановлением Розенмунда». Буквы Тетраэдра. 6 (50): 4565–4568. Дои:10.1016 / S0040-4039 (01) 89065-1.
- Синтез, 1969, 157.
- Оно, Киётака; Цудзи, Дзиро (1968). «Органический синтез с помощью соединений благородных металлов. XXXV. Новые реакции декарбонилирования альдегидов и ацилгалогенидов с использованием комплексов родия». Журнал Американского химического общества. 90 (1): 99–107. Дои:10.1021 / ja01003a018.
Рекомендации
- ^ Ласло Курти; Барбара Чако (2005). Стратегические применения названных реакций в органическом синтезе: предыстория и подробный механизм. ISBN 0124297854.
- ^ а б Даути, Д. Х .; Пиньоле, Л. Х. (октябрь 1978 г.). «Каталитическое декарбонилирование альдегидов». Журнал Американского химического общества. 100 (22): 7083–7085. Дои:10.1021 / ja00490a061.
- ^ Ziegler, Frederick E .; Белема, Маконен (февраль 1997 г.). «Хиральные азиридинильные радикалы: приложение к синтезу ядра ядра FR-900482». Журнал органической химии. 62 (4): 1083–1094. Дои:10.1021 / jo961992n.
- ^ Ху, Пэнфэй; Снайдер, Скотт А. (29 марта 2017 г.). «Энантиоспецифический полный синтез сильно деформированного (-) - пресильфиперфолан-8-ола посредством тандемной циклизации, катализируемой палладием». Журнал Американского химического общества. 139 (14): 5007–5010. Дои:10.1021 / jacs.7b01454. PMID 28355073.
- ^ Гутманн, Бернхард; Эльснер, Петтери; Гласнов, Тома; Роберж, Доминик М .; Каппе, К. Оливер (20 октября 2014 г.). «Сдвиг химического равновесия при эффективном декарбонилировании, управляемом кольцевыми режимами потока». Angewandte Chemie International Edition. 53 (43): 11557–11561. Дои:10.1002 / anie.201407219. PMID 25196172.
- ^ Крейс, Майкл; Палмелунд, Андерс; Банч, Леннарт; Мэдсен, Роберт (октябрь 2006 г.). «Общий и удобный метод декарбонилирования альдегидов, катализируемого родием». Расширенный синтез и катализ. 348 (15): 2148–2154. Дои:10.1002 / adsc.200600228.