WikiDer > Белок, индуцирующий сборку актина - Википедия
| Белок, индуцирующий сборку актина | |||||||
|---|---|---|---|---|---|---|---|
 Домен EVH1-пептидный комплекс ActA | |||||||
| Идентификаторы | |||||||
| Символ | ActA | ||||||
| Ген NCBI | 2798121 | ||||||
| UniProt | P33379 | ||||||
| |||||||
В Белок, индуцирующий сборку актина (ActA) это белок закодировано и используется Listeria monocytogenes продвигаться через клетку-хозяин млекопитающего. ActA представляет собой бактериальный поверхностный белок, содержащий область, пронизывающую мембрану.[1] В клетке млекопитающего бактериальный ActA взаимодействует с Комплекс Арп2 / 3 и актин мономеры, чтобы вызвать полимеризацию актина на поверхности бактерий, образуя хвост актиновой кометы. Ген, кодирующий ActA, назван actA или prtB.[2]
Вступление
Как только L. monocytogenes бактерии попадают в организм человека, они проникают внутрь кишечный эпителий клетки и быстро пытаются выйти из вакуоли интернализации.[3][4] В цитозоле они начинают полимеризовать актин на своей поверхности с помощью белка ActA. Было показано, что ActA не только необходим, но и достаточен для индукции подвижности бактерий в отсутствие других бактериальных факторов.[5]
Открытие
ActA был обнаружен путем анализа лецитиназа-отрицательный Tn917-лак Мутанты Listeria из-за фенотипа, который они не могли распространяться от клетки к клетке. Эти мутантные бактерии по-прежнему уходили из фагосом так же эффективно, как бактерии дикого типа, и размножались в инфицированных клетках, но они не были окружены актином, как бактерии дикого типа. Дальнейший анализ показал, что Tn917-лак вставил в actA, второй ген оперона. Третий ген этого оперона, plcB, кодирует L. monocytogenes лецитиназа. Чтобы определить, actA сам, plcB или другие совместно транскрибируемые нижестоящие области участвуют в сборке актина, были получены мутации в соответствующих генах. Все мутанты, кроме actA мутанты были подобны дикому типу в отношении ассоциации с F-актином и клеточно-клеточного распространения. Дополнение с actA восстановлен фенотип дикого типа в actA мутанты.[1]
Функция
ActA - это белок, который имитирует Белок синдрома Вискотта-Олдрича (WASP), фактор, способствующий зародышеобразованию (NPF), присутствующий в клетках-хозяевах. NPF в клетках млекопитающих рекрутируются и связываются с уже существующими актин-родственный белок 2 и 3 комплекс (Комплекс Arp2 / 3) и вызывают активирующие конформационные изменения комплекса Arp2 / 3.[6] Из-за этого конформационного изменения NPFs инициируют полимеризацию нового актинового филамента под углом 70 °, что приводит к характерным Y-разветвленным структурам актина на переднем крае подвижных клеток. ActA локализуется на старом полюсе бактерии и охватывает как мембрану бактериальной клетки, так и клеточную стенку, латеральная диффузия подавляется; таким образом, ActA поляризованно и закрепляется на поверхности бактерий. Следовательно, полимеризация актина начинается только в этой области на поверхности бактерии.[7] Экспрессия ActA индуцируется только после проникновения в хозяйскую клетку млекопитающего.[8]
Сборка актиновых филаментов создает силу, которая толкает бактерии в цитоплазме млекопитающего вперед. Непрерывной полимеризации актина достаточно для подвижности цитоплазмы и даже для инфицирования соседних клеток.[9]
Исследование
Новые данные указывают на то, что ActA играет роль также в разрушении вакуолей. Мутант с делецией ActA был дефектен в отношении проницаемости вакуоли. Было показано, что участок из 11 аминокислот N-конца кислой области (32-42) важен для разрушения фагосома.[10]
Структура
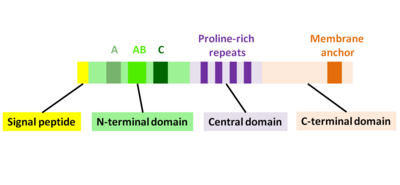
Первичный белковый продукт actA Ген состоит из 639 аминокислот и включает сигнальный пептид (первые 29 N-концевых аминокислот) и цепь ActA (C-концевые 610 аминокислот). Следовательно, последовательность зрелого белка ActA состоит из 610 аминокислот. ActA имеет молекулярную массу 70 349 Да и является поверхностным белком.[1][2]
ActA - это естественно развернутый белок, который можно разделить на три функциональных домена (рис.2):[1][11][12]
- N-концевой домен с высоким зарядом: аминокислотные остатки 1-234
- центральный домен с богатыми пролином повторами: аминокислотные остатки 235-394
- С-концевой домен с трансмембранным доменом: аминокислотные остатки 395-610
N-концевой домен
Первые 156 аминокислот N-концевого домена состоят из трех областей[10][13] (Рис. 2):
- А-область с участком кислотных остатков: 32-45
- AB-область, область связывания мономера актина: 59-102
- C-область, последовательность гомологии кофилина: 145-156
N-концевая часть ActA играет важную роль в полимеризации актина.[14] Домен отображает консенсусные элементы, присутствующие в NPF эукариотического семейства WASP, которые включают область связывания мономера актина, а также область связывания Arp2 / 3 C (центральная или гомология кофилина) и A (кислая) область.[7] Область связывания актинового мономера ActA имеет функциональные свойства, подобные WASP-Homology-2 (WH2) или домену V, но отличается последовательностью.[15] Таким образом, в NPF семейства WASP домены располагаются в следующем порядке: WH2, за которым следует C, а затем A, чего нет в ActA.
Центральный домен
Центральная богатая пролином область ActA имеет решающее значение для обеспечения эффективной подвижности бактерий. Существует четыре богатых пролином повтора, содержащих мотивы FPPPP или FPPIP. Эти области имитируют участки цитоскелетного белка клетки-хозяина. циксин, винкулин и палладин, известный как связанный с очаговые спайки или стрессовые волокна.[16] Фосфопротеин, стимулируемый вазодилататорами (ВАСП) может связываться через свой домен гомологии 1 Ena / VASP (EVH1 домен) в центральный регион, богатый пролином, и рекрутирует профилин, белок, связывающий мономер актина, который сам способствует полимеризации на зазубренных концах актиновых филаментов. Кроме того, похоже, что VASP взаимодействует с F-актин через свой карбокси-концевой домен EVH2, который обеспечивает связь бактерии с хвостом.[17] Это утверждение подтверждается тем фактом, что ActA может одновременно связывать несколько белков Ena / VASP и имеет высокое сродство между ActA и Ena / VASP. Было показано, что VASP снижает частоту актин-Y-ветвей in vitro и, таким образом, увеличивает долю нитей, которые организованы параллельно в хвостах комет.[18][19]
С-концевой домен
С-концевой домен ActA имеет гидрофобную область, которая закрепляет белок в бактериальной мембране.[20][21][22]
Таким образом, помимо
- отсутствие гомологии последовательностей в актин-связывающей области и
- изменение последовательности активирующих доменов ARP2 / 3, типичных для НПФ семейства WASP (V (WH2) -C-A),
- Основное различие между ActA и NPF хозяина состоит в том, что ActA не имеет элементов, которые связываются с регуляторными белками, такими как GTPases семейства Rho. Это структурное различие между ActA и NPF хозяина может быть выгодным для L. monocytogenes и его патогенез, поскольку активность нуклеации актина L. monocytogenes не зависит от регулирования хоста.[7]
Аналоги
WASP / N-WASP, который функционально имитирует ActA, высоко консервативен у эукариот. Он является важным организатором актинового цитоскелета и имеет решающее значение для таких процессов, как эндоцитоз и подвижность клеток. Активировано Cdc42, малая GTPase семейства Rho, WASP / N-WASP активирует комплекс Arp2 / 3, что приводит к быстрой полимеризации актина.[23]
Актиновая подвижность других патогенов
В Шигелла белок IcsA активирует N-WASP, который в неинфицированных клетках млекопитающих активируется GTPase Cdc42. Активный N-WASP / WASP приводит к полимеризации актина путем активации комплекса Arp2 / 3. Напротив, Листерия Белок ActA взаимодействует с комплексом Arp2 / 3 и непосредственно активирует его.[7]
В Риккетсия Белок RickA также способен активировать комплекс Arp2 / 3 WASP-подобным образом. В отличие от Листерияактиновые филаменты организованы в длинные неразветвленные параллельные пучки. Комплекс Arp2 / 3 локализуется только вблизи бактериальной поверхности, и поэтому предполагается, что происходит более частое независимое от комплекса Arp2 / 3 удлинение.[16]
В Burkholderia псевдомаллеи BimA инициирует полимеризацию актина in vitro. Предполагается, что внутриклеточная миграция этой бактерии функционирует независимо от комплекса Arp2 / 3.[16]
Смотрите также
Рекомендации
- ^ а б c d Кокс С., Гуэн Е., Табуре М., Берче П., Охайон Н., Коссарт П. (февраль 1992 г.). «Индуцированная L. monocytogenes сборка актина требует продукта гена actA, поверхностного белка». Клетка. 68 (3): 521–31. Дои:10.1016 / 0092-8674 (92) 90188-И. PMID 1739966.
- ^ а б Uniprot P33379
- ^ Коссарт П., Сансонетти П. Дж. (Апрель 2004 г.). «Бактериальная инвазия: парадигмы энтероинвазивных патогенов». Наука. 304 (5668): 242–8. Дои:10.1126 / science.1090124. PMID 15073367.
- ^ Коссарт П., Писарро-Серда Дж., Лекит М. (январь 2003 г.). «Инвазия клеток млекопитающих Listeria monocytogenes: функциональная мимикрия для подрыва клеточных функций». Тенденции в клеточной биологии. 13 (1): 23–31. Дои:10.1016 / S0962-8924 (02) 00006-5. PMID 12480337.
- ^ Зигмонд Ш. (февраль 2004 г.). «Формин-индуцированное зарождение актиновых филаментов». Текущее мнение в области клеточной биологии. 16 (1): 99–105. Дои:10.1016 / j.ceb.2003.10.019. PMID 15037312.
- ^ Goley ED, Rodenbusch SE, Martin AC, Welch MD (октябрь 2004 г.). «Критические конформационные изменения в комплексе Arp2 / 3 вызываются нуклеотидом и фактором, способствующим нуклеации». Молекулярная клетка. 16 (2): 269–79. Дои:10.1016 / j.molcel.2004.09.018. PMID 15494313.
- ^ а б c d Гуин Э., Велч, доктор медицины, Коссарт П. (февраль 2005 г.). «Актиновая подвижность внутриклеточных патогенов». Текущее мнение в микробиологии. 8 (1): 35–45. Дои:10.1016 / j.mib.2004.12.013. PMID 15694855.
- ^ Рафельски С.М., Териот Я.А. (февраль 2006 г.). «Механизм поляризации поверхностного белка Listeria monocytogenes ActA». Молекулярная микробиология. 59 (4): 1262–79. Дои:10.1111 / j.1365-2958.2006.05025.x. ЧВК 1413586. PMID 16430699.
- ^ Гольдберг МБ (декабрь 2001 г.). «Актиновая подвижность внутриклеточных микробных патогенов». Обзоры микробиологии и молекулярной биологии. 65 (4): 595–626. Дои:10.1128 / MMBR.65.4.595-626.2001. ЧВК 99042. PMID 11729265.
- ^ а б Пуссен М.А., Goldfine H (январь 2010 г.). «Доказательства участия ActA в созревании фагосомы Listeria monocytogenes». Клеточные исследования. 20 (1): 109–12. Дои:10.1038 / кр.2009.142. ЧВК 2802179. PMID 20029388.
- ^ Иретон К., Коссарт П. (1997). «Взаимодействия хозяина-патогена во время проникновения и актинового движения Listeria monocytogenes». Ежегодный обзор генетики. 31: 113–38. Дои:10.1146 / annurev.genet.31.1.113. PMID 9442892.
- ^ Нижний колонтитул, Мэтью Дж .; Лио, Джон К .; Териот, Джули А. (29 августа 2008 г.). «Плотная упаковка Listeria monocytogenes ActA, нативно развернутого белка, усиливает сборку F-актина без димеризации». Журнал биологической химии. 283 (35): 23852–23862. Дои:10.1074 / jbc.M803448200. ISSN 0021-9258. ЧВК 2527104. PMID 18577520.
- ^ Уэлч, Мэтью Д. (2007). «Актиновая подвижность и межклеточное распространение Listeria monocytogenes». В Goldfine, Ховард; Шэнь, Хао (ред.). Listeria monocytogenes: патогенез и реакция хозяина. Нью-Йорк: Спрингер. С. 197–223. Дои:10.1007/978-0-387-49376-3_10. ISBN 978-0-387-49373-2.
- ^ Welch MD, Rosenblatt J, Skoble J, Portnoy DA, Mitchison TJ (июль 1998 г.). «Взаимодействие человеческого комплекса Arp2 / 3 и белка ActA Listeria monocytogenes в нуклеации актиновых филаментов». Наука. 281 (5373): 105–8. Дои:10.1126 / science.281.5373.105. PMID 9651243.
- ^ Залевский Ю., Григорова И., Муллинс Р.Д. (февраль 2001 г.). «Активация комплекса Arp2 / 3 белком Listeria acta. Acta связывает два мономера актина и три субъединицы комплекса Arp2 / 3». Журнал биологической химии. 276 (5): 3468–75. Дои:10.1074 / jbc.M006407200. PMID 11029465.
- ^ а б c Lambrechts A, Gevaert K, Cossart P, Vandekerckhove J, Van Troys M (май 2008 г.). "Кометные хвосты Listeria: действующий механизм подвижности на основе актина". Тенденции в клеточной биологии. 18 (5): 220–7. Дои:10.1016 / j.tcb.2008.03.001. PMID 18396046.
- ^ Лоран В., Лойзель Т.П., Харбек Б. и др. (Март 1999 г.). «Роль белков семейства Ena / VASP в актиновой подвижности Listeria monocytogenes». Журнал клеточной биологии. 144 (6): 1245–58. Дои:10.1083 / jcb.144.6.1245. ЧВК 2150578. PMID 10087267.
- ^ Скобл Дж., Ауэрбух В., Голи Э.Д., Уэлч М.Д., Портной Д.А. (октябрь 2001 г.). «Ключевая роль VASP в опосредованном комплексом Arp2 / 3 нуклеации актина, формировании ветвей актина и подвижности Listeria monocytogenes». Журнал клеточной биологии. 155 (1): 89–100. Дои:10.1083 / jcb.200106061. ЧВК 2150787. PMID 11581288.
- ^ Медведь Ю.Е., Свиткина Т.М., Краузе М. и др. (Май 2002 г.). «Антагонизм между белками Ena / VASP и актиновыми филаментами регулирует подвижность фибробластов». Клетка. 109 (4): 509–21. Дои:10.1016 / S0092-8674 (02) 00731-6. HDL:1721.1/83477. PMID 12086607.
- ^ Васкес-Боланд Дж. А., Кокс С., Драмси С. и др. (Январь 1992 г.). «Нуклеотидная последовательность оперона лецитиназы Listeria monocytogenes и возможная роль лецитиназы в распространении от клетки к клетке». Инфекция и иммунитет. 60 (1): 219–30. ЧВК 257526. PMID 1309513.
- ^ Доманн Э., Веланд Дж., Роде М. и др. (Май 1992 г.). «Новый ген бактериальной вирулентности в Listeria monocytogenes, необходимый для взаимодействия микрофиламентов клетки-хозяина с гомологией с богатой пролином областью винкулина». Журнал EMBO. 11 (5): 1981–90. Дои:10.1002 / j.1460-2075.1992.tb05252.x. ЧВК 556658. PMID 1582425.
- ^ Кокс С., Хеллио Р., Гунон П., Охайон Н., Коссарт П. (июль 1993 г.). «Поляризованное распределение поверхностного белка ActA Listeria monocytogenes в месте направленной сборки актина». Журнал клеточной науки. 105 (3): 699–710. PMID 8408297.
- ^ Курису С., Такенава Т. (2009). «Белки семейства WASP и WAVE». Геномная биология. 10 (6): 226. Дои:10.1186 / gb-2009-10-6-226. ЧВК 2718491. PMID 19589182.
внешняя ссылка
- YouTube видео из Природа, Listeria monocytogenes [2:00–4:12]