WikiDer > Клеточное обезвоживание
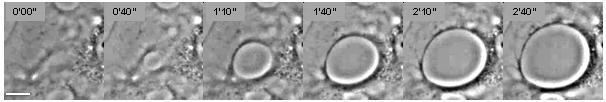
Сотовый обезвоживание относится к процессу зарождение и увеличение туннелей макроапертуры трансэндотелиальных клеток (ПЭМ) в эндотелиальные клетки (Рисунок 1).[1] Это явление аналогично зарождению и росту сухих пятен в вязких жидкостях, растекающихся по поверхности. несмачиваемый субстрат (рисунок 2).[2] Клеточное обезвоживание вызывается несколькими белковыми токсинами из патогенные бактерии, в частности, факторы, подобные EDIN из Золотистый стафилококк и из Clostridium botulinum, а также токсин отека от бацилла сибирской язвы.[3][4] ТЕА образуются в ответ на разрыв цитоскелет физические соединения через цитоплазма из-за торможения Путь RhoA / ROCK или к индукции потока циклического АМФ (лагерь) широкий сигнальная молекула.[4][5]
Физика клеточного обезвоживания

Феномен клеточного обезвоживания можно объяснить с помощью физического моделирования (рис. 2).[6] В движущая сила ответственны за самопроизвольное образование туннелей ПЭМ и их открытие мембрана напряжение который возникает в результате распространения клеток из-за релаксации актомиозина. В отличие от обезвоживания жидкостью, ТЭМ достигают максимального диаметра, при котором движущая сила уравновешивается силой сопротивления, развивающейся по краям ТЭМ (рис. 2). Эта сила сопротивления называется натяжение линии и не охарактеризован на молекулярном уровне.
Физические параметры
Движущие силы протягивание туннеля радиуса р, как показано на Рисунке 2. Здесь натяжение происходит из-за натяжения клеточная мембрана (σ), которому частично противодействует линейное натяжение вокруг туннеля (Т). В этих условиях чистая движущая сила (FD) состоит из двух вкладов:
Осушение происходит, если FD>0.
Напряжение мембраны (σ) зависит от радиуса туннеля р. Увеличение размера туннеля расслабляет мембрана, вызывая снижение натяжения мембраны, как описано Закон Гельфриха.
Натяжение линии (Т) соответствует силе сопротивления вдоль края туннеля, которая противодействует натяжению мембраны и ограничивает влагу. Это линейное натяжение может иметь физические и молекулярные компоненты.
Рекомендации
- ^ Лемичез, Э. (2012). «Динамика трансклеточного туннеля: контроль клеточного обезвоживания с помощью сократимости актомиозина и белков I-BAR». Биология клетки. 105 (3): 109–117. Дои:10.1111 / boc.201200063. PMID 23189935.
- ^ Де Женн, П.-Г. (2004). Капиллярность и явления смачивания. Нью-Йорк: Спрингер. ISBN 978-0387005928.
- ^ Бойер, Л. (2006). «Индукция временных макроапертур в эндотелиальных клетках посредством ингибирования RhoA факторами Staphylococcus aureus». Журнал клеточной биологии. 173 (5): 809–819. Дои:10.1083 / jcb.200509009. ЧВК 2063895. PMID 16754962.
- ^ а б Маддугода, М. П. (2011). «Передача сигналов цАМФ токсином отека сибирской язвы индуцирует трансэндотелиальные клеточные туннели, которые закрываются MIM через Arp2 / 3-управляемую полимеризацию актина». Клеточный хозяин и микроб. 10 (5): 464–474. Дои:10.1016 / j.chom.2011.09.014. PMID 22100162.
- ^ Цай, Ю. (2010). «Цитоскелетная когерентность требует сократимости миозина IIA». Журнал клеточной науки. 123 (3): 413–423. Дои:10.1242 / jcs.058297. ЧВК 2816186. PMID 20067993.
- ^ Гонсалес-Родригес, Д. (2012). «Клеточное обезвоживание: открытие макроапертур в эндотелиальных клетках». Письма с физическими проверками. 108 (21): 218105. Дои:10.1103 / PhysRevLett.108.218105. PMID 23003307.
