WikiDer > Смачивание
Смачивание это способность жидкость поддерживать контакт с твердый поверхность, в результате межмолекулярный взаимодействия, когда эти двое собраны вместе. Степень смачивания (смачиваемость) определяется балансом сил между клей и сплоченный силы. Смачивание имеет дело с тремя фазами вещества: газом, жидкостью и твердым телом. Сейчас он находится в центре внимания нанотехнологий и исследований нанонауки из-за появления многих наноматериалов за последние два десятилетия (например, графен,[1] углеродная нанотрубка, нитрид бора наномеш[2]).
Смачивание важно в связь или же приверженность из двух материалов.[3] Смачивание и поверхностные силы, контролирующие смачивание, также ответственны за другие связанные эффекты, в том числе капилляр последствия.
Есть два типа смачивания: безреактивное смачивание и активное смачивание.[4][5]
Объяснение
Клей силы между жидкость и твердый вызвать растекание капли жидкости по поверхности. Сплоченный силы внутри жидкости заставляют каплю скатываться и избегать контакта с поверхностью.
| Рис. 2 | Угол контакта | Степень смачивание | Сила взаимодействия | |
|---|---|---|---|---|
| Твердое – жидкое | Жидкость – жидкость | |||
| S | θ = 0 | Идеальное смачивание | Сильный | Слабый |
| C | 0 <θ <90 ° | Высокая смачиваемость | Сильный | Сильный |
| Слабый | Слабый | |||
| B | 90 ° ≤ θ <180 ° | Низкая смачиваемость | Слабый | Сильный |
| А | θ = 180 ° | Несмачивание | Слабый | Сильный |
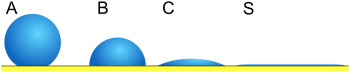
В угол контакта (θ), как показано на рисунке 1, представляет собой угол, под которым граница раздела жидкость – пар встречается с границей твердое тело – жидкость. Угол контакта определяется балансом между адгезионными и когезионными силами. По мере того, как тенденция капли растекаться по плоской твердой поверхности увеличивается, угол смачивания уменьшается. Таким образом, краевой угол является обратной мерой смачиваемости.[6]
Угол смачивания менее 90 ° (низкий угол смачивания) обычно указывает на то, что смачивание поверхности очень благоприятно, и жидкость будет растекаться по большой площади поверхности. Углы смачивания более 90 ° (высокий угол смачивания) обычно означают, что смачивание поверхности неблагоприятно, поэтому жидкость минимизирует контакт с поверхностью и образует компактную каплю жидкости.
Для воды смачиваемую поверхность также можно назвать гидрофильный и несмачиваемая поверхность гидрофобный. Супергидрофобные поверхности имеют краевые углы более 150 °, при этом контакт между каплей жидкости и поверхностью практически отсутствует. Иногда это называют "Эффект лотоса". В таблице описаны различные углы смачивания и соответствующие им взаимодействия твердое тело / жидкость и жидкость / жидкость.[7] Для неводных жидкостей термин «лиофильный» используется для условий с низким углом смачивания, а термин «лиофобный» используется для обозначения более высоких углов смачивания. Точно так же термины омнифобный и омнифильный относятся к обоим полярный и аполярные жидкости.
Поверхности с высокой и низкой энергией
Жидкости могут взаимодействовать с двумя основными типами твердых поверхностей. Традиционно твердые поверхности делятся на высокопрочные.энергия и твердые тела с низким энергопотреблением. Относительная энергия твердого тела связана с объемной природой самого твердого тела. Твердые вещества, такие как металлы, очки, и керамика известны как твердые тела, потому что химические связи удерживающие их вместе (например, ковалентные, ионные или металлические) очень сильны. Таким образом, для разрушения этих твердых тел требуется большое количество энергии (альтернативно, требуется большое количество энергии, чтобы разрезать основную массу и образовать две отдельные поверхности), поэтому их называют «высокоэнергетическими». Большинство молекулярных жидкостей полностью смачиваются высокоэнергетическими поверхностями.
Другой тип твердого тела - это слабые молекулярные кристаллы (например, фторуглероды, углеводороды и т. Д.), В которых молекулы удерживаются вместе в основном за счет физических сил (например, сил Ван-дер-Ваальса и водородных связей). Поскольку эти твердые тела удерживаются вместе слабыми силами, для их разрушения требуется очень небольшое количество энергии, поэтому они называются «низкоэнергетическими». В зависимости от типа выбранной жидкости низкоэнергетические поверхности могут допускать полное или частичное смачивание.[8][9]
Сообщается, что динамические поверхности претерпевают изменения в поверхностная энергия при применении соответствующих раздражителей. Например, было показано, что поверхность, представляющая управляемые фотонами молекулярные двигатели, претерпевает изменения краевого угла смачивания воды при переключении между бистабильными конформациями с различной поверхностной энергией.[10]
Смачивание низкоэнергетических поверхностей
Поверхности с низким энергопотреблением в первую очередь взаимодействуют с жидкостями через дисперсионные (ван дер Ваальс) сил. Уильям Зисман сделал несколько ключевых выводов:[11]
Зисман заметил, что cos θ линейно увеличивается с увеличением поверхностное натяжение (γLV) жидкости уменьшилось. Таким образом, он смог установить линейная функция между cos θ и поверхностным натяжением (γLV) для различных органический жидкости.
Поверхность более смачиваема, когда γLV и θ низкий. Зисман назвал пересечение этих линий при cos θ = 1 критическое поверхностное натяжение (γc) этой поверхности. Это критическое поверхностное натяжение является важным параметром, потому что оно характерно только для твердого тела.
Зная критическое поверхностное натяжение твердого тела, можно предсказать смачиваемость поверхности.[6] Смачиваемость поверхности определяется внешними химическими группами твердого тела. Различия в смачиваемости поверхностей схожей структуры обусловлены различиями в упаковке атомов. Например, если поверхность имеет разветвленные цепи, она будет иметь более плохую упаковку, чем поверхность с прямыми цепями. Более низкое критическое поверхностное натяжение означает менее смачиваемую поверхность материала.
Идеальные твердые поверхности
An идеальная поверхность плоский, жесткий, идеально гладкий, химически однородный и не имеет гистерезис контактного угла. Нуль гистерезис подразумевает, что углы смачивания и удаления равны. Другими словами, существует только один термодинамически стабильный контактный угол. Когда капля жидкости помещается на такую поверхность, характерный угол смачивания образуется, как показано на рисунке 1. Кроме того, на идеальной поверхности капля возвращается к своей первоначальной форме, если ее нарушить.[7][11] Следующие ниже выводы применимы только к идеальным твердым поверхностям; они действительны только для состояния, в котором границы раздела фаз неподвижны, а линия границы раздела фаз находится в состоянии равновесия.
Минимизация энергии, три фазы
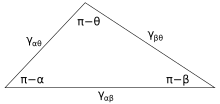
На рисунке 3 показана линия контакта, где встречаются три фазы. В равновесие, сеть сила на единицу длины, действующую вдоль границы между тремя фазами, должен быть равен нулю. Компоненты результирующей силы в направлении вдоль каждой из поверхностей раздела определены как:
где α, β и θ - указанные углы, а γij - поверхностная энергия между двумя указанными фазами. Эти отношения также могут быть выражены аналогом треугольника, известного как треугольник Неймана, показанного на рисунке 4. Треугольник Неймана согласуется с геометрическим ограничением, что , и применяя к нему закон синусов и закон косинусов, получаем соотношения, которые описывают, как межфазные углы зависят от отношения поверхностных энергий.[12]
Поскольку эти три поверхностные энергии образуют стороны треугольник, они ограничены неравенствами треугольника γij <γjk + γik Это означает, что ни одно из поверхностных натяжений не может превышать сумму двух других. Если три жидкости с поверхностной энергией, которые не соответствуют этим неравенствам, вступят в контакт, не будет существовать равновесная конфигурация, соответствующая рисунку 3.
Упрощение до плоской геометрии, соотношение Юнга
Если фаза β заменена плоской жесткой поверхностью, как показано на рисунке 5, тогда β = π, и второе уравнение чистой силы упрощается до уравнения Юнга,[13]
который связывает поверхностное натяжение между тремя фазами: твердый, жидкость и газ. Впоследствии это предсказывает краевой угол смачивания жидкости. капля на твердой поверхности из знания трех задействованных поверхностных энергий. Это уравнение также применимо, если «газовая» фаза представляет собой другую жидкость, несмешиваемый с каплей первой «жидкой» фазы.
Упрощение до плоской геометрии, соотношение Юнга, полученное из вариационных вычислений
Считайте интерфейс кривой за куда - свободный параметр. Свободная энергия, которую необходимо минимизировать, составляет
с ограничениями который мы можем написать как и фиксированный объем .
Таким образом, модифицированный лагранжиан с учетом ограничений имеет вид
куда - множители Лагранжа. По определению импульс и гамильтониан который вычисляется как:
Напомним, что граница свободна в направление и - свободный параметр. Следовательно, мы должны иметь:
На границе и , поэтому восстанавливаем уравнение Юнга.
Неидеально гладкие поверхности и угол смачивания Юнга
Уравнение Юнга предполагает идеально плоскую и жесткую поверхность, которую часто называют идеальная поверхность. Во многих случаях поверхности далеки от этой идеальной ситуации, и здесь рассматриваются два случая: случай шероховатых поверхностей и случай гладких поверхностей, которые все еще являются действительными (конечно жесткими). Даже на идеально гладкой поверхности капля будет принимать широкий спектр углов смачивания, начиная от так называемого наступающего угла смачивания, , до так называемого отступающего контактного угла, . Равновесный контактный угол () можно рассчитать из и как показал Тадмор[15] в качестве,
куда
Уравнение Юнга – Дюпре и коэффициент распространения
Уравнение Юнга – Дюпре (Thomas Young 1805; Anthanase Dupré и Paul Dupré 1869) не показывает, что ни γSG ни γSL может быть больше суммы двух других поверхностных энергий.[16][17] Следствием этого ограничения является предсказание полного смачивания при γSG > γSL + γLG и нулевое смачивание при γSL > γSG + γLG. Отсутствие решения уравнения Юнга – Дюпре является показателем отсутствия равновесной конфигурации с краевым углом между 0 и 180 ° для таких ситуаций.[18]
Полезный параметр для измерения увлажнения - это параметр распространения S,
Когда S > 0 жидкость полностью смачивает поверхность (полное смачивание). Когда S <0 происходит частичное смачивание.
Комбинируя определение параметра распространения с соотношением Юнга, получаем уравнение Юнга – Дюпре:
который имеет физические решения для θ только при S <0.
Уравнение Джаспера-Ананда для плоских и искривленных поверхностей.
Благодаря усовершенствованию методов измерения, таких как АСМ, конфокальная микроскопия и СЭМ, исследователи смогли создавать и отображать капли во все меньших масштабах. С уменьшением размера капель появились новые экспериментальные наблюдения за смачиванием. Эти наблюдения подтвердили, что модифицированное уравнение Юнга не выполняется на микромасштабах.
Для сидячая капля, свободная энергия трехфазной системы может быть выражена как:[19]
При постоянном объеме в условиях термодинамического равновесия это сводится к:[19][20]
Обычно VdP термин не учитывается для крупных капель, однако VdP работа становится значимой в малых масштабах. Изменение давления при постоянном объеме на свободной границе жидкость-пар происходит из-за давления Лапласа, которое пропорционально средней кривизне и не равно нулю. Решение вышеуказанного уравнения для выпуклых и вогнутых поверхностей дает:[20]
Где постоянные параметры A, B и C определены как:
, и .
Это уравнение связывает контактный угол , геометрическое свойство сидящей капли для объемной термодинамики, энергия на границе трехфазного контакта , а кривизна поверхности . Для частного случая неподвижной капли на плоской поверхности :
Первые два члена в приведенном выше уравнении представляют собой модифицированное уравнение Юнга, а третий член связан с давлением Лапласа. Это нелинейное уравнение правильно предсказывает знак и величину κ, сглаживание краевого угла в очень малых масштабах и гистерезис краевого угла.[20]
Расчетное прогнозирование смачивания
Для многих конфигураций поверхность / адсорбат данные по поверхностной энергии и экспериментальные наблюдения недоступны. Поскольку смачивающие взаимодействия имеют большое значение в различных применениях, часто желательно прогнозировать и сравнивать поведение смачивания различных поверхностей материала с определенной кристаллографической ориентацией по отношению к воде или другим адсорбентам. Это можно сделать с атомистической точки зрения с помощью инструментов, включая молекулярная динамика и теория функционала плотности.[21][22] В теоретическом прогнозе смачивания ab initio В таких подходах, как DFT, вода обычно заменяется льдом. Это связано с тем, что расчеты DFT обычно проводятся в условиях нулевого теплового движения атомов, что по существу означает, что моделирование проводится при абсолютный ноль. Это упрощение, тем не менее, дает результаты, которые актуальны для адсорбции воды в реальных условиях, и использование льда для теоретического моделирования смачивания является обычным явлением.[23]
Неидеальные шероховатые твердые поверхности
В отличие от идеальных поверхностей, настоящие поверхности не обладают идеальной гладкостью, жесткостью или химической однородностью. Подобные отклонения от идеальности приводят к явлению, называемому гистерезис контактного угла, определяемую как разность опережающих (θа) и удаляющейся (θр) краевые углы[24]
Когда контактный угол находится между наступающим и отступающим случаями, линия контакта считается закрепленной, и можно наблюдать гистерезисное поведение, а именно гистерезис контактного угла. Когда эти значения превышаются, смещение контактной линии, как на рисунке 3, будет происходить либо за счет расширения, либо втягивания капли.[25] На рис. 6 показаны углы смачивания при движении вперед и назад. Угол контакта при продвижении - это максимальный стабильный угол, а угол контакта при удалении - это минимальный стабильный угол. Гистерезис краевого угла возникает из-за того, что на неидеальном твердом теле обнаруживается множество различных термодинамически стабильных краевых углов. Эти изменяющиеся термодинамически стабильные краевые углы известны как метастабильные состояния.[11]
Такое движение границы раздела фаз, включающее углы смачивания и отступления, известно как динамическое смачивание. Разница между динамическим и статическим углами смачивания пропорциональна капиллярное число, Когда линия контакта продвигается, покрывая большую часть поверхности жидкостью, угол контакта увеличивается и, как правило, связан со скоростью линии контакта.[25][26] Если скорость линии контакта неограниченно увеличивается, угол смачивания увеличивается, и по мере приближения к 180 ° газовая фаза увлекается тонким слоем между жидкостью и твердым телом. Это кинетический неравновесный эффект, который возникает из-за того, что линия контакта движется с такой высокой скоростью, что полное смачивание не может произойти.
Известным отклонением от идеальных условий является грубая текстура исследуемой поверхности. Шероховатая текстура поверхности может относиться к одной из двух категорий: однородная и неоднородная. Режим гомогенного смачивания - это когда жидкость заполняет бороздки шероховатой поверхности. Однако при гетерогенном режиме смачивания поверхность состоит из двух типов пятен. Важным примером такой композитной поверхности является поверхность, состоящая из участков как воздуха, так и твердого тела. Такие поверхности по-разному влияют на краевые углы смачивания жидкостей. Кэсси-Бакстер и Венцель - две основные модели, которые пытаются описать смачивание текстурированных поверхностей. Однако эти уравнения применимы только тогда, когда размер капли достаточно велик по сравнению со шкалой шероховатости поверхности.[27] Когда размер капли сравним с размером нижележащих столбов, следует учитывать эффект натяжения линии.[28]
Модель Венцеля
В Модель Венцеля (Роберт Н. Венцель, 1936) описывает режим однородного смачивания, как показано на рисунке 7, и определяется следующим уравнением для краевого угла смачивания на шероховатой поверхности:[27]
куда - кажущийся угол смачивания, который соответствует стабильному состоянию равновесия (то есть состоянию с минимальной свободной энергией для системы). В коэффициент шероховатости, r, является мерой того, как шероховатость поверхности влияет на однородную поверхность. Коэффициент шероховатости определяется как отношение истинной площади твердой поверхности к кажущейся площади.
θ - это Угол контакта молодого как определено для идеальной поверхности. Хотя уравнение Венцеля показывает, что контактный угол шероховатой поверхности отличается от внутренний угол контакта, он не описывает угол контакта гистерезис.[29]
Модель Кэсси-Бакстера
При работе с неоднородной поверхностью модели Венцеля недостаточно. Необходима более сложная модель, чтобы измерить, как изменяется кажущийся угол смачивания при использовании различных материалов. Эта неоднородная поверхность, подобная изображенной на рисунке 8, объясняется с помощью уравнения Кэсси-Бакстера (Закон Кэсси):[27]
Здесь рж - коэффициент шероховатости мокрой поверхности и ж - доля площади твердой поверхности, смоченной жидкостью. Важно понимать, что когда ж = 1 и рж = г, уравнения Кэсси – Бакстера превращаются в уравнение Венцеля. С другой стороны, когда имеется много различных долей шероховатости поверхности, каждая доля от общей площади поверхности обозначается как .
Суммирование всего равно 1 или общей поверхности. Кэсси – Бакстер также можно преобразовать в следующее уравнение:[30]
Здесь γ - поверхностное натяжение Кэсси – Бакстера между жидкостью и паром, γя, св - поверхностное натяжение твердого пара каждого компонента, а γя, сл - поверхностное натяжение твердой жидкости каждого компонента. Стоит упомянуть случай, когда капля жидкости помещается на подложку и создает под ней небольшие воздушные карманы. Этот случай для двухкомпонентной системы обозначается:[30]
Здесь следует отметить ключевое различие в том, что для второй компоненты поверхностного натяжения между твердым телом и паром отсутствует поверхностное натяжение. Это связано с предположением, что открытая поверхность воздуха находится под каплей и является единственным другим субстратом в системе. Впоследствии уравнение выражается как (1 - ж). Следовательно, уравнение Кэсси может быть легко выведено из уравнения Кэсси – Бакстера. Экспериментальные результаты относительно свойств поверхности систем Венцеля и Кэсси-Бакстера показали эффект закрепления для угла Юнга от 180 до 90 °, области, классифицированной в рамках модели Кэсси-Бакстера. Эта композитная система жидкость / воздух в значительной степени гидрофобна. После этого был обнаружен резкий переход к режиму Венцеля, когда капля смачивает поверхность, но не дальше краев капли. Фактически уравнения Юнга, Венцеля и Кэсси-Бакстера представляют собой условия трансверсальности вариационной задачи смачивания.[31][32]
Пленка-предшественник
С появлением изображений с высоким разрешением исследователи начали получать экспериментальные данные, которые заставили их усомниться в предположениях уравнения Кэсси-Бакстера при вычислении видимого краевого угла. Эти группы[ВОЗ?] полагают, что кажущийся угол смачивания во многом зависит от тройной линии. Тройная линия, соприкасающаяся с неоднородной поверхностью, не может лежать на неоднородной поверхности, как остальная часть капли. По идее, это должно следовать за несовершенством поверхности. Этот изгиб тройной линии неблагоприятен и не наблюдается в реальных ситуациях. Теория, которая сохраняет уравнение Кэсси – Бакстера и в то же время объясняет наличие минимизированного энергетического состояния тройной линии, основана на идее пленки-предшественника. Эта пленка субмикронной толщины опережает движение капли и находится вокруг тройной линии. Кроме того, эта пленка-предшественник позволяет тройной линии изгибаться и принимать различные формы, которые изначально считались неблагоприятными. Эта жидкость-предшественник наблюдалась с использованием сканирующая электронная микроскопия окружающей среды (ESEM) на поверхностях с порами, сформированными в объеме. С введением концепции пленки-предшественника тройная линия может следовать энергетически возможным конформациям, тем самым правильно объясняя модель Кэсси – Бакстера.[33]
«Эффект лепестка» против «эффекта лотоса»
Внутренняя гидрофобность поверхности может быть улучшена за счет текстурирования с различными масштабами длины грубость. Красный Роза использует это преимущество, используя иерархию микро- и наноструктур на каждом лепестке, чтобы обеспечить достаточную шероховатость для супергидрофобности. Точнее говоря, каждый лепесток розы имеет на своей поверхности набор микропапилл, а каждый сосочек, в свою очередь, имеет множество нано складок. Период, термин "лепестковый эффект"описывает тот факт, что капля воды на поверхности лепестка розы имеет сферическую форму, но не может скатиться, даже если лепесток перевернуть вверх дном. Капли воды сохраняют свою сферическую форму из-за супергидрофобности лепестка (угол контакта примерно 152,4 °), но не скатывается, потому что поверхность лепестка имеет высокую силу сцепления с водой.[34]
При сравнении "лепестковый эффект"к"эффект лотоса", важно отметить некоторые поразительные различия. Структуру поверхности листа лотоса и лепестка розы, как показано на рисунке 9, можно использовать для объяснения двух различных эффектов.
Лист лотоса имеет случайно шероховатую поверхность и низкий угол контакта гистерезис, что означает, что капля воды не может смачивать микроструктурные пространства между шипами. Это позволяет воздуху оставаться внутри текстуры, создавая неоднородную поверхность, состоящую как из воздуха, так и из твердого вещества. В результате сила сцепления между водой и твердой поверхностью чрезвычайно мала, что позволяет воде легко скатываться (т.е. "самоочищение"явление").
Микро- и наноструктуры лепестков розы крупнее по размеру, чем у листа лотоса, что позволяет пленке жидкости пропитать текстуру. Однако, как показано на рисунке 9, жидкость может попасть в канавки большего размера, но не может попасть в канавки меньшего размера. Это известно как режим пропитки Кэсси. Поскольку жидкость может смачивать канавки большего размера, сила сцепления между водой и твердым телом очень высока. Это объясняет, почему капля воды не упадет, даже если лепесток наклонен под углом или перевернут. Этот эффект потерпит неудачу, если капля имеет объем более 10 мкл, потому что нарушен баланс между весом и поверхностным натяжением.[35]
Переход Кэсси-Бакстера к Венцеля
в Модель Кэсси-Бакстера, капля находится на текстурированной поверхности, а под ней находится воздух. Вовремя переход смачивания из состояния Кэсси в состояние Венцеля воздушные карманы больше не являются термодинамически стабильными, и жидкость начинает зарождаться из середины капли, создавая «грибовидное состояние», как показано на рисунке 10.[36] Условие проникновения определяется следующим образом:
куда
- θC критический угол смачивания
- Φ - доля границы раздела твердое / жидкое, при которой капля контактирует с поверхностью
- р - сплошная шероховатость (для плоской поверхности r = 1)
Фронт проникновения распространяется, чтобы минимизировать поверхностную энергию, пока не достигнет краев капли, достигая, таким образом, состояния Венцеля. Поскольку твердое тело можно рассматривать как абсорбирующий материал из-за его шероховатости поверхности, это явление растекания и впитывания называется полувыкованием. Краевые углы, при которых происходит растекание / пропитывание, составляют от 0 до π / 2.[37]
Модель Венцеля справедлива между θC и π / 2. Если контактный угол меньше ΘCфронт проникновения выходит за пределы капли и на поверхности образуется пленка жидкости. На рисунке 11 изображен переход от состояния Венцеля к состоянию поверхностной пленки. Пленка сглаживает шероховатость поверхности, и модель Венцеля больше не применяется. В этом состоянии условие равновесия и соотношение Юнга дают:
За счет точной настройки шероховатости поверхности можно добиться перехода как между супергидрофобными, так и супергидрофильными областями. Как правило, чем грубее поверхность, тем она более гидрофобна.
Динамика распространения
Если капля помещается на гладкую горизонтальную поверхность, она обычно не находится в состоянии равновесия. Следовательно, он распространяется до достижения равновесного радиуса контакта (частичное смачивание). С учетом капиллярного, гравитационного и вязкого вкладов радиус капли как функция времени может быть выражен как[38]
Для ситуации полного смачивания радиус капли в любой момент во время процесса растекания определяется выражением
куда
- γLG является поверхностное натяжение жидкости
- V объем капли
- η является вязкость жидкости
- ρ является плотность жидкости
- грамм является гравитационная постоянная
- λ коэффициент формы, 37,1 м−1
- т0 экспериментальное время задержки
- ре радиус капли в равновесии
Изменение смачивающих свойств
Поверхностно-активные вещества
Многие технологические процессы требуют контроля растекания жидкости по твердым поверхностям. Когда капля помещается на поверхность, она может полностью или частично намочить или не намочить поверхность. За счет уменьшения поверхностного натяжения с поверхностно-активные веществанесмачиваемый материал может быть частично или полностью смачиваемым. Избыточная свободная энергия (σ) капли на твердой поверхности равна:[39]
- γ - межфазное натяжение жидкость – пар
- γSL - межфазное натяжение твердое тело – жидкость
- γSV - межфазное натяжение твердого тела и пара
- S площадь границы раздела жидкость – пар
- п избыточное давление внутри жидкости
- р радиус основания капли
На основании этого уравнения избыточная свободная энергия минимизируется при уменьшении γ, γSL уменьшается, или γSV увеличивается. Поверхностно-активные вещества абсорбируются на поверхностях раздела жидкость-пар, твердое тело-жидкость и твердое тело-пар, что изменяет смачиваемость гидрофобных материалов для уменьшения свободной энергии. Когда поверхностно-активные вещества абсорбируются на гидрофобной поверхности, группы полярных головок обращены в раствор хвостом наружу. На более гидрофобных поверхностях поверхностно-активные вещества могут образовывать двойной слой на твердом теле, что делает его более гидрофильным. Динамический радиус капли можно охарактеризовать, когда капля начинает растекаться. Таким образом, краевой угол изменяется на основе следующего уравнения:[39]
- θ0 начальный контактный угол
- θ∞ конечный угол контакта
- τ шкала времени переноса поверхностно-активного вещества
По мере поглощения поверхностно-активных веществ поверхностное натяжение твердое тело – пар увеличивается, а края капли становятся гидрофильными. В результате капля распространяется.
Изменения поверхности
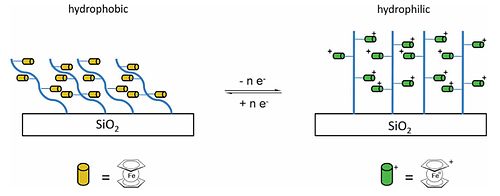
Ферроцен это редокс-активное металлоорганическое соединение[41] которые могут быть включены в различные мономеры и раньше делал полимеры который можно привязать к поверхности.[40] Винилферроцен (ферроценилэтен) может быть получен Реакция Виттига[42] а затем полимеризовали с образованием поливинилферроцена (PVFc), аналог из полистирол. Другой полимер, который может быть получен, - это поли (2- (метакрилоилокси) этил ферроценкарбоксилат), PFcMA. И PVFc, и PFcMA были привязаны к кремнезем пластины и смачиваемость, измеренная, когда полимерные цепи не заряжены и когда ферроцен части окисляются с образованием положительно заряженных групп, как показано справа.[40] Краевой угол смачивания с водой на пластинах, покрытых PFcMA, был на 70 ° меньше после окисления, в то время как в случае PVFc уменьшение составляло 30 °, и было показано, что переключение смачиваемости обратимо. В случае PFcMA влияние более длинных цепей с большим количеством ферроценовых групп (а также большей молярная масса) был исследован, и было обнаружено, что более длинные цепи приводят к значительно большему уменьшению угла смачивания.[40][43]
Кислородные вакансии
Оксиды редкоземельных элементов обладают собственной гидрофобностью и, следовательно, могут использоваться в термостабильных теплообменники и другие применения, связанные с гидрофобностью при высоких температурах.[44] Наличие кислородных вакансий на поверхности оксидов церия или других оксидов редкоземельных элементов играет важную роль в регулировании смачиваемости поверхности. Адсорбция воды на оксидных поверхностях может происходить как молекулярная адсорбция, при которой H2Молекулы O остаются нетронутыми на конечной поверхности или в результате диссоциативной адсорбции, при которой OH и H адсорбируются отдельно.[45] на твердых поверхностях. Обычно обнаруживается, что присутствие кислородных вакансий увеличивает гидрофобность, способствуя диссоциативной адсорбции.[46]
Смотрите также
- Адсорбция - Процесс, возникающий в результате притяжения атомов, ионов или молекул из газа, жидкости или раствора, прилипшего к поверхности
- Тест Амотта
- Анти туман - Химические вещества, предотвращающие конденсацию воды в виде мелких капель на поверхности
- Обезвоживание
- Электросмачивание
- Флотация
- Техника сеансового сброса - Метод, используемый для характеристики твердой поверхностной энергии
- Мыльный пузырь - Тонкая пленка мыльной воды, окружающая воздух
- Повышение в ядре - Лабораторная техника
- Смачивающий ток - Минимальный электрический ток через контакт для пробоя сопротивления поверхностной пленки
- Напряжение смачивания
Рекомендации
- ^ Rafiee, J .; Mi, X .; Gullapalli, H .; Thomas, A. V .; Yavari, F .; Shi, Y .; Ajayan, P.M .; Кораткар, Н. А. (2012). «Смачивающая прозрачность графена» (PDF). Материалы Природы. 11 (3): 217–22. Bibcode:2012НатМа..11..217Р. Дои:10.1038 / nmat3228. PMID 22266468. Архивировано из оригинал (PDF) на 2017-11-15.
- ^ Mertens, Stijn F. L .; Хемми, Адриан; Мафф, Стефан; Грёнинг, Оливер; Де Фейтер, Стивен; Остервальдер, Юрг; Гребер, Томас (2016). «Переключение трения и сцепления жидкости с твердым телом» (PDF). Природа. 534 (7609): 676–679. Bibcode:2016Натура.534..676М. Дои:10.1038 / природа18275. PMID 27357755. S2CID 205249367. Архивировано из оригинал (PDF) на 2019-04-11.
- ^ Амзиан, Софиан; Колле, Флоренция (2017-03-05). Строительные материалы на основе биоагрегатов: новейший отчет технического комитета RILEM 236-BBM. Springer. ISBN 9789402410310.
- ^ Dezellus, O .; Евстатопулос, Н. (2010). «Фундаментальные вопросы реактивного смачивания жидкими металлами» (PDF). Журнал материаловедения. 45 (16): 4256–4264. Bibcode:2010JMatS..45.4256D. Дои:10.1007 / s10853-009-4128-x. S2CID 4512480.
- ^ Ху, Хань; Цзи, Хай-Фэн; Солнце, Ин (2013). «Влияние кислородных вакансий на смачиваемость поверхности ZnO водой». Физическая химия Химическая физика. 15 (39): 16557–65. Bibcode:2013PCCP ... 1516557H. Дои:10.1039 / C3CP51848E. PMID 23949186. S2CID 205850095.
- ^ а б Sharfrin, E .; Зисман, Уильям А. (1960). «Определяющие соотношения в смачивании низкоэнергетических поверхностей и теория ретракционного метода приготовления монослоев». Журнал физической химии. 64 (5): 519–524. Дои:10.1021 / j100834a002.
- ^ а б Eustathopoulos, N .; Николас, М.Г .; Древет Б. (1999). Смачиваемость при высоких температурах. Оксфорд, Великобритания: Пергамон. ISBN 978-0-08-042146-9.
- ^ Schrader, M.E; Лоеб, Г. (1992). Современные подходы к смачиваемости. Теория и приложения. Нью-Йорк: Пленум Пресс. ISBN 978-0-306-43985-8.
- ^ де Женн, П. (1985). «Смачивание: статика и динамика» (PDF). Обзоры современной физики. 57 (3): 827–863. Bibcode:1985РвМП ... 57..827Д. Дои:10.1103 / RevModPhys.57.827. Архивировано из оригинал (PDF) 10 сентября 2016 г.
- ^ Чен, Куанг-Янь; Иващенко, Алексей; Кэрролл, Грегори Т .; Робертус, Джорт; Kistemaker, Jos C.M .; Лондон, Габор; Браун, Уэсли Р.; Рудольф, Петра; Феринга, Бен Л. (2014). «Контроль смачиваемости поверхности с помощью триподных светоактивируемых молекулярных двигателей». Журнал Американского химического общества. 136 (8): 3219–3224. Дои:10.1021 / ja412110t. PMID 24490770.
- ^ а б c Джонсон, Рулон Э. (1993) в Смачиваемость Эд. Берг, Джон. C. Нью-Йорк, штат Нью-Йорк: Marcel Dekker, Inc. ISBN 0-8247-9046-4
- ^ Rowlinson, J.S .; Видом Б. (1982). Молекулярная теория капиллярности. Оксфорд, Великобритания: Clarendon Press. ISBN 978-0-19-855642-8.
- ^ Янг, Т. (1805). «Эссе о сцеплении жидкостей» (PDF). Философские труды Лондонского королевского общества. 95: 65–87. Дои:10.1098 / рстл.1805.0005. S2CID 116124581.
- ^ Т.С. Чоу (1998). «Смачивание шероховатых поверхностей». Журнал физики: конденсированное вещество. 10 (27): L445 – L451. Bibcode:1998JPCM ... 10L.445C. Дои:10.1088/0953-8984/10/27/001.
- ^ Тадмор, Рафаэль (2004). «Энергия линии и соотношение между углами смачивания, отступления и Юнга». Langmuir. 20 (18): 7659–64. Дои:10.1021 / la049410h. PMID 15323516.
- ^ Шредер, Малкольм Э. (2002-05-01). «Возвращение к Юн-Дюпре». Langmuir. 11 (9): 3585–3589. Дои:10.1021 / la00009a049.
- ^ Афанас М. Дюпре, Поль Дюпре (1869-01-01). Теория mécanique de la chaleur (На французском). Готье-Виллар.
- ^ Клегг, Карл (2016). «Коэффициент растекания контактного угла». www.ramehart.com. ramé-hart. Получено 6 января 2016.
- ^ а б Джаспер, Уоррен Дж .; Расипурам, Шринивасан (декабрь 2017 г.). «Взаимосвязь между краевым углом и радиусом контактной линии для капель масла размером от микро до [от 10-6 до 10-18] литров». Журнал молекулярных жидкостей. 248: 920–926. Дои:10.1016 / j.molliq.2017.10.134. ISSN 0167-7322.
- ^ а б c Джаспер, Уоррен Дж .; Ананд, Надиш (май 2019 г.). «Обобщенный вариационный подход для прогнозирования краевых углов сидячих нанокапель как на плоских, так и на изогнутых поверхностях». Журнал молекулярных жидкостей. 281: 196–203. Дои:10.1016 / j.molliq.2019.02.039. ISSN 0167-7322.
- ^ Солнце, Сюэгуи (2017). «Молекулярно-динамическое моделирование поведения смачивания Li на W-поверхностях». Fusion Engineering и дизайн. 117: 188–193. Дои:10.1016 / j.fusengdes.2016.06.037.
- ^ Коста, Д. (2017). «Эффекты краевого смачивания носителей γ-Al2O3 и анатаз-TiO2 активными фазами MoS2 и CoMoS: исследование методом DFT». Журнал катализа. 246 (2): 325–334. Дои:10.1016 / j.jcat.2006.12.007.
- ^ Гидрофобность низкоиндексных плоскостей CeO2, Прикладная наука о поверхности, Elsevier, 2019, 478, стр.68-74. в архивах HAL выходит
- ^ Роберт Дж. Гуд (1992). «Краевой угол, смачивание и адгезия: критический обзор». Журнал адгезии и технологий. 6 (12): 1269–1302. Дои:10.1163 / 156856192X00629.
- ^ а б Ши, З .; и другие. (2018). «Гистерезис динамического краевого угла в жидкостных мостах». Коллоиды и поверхности A. 555: 365–371. arXiv:1712.04703. Дои:10.1016 / j.colsurfa.2018.07.004. S2CID 51916594.
- ^ Де Жен, П. Г. (1994). Программные интерфейсы. Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 978-0-521-56417-5.
- ^ а б c Авраам Мармур (2003). «Смачивание гидрофобных шероховатых поверхностей: быть неоднородным или не быть». Langmuir. 19 (20): 8343–8348. Дои:10.1021 / la0344682.
- ^ Чен, Сюэмэй; Ма, Жуйюань; Ли, Цзиньтао; Хао, Чунлей; Го, Вэй; Luk, B.L .; Ли, Шуай Ченг; Яо, Шухуай; Ван, Цзуанкай (2012). «Испарение капель на супергидрофобных поверхностях: шероховатость поверхности и влияние малых размеров капель» (PDF). Письма с физическими проверками. 109 (11): 116101(1–6). Bibcode:2012PhRvL.109k6101C. Дои:10.1103 / PhysRevLett.109.116101. PMID 23005650. S2CID 29794436. Архивировано из оригинал (PDF) на 2019-04-11.
- ^ Мармур, Авраам (1992) в Современный подход к смачиваемости: теория и приложения Шредер, Малькольм Э. и Лоеб, Джордж Нью-Йорк: Plenum Press
- ^ а б Whyman, G .; Бормашенко, Эдуард; Штейн, Тамир (2008). «Строгий вывод уравнений Юнга, Кэсси – Бакстера и Венцеля и анализ явления гистерезиса краевого угла». Письма по химической физике. 450 (4–6): 355–359. Bibcode:2008CPL ... 450..355 Вт. Дои:10.1016 / j.cplett.2007.11.033.
- ^ Бормашенко, Эдуард (05.08.2009). «Уравнения Юнга, Борувки – Неймана, Венцеля и Кэсси – Бакстера как условия трансверсальности для вариационной задачи смачивания». Коллоиды и поверхности A: физико-химические и технические аспекты. 345 (1): 163–165. Дои:10.1016 / j.colsurfa.2009.04.054. ISSN 0927-7757.
- ^ Бормашенко, Эдуард (17.01.2020). «Вариационная структура для определения краевых углов: общий термодинамический подход». Журнал адгезии и технологий. 34 (2): 219–230. Дои:10.1080/01694243.2019.1663030. ISSN 0169-4243. S2CID 203537637.
- ^ Бормашенко, Е. (2008). "Почему применимо уравнение Кэсси-Бакстера?". Коллоиды и поверхность A. 324 (1–3): 47–50. Дои:10.1016 / j.colsurfa.2008.03.025.
- ^ Lin, F .; Zhang, Y; Xi, J; Чжу, Y; Wang, N; Ся, Ф; Цзян, Л. (2008). «Эффект лепестка: супергидрофобное состояние с высокой адгезионной силой». Langmuir. 24 (8): 4114–4119. Дои:10.1021 / la703821h. PMID 18312016.
- ^ Muzammil, I .; Li, Y.P .; Li, X.Y .; Лей, М. (2018). «Зависящая от рабочего цикла химическая структура и смачиваемость сополимеров акриловой кислоты и октафторциклобутана, работающих в импульсном ВЧ-плазме». Прикладная наука о поверхности. 436: 411–418. Bibcode:2018ApSS..436..411M. Дои:10.1016 / j.apsusc.2017.11.261.
- ^ а б Ишино, Ц .; Окумура, К. (2008). «Смачивающие переходы на текстурированных гидрофильных поверхностях» (PDF). Европейский физический журнал. 25 (4): 415–424. Bibcode:2008EPJE ... 25..415I. Дои:10.1140 / epje / i2007-10308-у. PMID 18431542. S2CID 35973585. Архивировано из оригинал (PDF) на 2019-04-11.
- ^ Quere, D .; Тиле, Уве; Кере, Дэвид (2008). «Смачивание текстурированных поверхностей» (PDF). Коллоиды и поверхности A. 206 (1–3): 41–46. Дои:10.1016 / S0927-7757 (02) 00061-4.
- ^ Херт, Майкл; Шуберт, Дирк В. (2012). «Простой подход к динамике распространения полимерных жидкостей». Макромолекулярная химия и физика. 213 (6): 654–665. Дои:10.1002 / macp.201100631.
- ^ а б Ли, К. С .; Иванова, Н .; Старов, В. М .; Hilal, N .; Дучк, В. (2008). «Кинетика смачивания и растекания водными растворами ПАВ». Достижения в области коллоидов и интерфейсной науки. 144 (1–2): 54–65. Дои:10.1016 / j.cis.2008.08.005. PMID 18834966.
- ^ а б c d Пичниг, Р. (2016). «Полимеры с подвесными ферроценами». Обзоры химического общества. 45 (19): 5216–5231. Дои:10.1039 / C6CS00196C. PMID 27156979.
- ^ Коннелли, Н.Г .; Гейгер, В. Э. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии» (PDF). Химические обзоры. 96 (2): 877–910. Дои:10.1021 / cr940053x. PMID 11848774. Архивировано из оригинал (PDF) 22 января 2016 г.
- ^ Liu, W.-Y .; Xu, Q.-H .; Ма, Y.-X .; Liang, Y.-M .; Dong, N.-L .; Гуань, Д.-П. (2001). «Бессольвентный синтез производных ферроценилэтилена». Журнал металлоорганической химии. 625: 128–132. Дои:10.1016 / S0022-328X (00) 00927-X.
- ^ Elbert, J .; Gallei, M .; Rüttiger, C .; Brunsen, A .; Didzoleit, H .; Stühn, B .; Рехан, М. (2013). «Ферроценовые полимеры для переключаемой смачиваемости поверхности». Металлоорганические соединения. 32 (20): 5873–5878. Дои:10.1021 / om400468p.
- ^ Кемсли, Джиллиан (28 января 2013 г.). «Оксиды редкоземельных элементов по своей природе гидрофобны». Новости химии и машиностроения. 91 (4).
- ^ Фронзи, Марко; Ассади, М. Хусейн Н .; Hanaor, Dorian A.H .; Hanaor, Dorian A.H .; Гань, Исян (2019). «Теоретические сведения о гидрофобности CeO с низким индексом2 поверхности ». Прикладная наука о поверхности. 478: 68–74. arXiv:1902.02662. Bibcode:2019ApSS..478 ... 68F. Дои:10.1016 / j.apsusc.2019.01.208. S2CID 118895100.
- ^ Saini, C.P .; Бармен, А .; Das, D .; Satpati, B .; Bhattacharyya, S.R .; Kanjilal, D .; Пономарев, А .; Звягин, С .; Канжилал, А. (2017). «Роль кислородной вакансии в гидрофобном поведении TiO.2 Наностержни на пирамидах Si с химическим травлением ». Журнал физической химии C. 121: 278–283. Дои:10.1021 / acs.jpcc.6b08991.
дальнейшее чтение
- де Женн, Пьер-Жиль; Брошар-Вяр, Франсуаза; Quéré, Дэвид (2004). Капиллярность и явления смачивания. Springer Нью-Йорк. Дои:10.1007/978-0-387-21656-0. ISBN 978-1-4419-1833-8. S2CID 137894832.
- Виктор Михайлович Старов; Мануэль Г. Веларде; Клейтон Дж. Радке (2 апреля 2007 г.). Динамика смачивания и растекания. CRC Press. ISBN 978-1-4200-1617-8.
внешняя ссылка
- Что такое смачиваемость?
 СМИ, связанные с Смачивание в Wikimedia Commons
СМИ, связанные с Смачивание в Wikimedia Commons








![{ displaystyle x in I = [0, L]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d305c8663697c7ab89128c6c19f017d16b9addeb)

![{ displaystyle { cal {F}} [y, L] = int _ {0} ^ {L} left ( gamma _ {LG} { sqrt {1 + y '^ {2}}} + ( gamma _ {SL} - gamma _ {SG}) right) dx}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16a5fa77da20dd04965ce70d94455ca3080a11a3)














































![{ displaystyle r (t) = r_ {e} left [1- exp left (- left ({ frac {2 gamma _ {LG}} {r_ {e} ^ {12}}} + { frac { rho g} {9r_ {e} ^ {10}}} right) { frac {24 lambda V ^ {4} left (t + t_ {0} right)} { pi ^ {2} eta}} right) right] ^ { frac {1} {6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d55ffe285b1d3f0a6e3f3df3ec421df9276f5142)
![{ displaystyle r (t) = left [ left ( gamma _ {LG} { frac {96 lambda V ^ {4}} { pi ^ {2} eta}} left (t + t_ {0} right) right) ^ { frac {1} {2}} + left ({ frac { lambda (t + t_ {0})} { eta}} right) ^ { frac {2} {3}} { frac {24 rho gV ^ { frac {3} {8}}} {7 cdot 96 ^ { frac {1} {3}} pi ^ { frac {4} {3}} gamma _ {LG} ^ { frac {1} {3}}}} right] ^ { frac {1} {6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a916f6235ab045106b813b7dd4629ec7ffafbd4)

