WikiDer > Фосфат хрома (III)
 | |
| Имена | |
|---|---|
| Название ИЮПАК Фосфат хрома (III) | |
| Другие имена Фосфат хрома, монофосфат хрома, ортофосфат хрома, фосфат хрома | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.219 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| CrPO4 | |
| Молярная масса | 146,97 г / моль |
| Плотность | 4,236 г / см3[1] |
| Температура плавления | 1907 ° С (3465 ° F, 2180 К)[1] |
| Точка кипения | 2671 ° С (4840 ° F, 2944 К) |
| нерастворимый экзотермический синий раствор[1] | |
| Структура | |
| моноклинический[1] | |
| Опасности | |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 1 мг / м3[2] |
REL (Рекомендуемые) | TWA 0,5 мг / м3[2] |
IDLH (Непосредственная опасность) | 250 мг / м3[2] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фосфат хрома (III) описывает неорганические соединения с химическая формула CrPO4.(ЧАС2O)п, где n = 0, 4 или 6. Все твердые тела глубоко окрашены. Безводный CrPO4 зеленый. Гексагидрат CrPO4• 6H2О фиолетовый.
Синтез
Фосфат хрома получают путем обработки фосфорная кислота решение оксид хрома (VI) с гидразин.[3]
Гексагидратированный фосфат хрома (III)
Гексагидрат фосфат хрома, CrPO4• 6H2O получают восстановлением триоксида хрома CrO3, с этанолом в присутствии ортофосфорной кислоты, H3PO4, в диапазоне температур от −24 ° C до +80 ° C.[4]
Мезопористая фаза
Гелеобразный фосфат хрома (III) получают восстановлением дихромата аммония (NH4)2Cr2О7, используя этанол, CH3COOH и азотная кислота, HNO3. Этот процесс выполняется в присутствии дигидрофосфата аммония и мочевины при повышенной температуре, где бромид тетрадецилтриметиламмония (TTBr) используется в качестве агента, определяющего структуру.[5]
Фильмы
Приготовление текстурированного фосфата хрома осуществляется путем смешивания эквимолярных растворов водного нитрата хрома и диаммонийфосфата в чашке, помещенной в герметичную камеру, с низкотемпературным катализатором из паров аммиака, диффундирующим в раствор с постоянной скоростью. Через 24 часа образовавшаяся пурпурная пленка вырастает из жидкости в результате гидролиза и поликонденсации, происходящих в реакционной среде на границе воздух / жидкость и пленка / жидкость. Поверхностное натяжение делает пленку компактной, что позволяет легко вставить предметное стекло микроскопа и приподнять пленку из-под поверхности раствора. После получения раствор промывают деионизированной водой и этанолом, затем сушат в вакууме.[6]
Аморфная фаза
Получение безводного фосфата хрома (III) начинается с измельчения смеси 75% мол. Оксида хрома (III), Cr2О3, и 25 мол.% чистого гидрофосфата аммония, (NH4)2HPO4. Эта смесь прессуется в гранулы и нагревается под давлением воздуха при 400 ° C в течение 24 часов для удаления аммиака и воды. После этого происходит последовательность нагрева 450 ° C (24 часа), 700 ° C (3-24 часа), 800 ° C (24 часа) и 850 ° C (2-24 часа). После этого смесь гранул постепенно охлаждают.[7]
Физические свойства
Кристальная структура
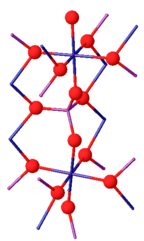
Фосфат хрома (III) может существовать в виде двух изоморфы. Его β-изоформа орторомбическая с См пространственная группа (a = 0,5165, b = 0,7750, c = 0,6131 нм). Структура состоит из бесконечных цепочек трансграничных CrO6 октаэдры, которые идут параллельно оси c и соединены PO4 тетраэдры. Выше 1175 ° C, β-CrPO4 превращается в α-CrPO4. α-CrPO4 также является ромбическим, с Имма пространственная группа (a = 1.0380, b = 1.2845, c = 0.6278 нм). Структура состоит из бесконечной сети связанных многогранников с октаэдром CrO6 и тетраэдром PO4, имеющим общее ребро. Cr3+ Сайты образуют пары Cr (2) / Cr (2 ') с общими ребрами и имеют два общих угла с четырьмя октаэдрами Cr (1).[8]
Магнитные свойства
Магнитные свойства β-CrPO4 являются результатом расстояний катион-катион вдоль октаэдрических цепочек, которые вызывают сильные прямые обменные взаимодействия и даже связи металл-металл. Нейтронографические исследования показывают, что спиральные моменты в β-CrPO4 коллинеарны и антиферромагнитно связаны вдоль цепочек в плоскостях 001 при низкой температуре (5K, µeff = 2.55µB).[8] Наблюдения при дифракционном исследовании показали, что при низкой температуре (2 К) α-CrPO4 октаэдры CrO6 единицы создают бесконечную трехмерную сеть, которая, как ожидается, обеспечит сильные магнитные сверхобменные связи Cr-O-Cr с обменным путем через фосфатную группу. Эти связи придают структуре антиферромагнитные характеристики (Ɵ = -35,1 K, µeff = 3,50 мкБ), что приводит к антипараллельным магнитным спинам в плоскости, перпендикулярной цепочкам октаэдрического CrO6.[9]
Химические свойства
Ионный обмен
При высокой температуре и pH в диапазоне 283-383K и pH 4-7 соответственно уравновешенный раствор KOH / HCl, нерастворимый CrPO4 твердый и водный раствор катионов дают реакцию сорбции. Исследования показывают, что CrPO4 катализирует адсорбцию двухвалентных катионов на своей аморфной поверхности по механизму катионного обмена. Механизм предполагает, что ионы H + высвобождаются из твердой фазы в водную, когда катионы гидролизуются и адсорбируются на поверхности катализатора. Таким образом, снижение pH реакции используется как прямой индикатор скорости адсорбции в реакции:
График уравнения Курбатова используется для связи высвобождения H+ иона к константе равновесия реакции:
где Kd (l g-1) представляет собой коэффициент распределения, а n - наклон прямой линии, указывающий на H+/ Мz + стехиометрия обменной реакции. В аналогичных условиях селективность CrPO4 для дативных катионов следует последовательность: Pb2+ > Cu2+ > Ni2+ ≅ CD2+. Повышение температуры и pH усиливает реакцию ионного обмена.[10]
Фосфат хрома (III) также используется для катионного обмена в реакциях сорбции. Этот катализ широко используется для снижения токсичности металлов во время очистки окружающей среды. Это было применено для уменьшения концентрации свинца в водной среде обитания и питьевой воде.[10]
Заявление
Антикоррозийное покрытие
Краски, содержащие фосфат хрома (III), используются в качестве антикоррозионных покрытий для металлов. Краски состоят из водного кислого раствора фосфата хрома (III), который превращается в плотную пленку при нанесении на металлы, широко используемые в производстве и быту, такие как цинк, цинковый сплав, алюминий и подложки из алюминиевого сплава. Способы нанесения включают гальваническое покрытие, погружение или распыление раствора на поверхность подложки.[11]
Катализатор
Фосфат хрома (III) находит различное применение в полимерной промышленности. Комбинированный фосфат алюминия хрома (III) широко используется в качестве катализатора при алкилировании ароматических углеводородов с использованием спиртов, например при метилировании толуола с использованием метанола. Спирт дегидратируется до простого эфира, в то время как алкилзамещенный продукт можно использовать в качестве промежуточного продукта при производстве синтетических волокон, таких как полиэтилентерефталат.[12]
Полимер
Предварительная обработка фосфат-силикатом хрома (III) также используется в качестве слоистой структуры для гашения вибрации и шума в двигателе.[13]
Токсичность
Хотя фосфат хрома (III) плохо растворяется в воде, чрезмерное воздействие этого соединения из окружающей среды, промышленного расположения и истирания металла на металлических имплантатах может иметь вредные последствия. Токсичность фосфата хрома (III) зависит от продолжительности воздействия, концентрации фосфата хрома (III), путей проникновения через мембранный барьер и высвобождения иона трехвалентного хрома из фосфата хрома (III). Клетки макрофагов в организме, подвергнутые воздействию фосфата хрома (III), поглощают или фагоцитируют соединение в его эндосомальную и лизосомальную среду, которая является кислой. Это катализирует протеолитическую реакцию, приводящую к дозозависимому увеличению высвобождения иона хрома (III) в пораженных клетках. Cr3+ ионы оказывают токсическое действие на белки цитозоля и митохондрий, окислительно изменяя их химические свойства, что лишает их возможности выполнять свои функции. Воздействуют на белки с высоким сродством к металлам, такие как энолаза, ферменты каталазы и гемоглобин, молекулярные переносчики ферритина. В конечном итоге это может привести к нефротоксичности, репродуктивной токсичности и токсичности для развития из-за повреждения тканей, некроза и воспаления.[14]
дальнейшее чтение
- Мустафа, С .; Муртаза, С .; Naeem, A .; Фарина, К. (2010). «Ионообменная сорбция ионов Pb2 + на CrPO4». Экологические технологии. 26 (4): 353–359. Дои:10.1080/09593332608618544. PMID 15906486.
Смотрите также
- Хром (III)
- Хром (IV)
- Фосфат алюминия
- Хромовая кислота
- Хромовые квасцы
- Хроматное конверсионное покрытие
внешняя ссылка
Рекомендации
- ^ а б c d Брауэр, Георг (1965) [1962]. Handbuch Der Präparativen Anorganischen Chemie [Справочник по препаративной неорганической химии] (на немецком). 2. Штутгарт; Нью-Йорк, Нью-Йорк: Фердинанд Энке Верлаг; Academic Press, Inc. стр. 1341. ISBN 978-0-32316129-9. Получено 2014-01-10.
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0141". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Ф. Хайн и С. Херцог (1963). «Ортофосфат хрома». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд.. 1. Нью-Йорк, Нью-Йорк: Academic Press. С. 1364–5.CS1 maint: использует параметр авторов (связь)
- ^ Васович, Душанка Д .; Стоякович, Джордже Р. (2003). «Получение и свойства некоторых аморфных фосфатов хрома (III)». Журнал некристаллических твердых тел. 101 (1): 129–132.
- ^ Тарафдар, А .; Biswas, S .; Праманик Н.К .; Праманик П. «Синтез мезопористого фосфата хрома нетрадиционным золь-гель методом». Микропористые и мезопористые материалы, 2006, 89, 1-3, стр 204-208.
- ^ Gomm, J.R .; Schwenzer B .; Морс Д.Э. «Текстурированные пленки фосфата хрома, синтезированные методом низкотемпературного пародиффузионного катализа». Науки о твердом теле, 2007, 9, 5, стр 429-431
- ^ Bosacka, M .; Jakubus, P .; Rychowska-Himmel, I. (2007). «Получение фосфатов хрома (III) (V) в твердом состоянии и их термическая стабильность». Журнал термического анализа и калориметрии. 88 (1): 133–137. Дои:10.1007 / s10973-006-8050-z.
- ^ а б Attfield, J.P; Battle, P.D; Энтони, К.С.; Джонсон, округ Колумбия (1988). «Магнитные структуры и свойства альфа-CrPO.4 и альфа-CrAsO ". Неорганическая химия. 28 (7): 1207–1213. Дои:10.1021 / ic00306a004.
- ^ Attfield, J.P; Battle, P.D; Энтони, К. «Спиральная магнитная структура ортофосфата β-хрома (III) (β-CrPO4)." Журнал химии твердого тела, 1985, 57, стр 357-361
- ^ а б Мустафа, С .; Муртаза, С .; Naeem, A .; Фарина, К. (2010). "Ионно-обменная сорбция Pb2+ Ионы на CrPO4". Экологические технологии. 26 (4): 353–359. Дои:10.1080/09593332608618544. PMID 15906486.
- ^ Ludwig, R .; Реккер, А. "Не содержащие хрома (VI) водные кислые растворы конверсии хрома (III)". US20070243397 A1, 2007. Columbia Chemical Corporation, Огайо, https://www.google.com/patents/US20070243397 (по состоянию на 12 апреля 2015 г.)
- ^ Джонсон, M.M .; Новак, Г. «Фосфат хрома как катализатор алкилирования». Патент США 4543436 A, 24 сентября 1985 г.https://www.google.com/patents/US4543436 (по состоянию на 12 апреля 2015 г.)
- ^ Swanson, R .; Hufnagel, A. "Многослойная вязкоупругая демпфирующая структура и способ ее изготовления". US 20090252989 A1, 8 октября 2009 г. https://www.google.com/patents/US20090252989?dq=Laminated+viscoelastic+damping+structure&hl=en&sa=X&ei=u3QqVd0mg6uiBLWzgVA&ved=0CB4Q6AEwAA (по состоянию на 12 апреля 2015 г.); SciFinder Scholar 2009: 20090252989 A1
- ^ Шарф, В .; Clement, C.C .; Zolla, V .; Перино, Г .; Ян, Б .; Elci, S.G .; Purdue, E .; Goldring, S .; Macaluso, F .; Cobelli, N; Vachet, R.W; Сантамброджо, Л. (2015). «Молекулярный анализ токсичности хрома и кобальта». Научные отчеты. 2014: 5729. Дои:10.1038 / srep05729. ЧВК 4103093. PMID 25034144.