WikiDer > Основной электрон
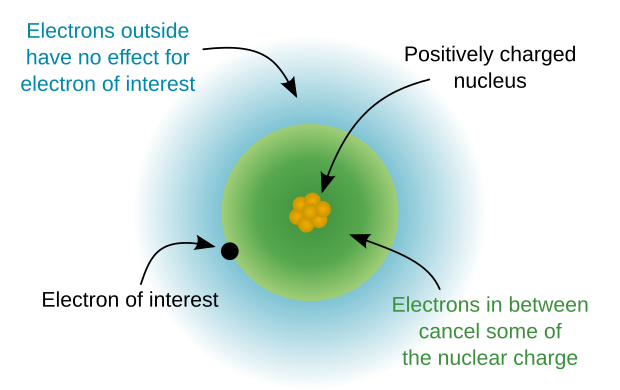
Основные электроны электроны в атом это не валентные электроны и не участвуйте в химическая связь.[1] Ядро и основные электроны атома образуют ядро атома. Электроны ядра прочно связаны с ядром. Следовательно, в отличие от валентных электронов, остовные электроны играют второстепенную роль в химических связях и реакциях, экранируя положительный заряд атомного ядра от валентных электронов.[2]
Число валентных электронов элемента можно определить по группа периодической таблицы элемента (см. валентный электрон):
- За элементы основной группычисло валентных электронов колеблется от 1 до 8 электронов (ns- и np-орбитали).
- За переходные металлы, количество валентных электронов колеблется от 3 до 12 электронов (ns и (n-1) d орбитали).
- За лантаноиды и актиниды, количество валентных электронов колеблется от 3 до 16 электронов (ns, (n-2) f и (n-1) d орбитали).
Все другие невалентные электроны атома этого элемента считаются остовными электронами.
Орбитальная теория
Более сложное объяснение разницы между остовными и валентными электронами можно описать с помощью теория атомной орбиты.
В атомах с одним электроном энергия орбитали определяется исключительно главным квантовым числом n. Орбиталь n = 1 имеет наименьшую возможную энергию в атоме. При больших n энергия возрастает настолько, что электрон может легко покинуть атом. В одноэлектронных атомах все уровни энергии с одним и тем же главным квантовым числом вырождены и имеют одинаковую энергию.
В атомах с более чем одним электроном энергия электрона зависит не только от свойств орбитали, на которой он находится, но и от его взаимодействия с другими электронами на других орбиталях. Это требует учета квантового числа l. Более высокие значения l связаны с более высокими значениями энергии; например, состояние 2p выше, чем состояние 2s. Когда l = 2, увеличение энергии орбитали становится достаточно большим, чтобы вытолкнуть энергию орбитали выше энергии s-орбитали в следующей более высокой оболочке; при l = 3 энергия проталкивается в оболочку на две ступени выше. Заполнение трехмерных орбиталей не происходит до тех пор, пока не будут заполнены 4s-орбитали.
Увеличение энергии подоболочек с увеличивающимся угловым моментом в более крупных атомах связано с эффектами электрон-электронного взаимодействия и, в частности, связано со способностью электронов с низким угловым моментом более эффективно проникать в ядро, где они менее экранированы. от заряда промежуточных электронов. Таким образом, в атомах с более высоким атомным номером l электронов становится все более и более определяющим фактором их энергии, а главные квантовые числа n электронов становятся все менее и менее важными в их энергетическом размещении. Энергетическая последовательность первых 35 подоболочек (например, 1s, 2s, 2p, 3s и т. Д.) Дана в следующей таблице [не показана?]. Каждая ячейка представляет собой подоболочку, где n и l задаются индексами строки и столбца соответственно. Число в ячейке - это позиция подоболочки в последовательности. См. Таблицу Менделеева ниже, организованную по подоболочкам.
Атомное ядро
Атомное ядро относится к атом без валентные электроны.[3]
Атомное ядро имеет положительный электрический заряд. Масса ядра почти равна массе атома. Атомное ядро с достаточной точностью можно считать сферически-симметричным. Радиус ядра как минимум в три раза меньше радиуса соответствующего атома (если рассчитать радиусы теми же методами). Для тяжелых атомов радиус ядра немного увеличивается с увеличением числа электронов. Радиус ядра самого тяжелого элемента природного происхождения - уран - сравним с радиусом атома лития, хотя у последнего всего три электрона.
Химические методы не могут отделить электроны ядра от атома. При ионизации пламенем или ультрафиолетовый радиации, ядра атомов, как правило, также остаются нетронутыми.
Релятивистские эффекты
Для элементов с высоким атомным номером Z релятивистские эффекты могут наблюдаться для остовных электронов. Скорости s-электронов ядра достигают релятивистского импульса, что приводит к сжатию 6s-орбиталей относительно 5d-орбиталей. Физические свойства, на которые влияют эти релятивистские эффекты, включают пониженную температуру плавления ртути и наблюдаемый золотистый цвет золото и цезий за счет сокращения энергетического зазора.[4] Золото кажется желтым, потому что оно поглощает синий свет больше, чем другие длины волн видимого света, и поэтому отражает обратно желтый свет.
Электронный переход
Остовный электрон может быть удален со своего остовного уровня после поглощения электромагнитного излучения. Это либо возбудит электрон к пустой валентной оболочке, либо заставит его испускаться как фотоэлектрон из-за фотоэлектрический эффект. Образовавшийся атом будет иметь пустое пространство в основной электронной оболочке, которое часто называют керн. Он находится в метастабильном состоянии и распадется в течение 10 секунд.−15 s, высвобождая избыточную энергию через Рентгеновская флуоресценция (как характеристический рентген) или Эффект оже.[5] Обнаружение энергии, испускаемой валентным электроном, падающим на орбиталь с более низкой энергией, дает полезную информацию об электронной и локальной решетчатой структуре материала. Хотя большую часть времени эта энергия выделяется в виде фотон, энергия также может быть передана другому электрону, который вылетает из атома. Этот второй выброшенный электрон называется оже-электроном, и этот процесс электронного перехода с непрямым излучением известен как Эффект оже.[6]
Каждый атом, кроме водорода, имеет электроны остовного уровня с четко определенной энергией связи. Следовательно, можно выбрать элемент для зондирования, настроив энергию рентгеновского излучения на соответствующий край поглощения. Спектры испускаемого излучения могут использоваться для определения элементного состава материала.
Смотрите также
- Атомная орбиталь
- Эффект оже
- Сокращение лантаноидов
- Релятивистская квантовая химия
- Эффект экранирования
- Сдвиг уровня ядра поверхности
- валентный электрон
Рекомендации
- ^ Рассолов, Виталий А; Попл, Джон А; Редферн, Пол С; Кертисс, Ларри А. (2001-12-28). «Определение остовных электронов». Письма по химической физике. 350 (5–6): 573–576. Bibcode:2001CPL ... 350..573R. Дои:10.1016 / S0009-2614 (01) 01345-8.
- ^ Мисслер, Тарр, Г.Л. (1999). Неорганическая химия. Прентис-Холл.
- ^ Харальд Ибах, Ханс Лют. Физика твердого тела: Введение в основы материаловедения. Springer Science & Business Media, 2009. P.135.
- ^ «Квантовый праймер». www.chem1.com. Получено 2015-12-11.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "шнековый эффект". Дои:10.1351 / goldbook.A00520
- ^ «Эффект Оже и другие безызлучательные переходы». Издательство Кембриджского университета. Получено 2015-12-11.