WikiDer > Азимутальное квантовое число

В азимутальное квантовое число это квантовое число для атомная орбиталь что определяет его орбитальный угловой момент и описывает форму орбиты. В азимутальный квантовое число - второе из набора квантовых чисел, которые описывают уникальное квантовое состояние электрона (остальные главное квантовое число, то магнитное квантовое число, а квантовое число спина). Он также известен как орбитальный угловой момент квантовое число, орбитальное квантовое число или же второе квантовое число, и обозначается как ℓ (произносится элл).
Вывод
С энергетическими состояниями электронов атома связаны четыре квантовых числа: п, ℓ, мℓ, и мs. Они определяют полное уникальное квантовое состояние отдельного электрон в атом, и составить его волновая функция или же орбитальный. При решении для получения волновой функции Уравнение Шредингера сводится к трем уравнениям, которые приводят к первым трем квантовым числам. Следовательно, все уравнения для первых трех квантовых чисел взаимосвязаны. Азимутальное квантовое число возникло при решении полярной части волнового уравнения, как показано ниже, в зависимости от сферическая система координат, что обычно лучше всего работает с моделями, имеющими некоторое представление о сферическая симметрия.
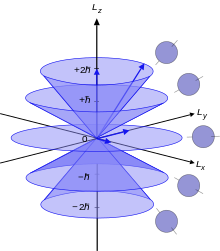
Атомный электрон угловой момент, L, связано с его квантовым числом ℓ по следующему уравнению:
куда час это приведенная постоянная Планка, L2 - оператор орбитального углового момента и - волновая функция электрона. Квантовое число ℓ всегда является целым неотрицательным числом: 0, 1, 2, 3 и т. д. L не имеет реального значения, кроме как в качестве оператор углового момента. Говоря об угловом моменте, лучше просто использовать квантовое число ℓ.
Атомные орбитали имеют отличительные формы, обозначенные буквами. На рисунке буквы s, п, и d (а соглашение, происходящее из спектроскопии) описывают форму атомная орбиталь.
Их волновые функции имеют вид сферические гармоники, и поэтому описываются Полиномы Лежандра. Различные орбитали, относящиеся к разным значениям ℓ иногда называют суб-оболочки, и обозначаются строчными буквами Латинские буквы (выбрано по историческим причинам) следующим образом:
Квантовые подоболочки для азимутального квантового числа. Азимутальный
номер (ℓ)Исторический
ПисьмоМаксимум
ЭлектроныИсторический
ИмяФорма 0 s 2 sарфа sферический 1 п 6 пглавный три в форме гантели пполярно-ориентированные орбитали; по одной доле на каждую поле осей x, y и z (оси + и -) 2 d 10 dпредохранитель 9 dзонтики и один doughnut (или «уникальная форма №1» см. это изображение сферических гармоник, центр третьего ряда) 3 ж 14 жнеобоснованный «Уникальная форма №2» (см. это изображение сферических гармоник, нижний ряд в центре) 4 грамм 18 5 час 22 6 я 26 Буквы после ж суб-оболочка просто следуйте буквеж в алфавитном порядке кроме буквыj и уже использованные.
Каждое из различных состояний углового момента может принимать 2 (2ℓ + 1) электроны. Это потому, что третье квантовое число мℓ (который можно условно назвать квантованный проекция вектора углового момента на ось z) проходит от -ℓ к ℓ в целочисленных единицах, поэтому есть 2ℓ + 1 возможных состояний. Каждый отдельный п, ℓ, мℓ орбиталь может быть занята двумя электронами с противоположными спинами (заданными квантовым числом мs = ± ½), что дает 2 (2ℓ + 1) электроны в целом. Орбитали с высшими ℓ значения, указанные в таблице, вполне допустимы, но эти значения охватывают все атомы, открытые на данный момент.
При заданном значении главное квантовое число п, возможные значения ℓ диапазон от 0 до п - 1; Следовательно п = 1 ракушка имеет только подоболочку s и может принимать только 2 электрона, п = 2 оболочка обладает s и п подоболочки и может принимать всего 8 электронов, п = 3 снаряда обладают s, п, и d подоболочки и имеет максимум 18 электронов и так далее.
А упрощенная одноэлектронная модель приводит к уровни энергии в зависимости только от основного числа. В более сложных атомах эти энергетические уровни расколоть для всех п > 1, помещая состояния высших ℓ выше состояний нижнего ℓ. Например, энергия 2p выше, чем 2s, 3d встречается выше 3p, что, в свою очередь, превышает 3s, и т. Д. Этот эффект в конечном итоге формируется блочная структура таблицы Менделеева. Ни один из известных атомов не обладает электроном, имеющим ℓ выше трех (ж) в своем основное состояние.
Квантовое число углового момента, ℓ, управляет[как?] количество плоских узлов, проходящих через ядро. Плоский узел в электромагнитной волне можно описать как среднюю точку между гребнем и впадиной, которая имеет нулевую величину. На s-орбитали никакие узлы не проходят через ядро, поэтому соответствующее азимутальное квантовое число ℓ принимает значение 0. В п орбитально, один узел пересекает ядро и, следовательно, ℓ имеет значение 1. имеет ценность .
В зависимости от стоимости п, существует квантовое число углового момента ℓ и следующая серия. Указанные длины волн предназначены для атом водорода:
- , Серия Лайман (ультрафиолет)
- , Серия Бальмера (видимый)
- , Серия Ритц – Пашен (ближний инфракрасный)
- , Brackett серии (коротковолновый инфракрасный)
- , Серия Pfund (средневолновый инфракрасный).
Сложение квантованных угловых моментов
Учитывая квантованный полный угловой момент который представляет собой сумму двух отдельных квантованных угловых моментов и ,
то квантовое число связанные с его величиной, может варьироваться от к в целочисленных шагах, где и являются квантовыми числами, соответствующими величине отдельных угловых моментов.
Полный угловой момент электрона в атоме

Из-за спин-орбитальное взаимодействие в атоме орбитальный угловой момент больше не ездит на работу с Гамильтониан, ни вращение. Поэтому они со временем меняются. Тем не менее полный угловой момент J коммутирует с одноэлектронным гамильтонианом и поэтому является постоянным. J определяется через
L будучи орбитальный угловой момент и S вращение. Полный угловой момент удовлетворяет тому же коммутационные соотношения как орбитальный угловой момент, а именно
из чего следует
куда Jя стоять за JИкс, Jу, и Jz.
Квантовые числа, описывающие систему, которые постоянны во времени, теперь j и мj, определяемый действием J по волновой функции
Так что j связана с нормой полного углового момента и мj к его проекции на заданную ось. В j число имеет особое значение для релятивистская квантовая химия, часто указывается в нижнем индексе в электронная конфигурация сверхтяжелых элементов.
Как и любой угловой момент в квантовой механике, проекция J по другим осям не могут быть определены вместе с Jz, потому что они не ездят на работу.
Связь между новыми и старыми квантовыми числами
j и мjвместе с паритет из квантовое состояние, замените три квантовые числа ℓ, мℓ и мs (проекция вращение по указанной оси). Первые квантовые числа могут быть связаны со вторыми.
Кроме того, собственные векторы из j, s, мj и паритет, которые также собственные векторы из Гамильтониан, являются линейными комбинациями собственные векторы из ℓ, s, мℓ и мs.
Список квантовых чисел углового момента
- Квантовое число собственного (или спинового) углового момента, или просто квантовое число спина
- квантовое число орбитального углового момента (тема данной статьи)
- магнитное квантовое число, связанный с квантовым числом орбитального момента
- квантовое число полного углового момента
История
Азимутальное квантовое число было перенесено из Боровская модель атома, и был утвержден Арнольд Зоммерфельд.[1] Модель Бора была получена из спектроскопический анализ атома в сочетании с Резерфорд атомная модель. Было обнаружено, что самый нижний квантовый уровень имеет нулевой угловой момент. Орбиты с нулевым угловым моментом рассматривались как колеблющиеся заряды в одном измерении и поэтому описывались как «маятниковые» орбиты, но не были обнаружены в природе.[2] В трехмерном пространстве орбиты становятся сферическими без каких-либо узлы пересекает ядро, подобно (в состоянии с наименьшей энергией) скакалке, которая колеблется в одном большом круге.
Смотрите также
- Оператор углового момента
- Введение в квантовую механику
- Частица в сферически-симметричном потенциале
- Связь по угловому моменту
- Коэффициенты Клебша – Гордана
Рекомендации
- ^ Айсберг, Роберт (1974). Квантовая физика атомов, молекул, твердых тел, ядер и частиц. Нью-Йорк: John Wiley & Sons Inc., стр. 114–117. ISBN 978-0-471-23464-7.
- ^ Р. Б. Линдси (1927). «Замечание об« маятниковых »орбитах в моделях атома». Proc. Natl. Акад. Наука. 13 (6): 413–419. Bibcode:1927ПНАС ... 13..413Л. Дои:10.1073 / pnas.13.6.413. ЧВК 1085028. PMID 16587189.




















![[J_i, J_j] = i hbar epsilon_ {ijk} J_k](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c774fd99fb91eb8937cbaaa6b6af2eaf88e7ad6)
![left [J_i, J ^ 2 right] = 0](https://wikimedia.org/api/rest_v1/media/math/render/svg/df773fc4aa955999fbf21070fb2d56ae4252b0ef)

