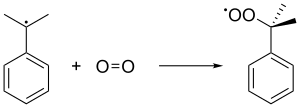WikiDer > Куменский процесс
В кумольный процесс (кумол-фенольный процесс, Скакательный отросток) является производственный процесс для синтеза фенол и ацетон из бензол и пропилен. Термин происходит от кумол (изопропилбензол), промежуточный материал в процессе. Его изобрели Р. Эдрис и П. Сергеев в 1942 году (СССР).[1], и независимо Генрихом Хоком в 1944 г.[2][3]
Этот процесс превращает два относительно дешевых исходных материала: бензол и пропилен, на два более ценных, фенол и ацетон. Другие требуемые реагенты: кислород из воздуха и небольших количеств радикальный инициатор. Большая часть мирового производства фенола и ацетон теперь основан на этом методе. В 2003 году с помощью кумольного процесса было произведено около 7 миллионов тонн фенола.[4] Чтобы этот процесс был экономичным, также должен быть спрос на ацетон побочный продукт, а также фенол.[5]
Этапы процесса
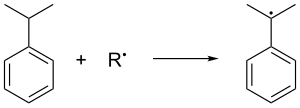
Кумол образуется в газовой фазе. Алкилирование Фриделя – Крафтса бензола пропиленом. Бензол и пропилен сжимаются вместе до давления 30 стандартные атмосферы при 250 ° C в присутствии каталитический Кислота Льюиса. Фосфорная кислота часто предпочитают алюминий галогениды. Кумол окисляется на воздухе, который удаляет третичные бензиловый водород из кумола и, следовательно, образует кумол радикальный:
Кумоловый радикал тогда облигации с молекулой кислорода, чтобы дать кумол перекись радикал, который, в свою очередь, образует гидропероксид кумола (C6ЧАС5C (CH3)2О2H) путем отщепления бензилового водорода от другой молекулы кумола. Этот последний кумол превращается в кумольный радикал и возвращается в последующие цепные образования гидропероксидов кумола. Давление 5 банкомат используется для обеспечения того, чтобы нестабильная перекись оставалась в жидком состоянии.
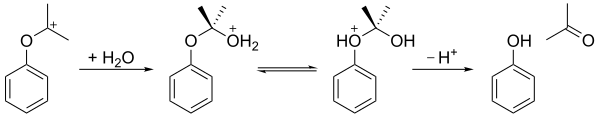
Гидропероксид кумола тогда гидролизованный в кислый средний ( Перестройка скакательного сустава) давать фенол и ацетон. На первом этапе протонируется концевой гидроперокси-атом кислорода. За этим следует стадия, на которой фенильная группа мигрирует от бензильного углерода к соседнему кислороду, и молекула воды теряется, производя резонанс стабилизированный третичный карбокатион. Согласованный механизм этого шага аналогичен механизмам Окисление Байера-Виллигера[6] а также стадия окисления гидроборирование-окисление.[7]В 2009 году закисленная бентонит Глина оказалась более экономичным катализатором, чем серная кислота в качестве кислотной среды.
Как показано ниже, в результате карбокатион затем подвергается атаке водой, протон затем переносится от гидрокси-кислорода к эфирному кислороду, и, наконец, ион распадается на фенол и ацетон.
Альтернативы совместному производству ацетона
Циклогексилбензол может заменить изопропилбензол. В результате перегруппировки Хока гидропероксид циклогексилбензола расщепляется с образованием фенола и циклогексанон. Циклогексанон является важным предшественником некоторых нейлон.[8]
Начиная с алкилирования бензола смесью 1 и 2-бутены, процесс кумола производит фенол и бутаноны.[5]
Альтернативы производству фенола
- Гидрохинон получают диалкилированием бензола пропеном с получением 1,4-диизопропилбензол. Это соединение реагирует с воздухом с образованием бис (гидропероксида). Аналогично поведению гидропероксид кумола, он перестраивается в кислоте, чтобы дать ацетон и гидрохинон. Окисление гидрохинона дает 1,4-бензохинон:[9]
- C6ЧАС4(CHMe2)2 + 2,5 O2 → С6ЧАС4О2 + 2 OCMe2 + H2О
- Резорцин аналогично готовится преобразованием 1,3-диизопропилбензол в бис (гидропероксид), который фрагментируется до резорцина и ацетона.[10]
- 2-нафтол также может быть произведено способом, аналогичным кумольному процессу.[11]
- 3-хлорфенол, который не возникает при хлорировании фенола, может быть получен с помощью кумольного процесса, начиная с алкилирования хлорбензола пропиленом.[12]
Обработка ацетона
Неочищенный ацетон гидрируют в жидкой фазе над Никель Ренея или смесь оксида меди и хрома для получения изопропиловый спирт. Этот процесс полезен, когда он сопровождается избыточным производством ацетона.[13][1]
Mitsui & Co. разработаны дополнительные шаги для гидрогенизация продукт ацетон и обезвоживание в изопропанол продукт в пропен, который повторно используется в качестве исходного реагента.[5]
Смотрите также
- Бисфенол А
- Процесс Доу
- Алкилирование Friedel Crafts
- Окисление Байера-Виллигера
- Процесс Рашига – Хукера (также производит фенол)
Рекомендации
- ^ http://izgudrojumi.lza.lv/izg_en.php?id=54
- ^ Хок Х. и Ланг С. (1944), Autoxydation von Kohlenwasserstoffen, IX. Mitteil .: Über Peroxyde von Benzol-Derivaten. Berichte der deutschen chemischen Gesellschaft (Серии A и B), 77: 257–264 Дои:10.1002 / cber.19440770321
- ^ Краткая энциклопедия химии (1993) Мэри Иглесо
- ^ Манфред Вебер, Маркус Вебер, Майкл Кляйне-Бойманн «Фенол» в Энциклопедии промышленной химии Ульмана 2004, Wiley-VCH. Дои:10.1002 / 14356007.a19_299.pub2.
- ^ а б c «Прямые пути к Фенолу». Архивировано из оригинал на 2007-04-09. Получено 2006-12-26.
- ^ Streitwieser, A; Хиткок, К. (1992). "30". Введение в органическую химию. Косовер, Э.М. (4-е изд.). Нью-Йорк: Макмиллан. стр.1018. ISBN 0-02-418170-6.
- ^ K.P.C., Vollhardt; N.E. Schore (2003). "22". Органическая химия: структура и функции (4-е изд.). Нью-Йорк: Фриман. п. 988. ISBN 0-7167-4374-4.
- ^ Плоткин, Джеффри С. (21 марта 2016 г.). "Что нового в производстве фенолов?". Американское химическое общество. Архивировано из оригинал на 2019-10-27. Получено 2018-01-02.
- ^ Герхард Франц, Роджер А. Шелдон «Окисление» в Энциклопедия промышленной химии Ульмана, Wiley-VCH, Weinheim, 2000 г. Дои:10.1002 / 14356007.a18_261
- ^ К. В. Шмидель, Д. Деккер (2012). «Резорцин». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a23_111.pub2.CS1 maint: использует параметр авторов (связь)
- ^ Джеральд Бут «Производные нафталина» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a17_009.
- ^ Франсуа Мюллер, Лилиан Кайяр (2011). «Хлорфенолы». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a07_001.pub2.CS1 maint: использует параметр авторов (связь)
- ^ Папа, А. Дж. "Пропанолс". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_173.
внешняя ссылка
| Викискладе есть медиафайлы по теме Куменский процесс. |