WikiDer > DIOP - Википедия
 | |
| Имена | |
|---|---|
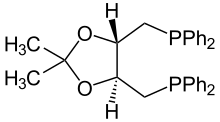
| Название ИЮПАК О-Изопропилиден-2,3-дигидрокси-1,4-бис (дифенилфосфино) бутан | |
| Другие имена (−)-2,3-О-Изопропилиден-2,3-дигидрокси-1,4-бис (дифенилфосфино) бутан (-) - 1,4-Бис (дифенилфосфино) -1,4-дидезокси-2,3-О-изопропилиден-L-треитол | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ChemSpider |
|
| ECHA InfoCard | 100.046.334 |
PubChem CID |
|
| UNII |
|
| |
| |
| Характеристики | |
| C31ЧАС32О2п2 | |
| Молярная масса | 498.543 г · моль−1 |
| Внешность | Белое твердое вещество |
| Температура плавления | От 86 до 89 ° C (от 187 до 192 ° F, от 359 до 362 K) |
| Нерастворимый | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
ДИОП (2,3-О-изопропилиден-2,3-дигидрокси-1,4-бис (дифенилфосфино) бутан) представляет собой фосфорорганическое соединение который используется как хиральный лиганд в асимметричный катализ. Это белое твердое вещество, растворимое в органических растворителях.
ДИОП готовят из ацетонид из д, л-Винная кислота, которая уменьшается до установки PPh2 заместители.
Использовать
Лиганд DIOP связывается с металлами через конформационно гибкий семичленный C4п2M хелатное кольцо.[1][2]
DIOP исторически важен в разработке лигандов для использования в асимметричный катализ, атомно-экономичный метод получения хиральных соединений. Описанный в 1971 году, это был первый образец C2-симметричный дифосфин.[3] Его комплексы применялись для восстановления прохиральных олефинов, кетонов и имины. Ноулз и другие. независимо сообщили о родственном C2-симметричный дифосфин ДИПАМП.[1]
С момента открытия DIOP было введено много аналогов DIOP. Эти производные DIOP включают MOD-DIOP, Cy-DIOP, DIPAMP и DBP-DIOP. Из многих производных DBP-DIOP демонстрирует хорошие регио- и энантиоселективность в гидроформилирование из бутены и стирол. DIOP был первым хиральным лигандом, использованным в катализируемом платиной-оловом гидроформилировании. На реактивность, химио- и энантиоселективность DIOP влияют CO и H2 давление и полярность растворителей. Наилучшие результаты при асимметричном гидроформилировании достигаются в растворителях со средней полярностью: бензоле и толуоле.[2]
Рекомендации
- ^ а б Shang, G .; Li, W .; Чжан, X. (2010). "Гомогенное асимметричное гидрирование, катализируемое переходными металлами". В Ивао Одзима (ред.). Каталитический асимметричный синтез (3-е изд.). Нью-Йорк: Джон Вили и сыновья. С. 343–436.
- ^ а б Agbossou, F .; Carpentier, J .; Мортре, А. (1995). «Асимметричное гидроформилирование». Chem. Rev. 95 (7): 2485–2806. Дои:10.1021 / cr00039a008.
- ^ Dang, T. P .; Каган, Х. Б. (1971). «Асимметричный синтез гидратроповой кислоты и аминокислот путем гомогенного каталитического гидрирования». Журнал химического общества D: Химические коммуникации (10): 481. Дои:10.1039 / C29710000481.