WikiDer > Перекись диэтилового эфира - Википедия
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| C4ЧАС10О3 | |
| Молярная масса | 106.121 г · моль−1 |
| Внешность | бесцветная жидкость |
| Плотность | 1,005 г / см3 |
| Точка кипения | От 62 до 64 ° C (от 144 до 147 ° F; от 335 до 337 K) при 18,7 гПа (пониженное давление) |
| Опасности | |
| Главный опасности | Взрывной |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
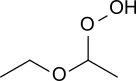
Гидропероксид диэтилового эфира это органическое соединение с формулой C2ЧАС5OCH (OOH) CH3. Это бесцветная жидкость, пригодная для перегонки. Гидропероксид диэтилового эфира и продукты его конденсации обвиняются во взрывчатке. органические пероксиды которые медленно образуются при воздействии диэтиловый эфир к окружающему воздуху и температурному режиму.[1][2]
Синтез и реакции
Гидропероксид диэтилового эфира может быть образован фотооксигенация диэтилового эфира. Это радикальный процесс, обусловленный возбуждением молекулярного кислорода ультрафиолетом в более реактивную форму. Его образование обычно нежелательно из-за риска взрыва. По этой причине коммерческие образцы диэтилового эфира обычно содержат антиоксиданты Такие как BHT и содержаться в материале, способном блокировать УФ-лучи, таком как янтарное стекло.
Его можно целенаправленно получить с высоким выходом путем кислотно-катализируемого добавления пероксид водорода к этилвиниловый эфир:[1]
- C2ЧАС5ОСН = СН2 + H2О2 → С2ЧАС5OCH (OOH) CH3
Аналогичным образом могут быть получены родственные гидропероксиды.
Гидропероксид диэтилового эфира при нагревании в воде разлагается до ацетальдегид:
- C2ЧАС5OCH (OOH) CH3 → CH3CHO + C2ЧАС5ОН + Н2О2 →
Гидропероксид диэтилового эфира образует полимеры, известные как пероксид диэтилового эфира, или же этилиден пероксид:
Перекись - это бесцветное масло, чрезвычайно бризантный и трение чувствительный взрывчатый материалОднако полимерные материалы твердые, что делает их более опасными, поскольку испарение летучего диэтилового эфира может оставлять тонкие пленки чистого взрывчатого вещества.
Тесты
Пероксиды диэтилового эфира можно обнаружить с помощью йодистый калий (KI) раствор в уксусной кислоте или йодистый калий / крахмал бумага. Положительный результат теста на образование йод (Я2), что вызывает желтый или коричневый цвет эфирной фазы или темно-синее пятно на бумажной полоске.[3]
Рекомендации
- ^ а б . Дои:10.1021 / ja01638a012. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ А. Риче, Р. Майстер (1936). "Modellversuche zur Autoxidation der Äther". Angewandte Chemie (на немецком). 49 (5): 106.
- ^ «Растворители, образующие пероксид». Сигма-Олдрич. Получено 2014-07-09.


