WikiDer > Плита пола
Эта статья нужны дополнительные цитаты для проверка. (Декабрь 2009 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Плита пола | |
|---|---|
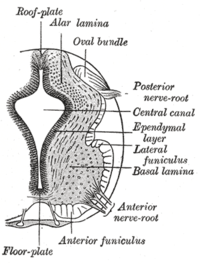 Плита пола разделяет левую и правую базальные пластины развивающихся нервная трубка. | |
| Подробности | |
| Предшественник | Нотохорд |
| Система | Нервная система |
| Анатомическая терминология | |
В плита пола является составной частью развивающейся нервная система позвоночных организмов. Расположен на вентральной средней линии эмбрионального нервная трубкапластина дна представляет собой специализированную глиальную структуру, которая охватывает переднезаднюю ось от среднего мозга до хвостовых областей. Было показано, что пластина дна сохраняется у позвоночных, таких как рыбки данио и мыши, с гомологичными структурами у беспозвоночных, таких как плодовая мушка. Дрозофила и нематода C. elegans. Функционально структура служит организатором для вентрализации тканей эмбриона, а также для управления позиционированием и дифференцировкой нейронов вдоль дорсовентральной оси нервной трубки.[1][2][3]
Индукция
Индукция пластинки дна во время эмбриогенеза эмбрионов позвоночных широко изучалась у кур и рыбок данио и происходит в результате сложной сигнальной сети между тканями, детали которой еще предстоит полностью уточнить. В настоящее время существует несколько конкурирующих взглядов. Во-первых, дифференцировка дна пластинки может быть опосредована индуктивной передачей сигналов от нижележащей нотохорда, осевой мезодерма производная сигнальная структура. Это подтверждается экспериментально на цыплятах, у которых индукция пластинки дна, а также ассоциативная дифференцировка вентральной нервной ткани опосредуются секретируемой сигнальной молекулой. звуковой еж (Тсс). Shh выражается в градиенте с наибольшей концентрацией, локализованной в хорде и пластине дна. В пробирке эксперименты по трансплантации ткани показывают, что удаление этой молекулы предотвращает дифференцировку пластинки дна, тогда как ее эктопическая экспрессия индуцирует дифференцировку клеток пластинки дна.[4] Альтернативная точка зрения предполагает, что клетки пластинки дна нервной трубки происходят из клеток-предшественников, которые мигрируют непосредственно из осевой мезодермы. В результате экспериментов с гибридом цыпленка и перепела, а также экспериментов по генетическому взаимодействию на рыбках данио выяснилось, что клетки хорды и дна происходят от общего предшественника. Кроме того, у рыбок данио Узловая сигнализация необходим для дифференцировки клеток медиальной пластинки дна, тогда как Shh расходуется. Эти данные могут указывать на то, что механизм индукции пластины дна у амниот и анамниот отличается.[5] Чтобы согласовать эти различия, на цыплятах была предложена двухрежимная индукционная модель. В этой модели исключительно эктодермальные клетки становятся медиальной пластинкой дна во время гаструляция посредством прехордальной мезодермы, возможно, посредством передачи сигналов Nodal. Позже в разработке во время нейруляция, расширенный контакт и взаимодействие между хордой и обреченными клетками пластинки дна вызывает дифференцировку, подтверждая кооперативный эффект между передачей сигналов Nodal и Shh.[6]
Аксонное руководство
В развитии центральной нервной системы решающее значение имеет решение нейрона пересекать или не пересекать среднюю линию. У позвоночных этот выбор опосредован пластиной дна и позволяет эмбриону успешно развить левую и правую половины тела по отношению к нервной ткани. Например, в то время как ипсилатеральные нейроны не пересекают среднюю линию, комиссуральные нейроны пересекают среднюю линию, образуя единую комиссуру. Эти конкретные нейроны развиваются в дорсальной области нервной трубки и перемещаются вентрально к пластине пола. Достигнув пластинки пола, комиссуральные нейроны пересекают структуру и появляются на противоположной стороне нервной трубки, после чего они проецируются вперед или назад внутри трубки.[7]

- Нетрины: Нетрины белки, экспрессируемые и секретируемые клетками пластинки пола. Эксперименты с экстрактами пластин пола и комиссуральными нейронами, встроенными в матрицу коллектора, показывают притяжение нейронов к пластине пола. in vitro.[8] Более того, выделение и трансфекция двух секретируемых белков нетрина-1 и нетрина-2 в клетки Cos имеют сходные эффекты.[9] Дальнейшие исследования подтвердили, что Netrins действуют как аттрактантные белки в дополнение к Shh, направляя комиссуральные аксоны к пластине пола.[10] Нетрины секретируются клетками пластинки дна и действуют, связывая рецептор аксона DCC хемотаксическим образом.
- Щель: Щель представляет собой секретируемый лиганд, экспрессируемый в пластинке дна, и его функция заключается в ингибировании прохождения аксонов нервной трубки. В то время как нетрины привлекают комиссуральные нейроны к средней линии, щелевые белки отталкиваются и вытесняют нейроны из средней линии. Поскольку аксоны, не предназначенные для пересечения средней линии, проходят через нервную трубку, они отталкиваются лигандной щелью, которая экспрессируется в клетках пластинки дна. Slit действует через свои рецепторы Roundabout (Robo) 1 и 2. Это взаимодействие ингибирует хемотаксис, обеспечиваемый путем Netrin / DCC. Однако Robo-3 (Rig-1) активируется во время роста комиссуральных аксонов во время миграции к пластине дна, которая изолирует Robo-1/2 внутри клетки внутри пузырьков. Следовательно, путь притяжения Нетрин / DCC доминирует над Путь отталкивания Slit / Robo и аксон может расти к средней линии и входить в пластину пола. При входе через механизм, еще не полностью изученный, Робо-3 становится подавленным, и это высвобождает и активирует Робо-1/2, эффективно отталкивая нейрон от средней линии пластинки пола. Благодаря этому сложному перекрестному взаимодействию Slit, Robo-1/2 и Robo-3 комиссуральные аксоны направляются к средней линии, чтобы пересечь нервную трубку и не могут пересечься обратно.[11]
Сигнальные молекулы, управляющие ростом и проекциями комиссуральных нейронов, хорошо изучены гомологами у беспозвоночных. В пути хемоаттракции Netrin / DCC гомологами C. elegans являются Unc-6 / Unc-40 и Unc-5, тогда как гомологами дрозофилы являются Netrin-A и Netrin-B / Frazzled и Dunc5. в Щелевой / Робо-хеморепелантный путь гомологами C. elegans являются Slt-1 / Sax-3, тогда как гомологами Drosophila также известны как Slit / Robo (1-3).[7]
Глиальный картирование судьбы
В центральной нервной системе (ЦНС) общее картирование судеб клеток обычно направляется сигнальным путем морфогена sonic hedgehog (Shh). В спинном мозге Shh направляется как хордой, так и областями дна пластинки, что в конечном итоге управляет организацией популяций нейральных и глиальных предшественников. Конкретные глиальные популяции, на которые влияет Shh в этих двух регионах, включают: клетки-предшественники олигодендроцитов (OPC), олигодендроциты, Клетки NG2 +, микроглия, и астроциты.[12] Область дна спинного мозга (FP) индивидуально способствует глиогенез, или образование глиальных клеток. Традиционно клетки-предшественники переходят из фазы размножения их предшественников в нейрогенную фазу и, в конечном итоге, в глиогенную фазу. Из глиогенной фазы бывшие клетки-предшественники могут затем стать астроцитами, олигодендроцитами или другими более специализированными типами глиальных клеток. Недавно были предприняты попытки использовать условный мутагенез для селективной инактивации пути Shh, особенно в области FP, чтобы идентифицировать различные роли молекул, участвующих в судьбе клеток олигодендроцитов. Олигодендроциты - это клетки, ответственные за миелинизирующие аксоны в ЦНС.
Шш регулирует Gli обработка через два белка, Птч1 и Smo.[13] Когда Shh не активен, Ptch1 отвечает за подавление пути посредством ингибирования Smo. Smo имеет решающее значение для общей передачи сигнала пути Shh. Если Smo подавляется, путь Shh также неактивен, что в конечном итоге подавляет глиогенез. Для судьбы клеток олигодендроцитов необходимы специфические факторы, такие как Gli3. Поскольку Shh регулирует процессинг Gli, если Smo нарушается или ингибируется с помощью Ptch1, это инактивирует путь Shh и предотвращает процессинг Gli, который нарушает картирование судеб глиальных клеток. Передача сигналов Shh в области FP очень важна, потому что она должна быть активной для того, чтобы происходил глиогенез. Если Shh инактивирован в области FP и активирован в других областях спинного мозга, таких как Dbx или домены pMN, нарушается глиогенез. Но когда Shh активен в области FP, глиогенез активируется, и глиальные клетки начинают мигрировать к своим целевым пунктам для функционирования.
Травма спинного мозга и регенерация аксонов
Область пластинки пола помогает в ведении аксонов, картировании глиальной судьбы и эмбриогенез. Если эта область спинного мозга будет повреждена, могут возникнуть серьезные осложнения для всех функций этой области, а именно ограниченная пролиферация и производство глиальных клеток, ответственных за миелинизацию и фагоцитоз в ЦНС. Травма спинного мозга (ТСМ) также чаще всего приводит к денудации или отрыву аксонов. Передача сигналов Wnt является обычным сигнальным путем, участвующим в случаях травм. Передача сигналов Wnt регулирует регенерацию после травмы спинного мозга. Сразу после травмы экспрессия Wnt резко возрастает.[14] Управление аксонами осуществляется Netrin-1[8] в области FP спинного мозга. Во время травм, особенно в случаях отрыва аксона, передача сигналов Wnt активируется, и аксоны начинают инициировать регенерацию, а аксоны регулируются через области FP с использованием путей передачи сигналов Shh и Wnt.
Эпендимные клетки спинного мозга также находятся в области FP спинного мозга. Эти клетки представляют собой популяцию нервных стволовых клеток, ответственных за репопуляцию потерянных клеток во время повреждения. Эти клетки обладают способностью дифференцироваться в популяции предшественников глии. Во время травмы фактор под названием Ахирин секретируется в области FP. Во время развития спинного мозга Ахирин экспрессируется исключительно на эпендимных стволовых клетках со скрытыми свойствами стволовых клеток и играет ключевую роль в развитии спинного мозга. В отсутствие Ахирина стволовость этих эпендимных клеток не регулируется.[15] Повреждение нарушает экспрессию и регуляцию Ахирина, и клетки области FP не могут быть должным образом восстановлены популяциями эпендимных стволовых клеток.
Рекомендации
- ^ «Вольперт, Льюис. Принципы развития: 3-е издание. Oxford University Press, 2007».
- ^ "Гилберт, Скотт Ф. Принципы развития: 8-е издание. Sinauer Associates, Inc. 2006."
- ^ "Джессел, Томас М. Спецификация нейронов в спинном мозге: индуктивные сигналы и транскрипционные коды. Nature Reviews Genetics. Октябрь 2000 г. (1)"
- ^ "Ямада, Т. Контроль клеточного паттерна в развивающейся нервной системе: поляризационная активность дна и хорды. Cell, Vol. 64, 635-647, 8 февраля 1991 г."
- ^ "Strahle, Uwe, et al. Спецификация дна позвоночных: вариации на общие темы. Тенденции в генетике, том 20, № 3, март 2004"
- ^ «Паттен, Иэн и др. Определенные способы индукции дна у куриного эмбриона. 19 июня 2003 г. Разработка 130, 4809-4821»
- ^ а б «Гуань К.Л. и Рао Ю. Сигнальные механизмы, опосредующие нейронные ответы на управляющие сигналы. Nat Rev Neurosci. 2003 Dec; 4 (12): 941-56».
- ^ а б "Серафини, Тито и др. Нетрины определяют семейство белков, способствующих росту аксонов, гомологичных C. elegans UNC-6. Cell, Vol. 79, 409-424. 12 августа 1994 г."
- ^ "Kennedy, Timothy E, et al. Нетрины являются диффузными хемотропными факторами для комиссуральных аксонов в эмбриональном спинном мозге. Cell, Vol. 79, 425-435, 12 августа 1994 г."
- ^ «Чаррон, Ф. и др. Морфоген sonic hedgehog - аксональный хемоаттрактант, который взаимодействует с нетрином-1 в ведении аксонов по средней линии. Cell. 2003 Apr 4; 113 (1): 11-23».
- ^ "Long, Hua et al. Консервативные роли белков Slit и Robo в наведении аксонов средней линии. Neuron, Vol. 42, 213–223, 22 апреля 2004 г."
- ^ Ю, Кванха; МакГлинн, Шон; Матис, Майкл П. (2013-04-01). «Звуковой еж, полученный из донной пластины, регулирует судьбу глиальных и эпендимных клеток в развивающемся спинном мозге». Разработка. 140 (7): 1594–1604. Дои:10.1242 / dev.090845. ISSN 0950-1991. ЧВК 3596997. PMID 23482494.
- ^ Бай, К. Брайан; Ауэрбах, Войтек; Ли, Джун С .; Стивен, Дэниел; Джойнер, Александра Л. (октябрь 2002 г.). «Gli2, но не Gli1, необходим для начальной передачи сигналов Shh и эктопической активации пути Shh». Разработка. 129 (20): 4753–4761. ISSN 0950-1991. PMID 12361967.
- ^ Цзоу, Иминь (2015). «Передача сигналов Wnt при травме спинного мозга». Передача сигналов Wnt при травме спинного мозга - Нервная регенерация - Глава 15. С. 237–244. Дои:10.1016 / B978-0-12-801732-6.00015-X. ISBN 9780128017326.
- ^ Абдулхалим М., Фелембан Атари; Сун, Сяохун; Кавано, Рие; Уэзоно, Наохиро; Ито, Аяко; Ахмед, Гиасуддин; Хоссейн, Махмуд; Накашима, Киничи; Танака, Хидеаки (01.05.2015). «Ахирин регулирует пролиферацию и дифференцировку нервных стволовых клеток в интактном и поврежденном спинном мозге мыши». Нейробиология развития. 75 (5): 494–504. Дои:10.1002 / dneu.22238. ISSN 1932-846X. PMID 25331329.