WikiDer > Гауссова сетевая модель

В Гауссовская сетевая модель (GNM) это представление биологического макромолекула как упругая масса-и-весна сеть, чтобы изучить, понять и охарактеризовать механические аспекты ее давних крупномасштабных динамика. Модель имеет широкий спектр применения от небольших белков, таких как ферменты, состоящие из одного домен, к большому макромолекулярные сборки например, рибосома или вирусный капсид. Динамика белковых доменов играет ключевую роль во множестве молекулярных распознаваний и клеточная сигнализация процессы. Белковые домены, связанные внутренне неупорядоченными гибкий компоновщик домены, вызывают дальнодействие аллостерия через динамика домена белкаРезультирующие динамические режимы не могут быть предсказаны на основе статических структур всего белка или отдельных доменов.
Модель сети Гаусса - это минималистский, крупнозернистый подход к изучению биологических молекул. В модели белки представлены узлами, соответствующими α-атомам углерода аминокислотных остатков. Точно так же структуры ДНК и РНК представлены от одного до трех узлов для каждого нуклеотид. Модель использует гармоническое приближение для моделирования взаимодействий. Это грубое представление делает вычисления недорогими в вычислительном отношении.
На молекулярном уровне многие биологические явления, такие как каталитическая активность фермент, происходят в диапазоне от нанометров до миллисекунд. Все методы моделирования атома, такие как молекулярная динамика моделирования редко достигают микросекундной длины траектории, в зависимости от размера системы и доступных вычислительных ресурсов. Анализ нормального режима в контексте моделей GNM или эластичных сетей (EN) в целом дает представление о более долгомасштабном функциональном динамическом поведении макромолекул. Здесь модель фиксирует функциональные движения биомолекулы в естественном состоянии за счет атомных деталей. Вывод, полученный из этой модели, является дополнением к методам моделирования атомарных деталей.
Другой моделью динамики белка, основанной на упругих сетях масс и пружин, является модель Модель анизотропной сети.
Теория гауссовой сетевой модели
Модель сети Гаусса была предложена Бахаром, Атилганом, Халилоглу и Эрманом в 1997 году.[1][2] GNM часто анализируется с использованием анализа в нормальном режиме, который предлагает аналитическую формулировку и уникальное решение для каждой конструкции. Анализ нормального режима GNM отличается от других анализов нормального режима тем, что он основан исключительно на топологии контакта между остатками, на которую влияет теория упругости Флори. [3] и Модель Rouse [4] и не учитывает трехмерную направленность движений.
Представление структуры как эластичной сети
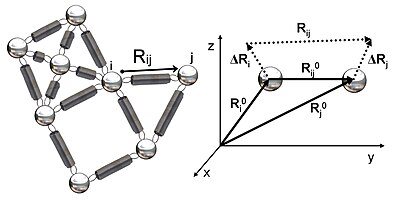
На рисунке 2 показано схематическое изображение эластичной сети, изученной в GNM. Металлические бусины представляют собой узлы в этой гауссовой сети (остатки белка), а пружины представляют связи между узлами (ковалентные и нековалентные взаимодействия между остатками). Для узлов я и j, векторы положения равновесия, р0я и р0j, равновесный вектор расстояний, р0ij, мгновенные векторы колебаний, ΔRя и ΔRj, и мгновенный вектор расстояния, рij, показаны на рисунке 2. Мгновенные векторы положения этих узлов определяются ря и рj. Разница между вектором положения равновесия и вектором мгновенного положения остатка я дает мгновенный вектор флуктуации, ΔRя = ря - р0я. Следовательно, мгновенный вектор колебаний между узлами я и j выражается как ΔRij = ΔRj - ΔRя = рij - р0ij.
Потенциал гауссовой сети
Потенциальная энергия сети с точки зрения ΔRя является
куда γ - силовая постоянная, единообразная для всех пружин и Γij это ijй элемент Кирхгоф (или связность) матрица контактов между остатками, Γ, определяется
рc - это расстояние отсечения для пространственных взаимодействий, принимаемое равным 7 Å для пар аминокислот (представленных их α-атомами углерода).
Выражение компонентов X, Y и Z векторов флуктуаций ΔRя так как ΔXТ = [ΔX1 ΔX2 ..... ΔXN], ΔYТ = [ΔY1 ΔY2 ..... ΔYN], и ΔZТ = [ΔZ1 ΔZ2 ..... ΔZN], приведенное выше уравнение упрощается до
Основы статистической механики
В GNM распределение вероятностей всех колебаний, п(ΔR) является изотропный
и Гауссовский
куда kB - постоянная Больцмана и Т абсолютная температура. п(ΔY) и п(ΔZ) выражаются аналогично. N-мерная гауссова функция плотности вероятности с вектором случайной величины Икс, средний вектор μ и ковариационная матрица Σ является
нормализует распределение и | Σ | - определитель ковариационной матрицы.
Подобно распределению Гаусса, нормализованное распределение для ΔXТ = [ΔX1 ΔX2 ..... ΔXN] вокруг положений равновесия можно выразить как
Константа нормализации, а также статистическая сумма ZИкс, дан кем-то
куда в этом случае является ковариационной матрицей. ZY и ZZ выражаются аналогично. Эта формулировка требует обращения матрицы Кирхгофа. В GNM определитель матрицы Кирхгофа равен нулю, следовательно, для вычисления обратного требуется разложение на собственные значения. Γ−1 строится с использованием N-1 ненулевых собственных значений и связанных с ними собственных векторов. Выражения для п(ΔY) и п(ΔZ) похожи на п(ΔX). Распределение вероятностей всех колебаний GNM принимает вид
Для этой системы массы и пружины константа нормализации в предыдущем выражении является общей статистической суммой GNM, ZGNM,
Ожидаемые значения колебаний и корреляций
Ожидаемые значения колебаний остатка, <ΔRя2> (также называемые среднеквадратичными флуктуациями, MSF) и их взаимными корреляциями, <ΔRя · ΔRj> могут быть организованы как диагональные и недиагональные члены ковариационной матрицы соответственно. На основе статистической механики ковариационная матрица для ΔX дан кем-то
Последнее равенство получается вставкой указанного выше p (ΔX) и взяв (обобщенный гауссовский) интеграл. С,
<ΔRя2> и <ΔRя · ΔRj> следует
Разложение по модам
Нормальные моды GNM находятся путем диагонализации матрицы Кирхгофа, Γ = UΛUТ. Здесь, U - унитарная матрица, UТ = U−1, собственных векторов тыя из Γ и Λ - диагональная матрица собственных значений λя. Частота и форма моды представлены ее собственным значением и собственным вектором соответственно. Поскольку матрица Кирхгофа положительно полуопределенная, первое собственное значение, λ1, равен нулю и соответствующий собственный вектор имеет все элементы, равные 1 /√N. Это показывает, что сетевая модель трансляционно инвариантна.
Взаимные корреляции между остаточными флуктуациями могут быть записаны в виде суммы по N-1 ненулевым модам как
Следует, что, [ΔRя · ΔRj] вклад отдельной моды выражается как
где [тыk]я это яй элемент тыk.
Влияние локальной плотности упаковки
По определению диагональный элемент матрицы Кирхгофа, Γii, равно степени узла в GNM, который представляет собой координационное число соответствующего остатка. Это число является мерой локальной плотности упаковки вокруг данного остатка. Влияние локальной плотности упаковки можно оценить, разложив в ряд Γ−1 матрица. Γ можно записать как сумму двух матриц, Γ = D + О, содержащий диагональные элементы и недиагональные элементы Γ.
- Γ−1 = (D + О)−1 = [ D (я + D−1О) ]−1 = (я + D−1О)−1D−1 = (я - D−1О + ...)−1D−1 = D−1 - D−1О D−1 + ...
Это выражение показывает, что локальная плотность упаковки вносит значительный вклад в ожидаемые флуктуации остатков.[5] Члены, следующие за инверсией диагональной матрицы, являются вкладом позиционных корреляций в ожидаемые флуктуации.
Приложения GNM

Колебания равновесия
Колебания равновесия биологических молекул можно измерить экспериментально. В Рентгеновская кристаллография B-фактор (также называемый фактором Дебая-Валлера или температурным фактором) каждого атома является мерой его среднеквадратического колебания вблизи его положения равновесия в природной структуре. В экспериментах ЯМР этот показатель может быть получен путем вычисления среднеквадратических различий между различными моделями. Во многих приложениях и публикациях, включая оригинальные статьи, было показано, что ожидаемые колебания остатков, полученные с помощью GNM, хорошо согласуются с экспериментально измеренные флуктуации собственного состояния.[6][7] Связь между B-факторами, например, и ожидаемыми колебаниями остатков, полученными из GNM, следующая
На рис.3 показан пример расчета GNM для каталитического домена белка Cdc25B, a цикл деления клеток фосфатаза с двойной специфичностью.

Физические значения медленного и быстрого режимов
Диагонализация матрицы Кирхгофа разбивает конформационные движения на спектр коллективных мод. Ожидаемые значения флуктуаций и взаимных корреляций получаются из линейных комбинаций флуктуаций вдоль этих нормальных режимов. Вклад каждой моды масштабируется с обратной частотой этой моды. Следовательно, медленные (низкочастотные) моды вносят наибольший вклад в ожидаемые флуктуации. Показано, что наряду с несколькими самыми медленными режимами движения являются коллективными и глобальными и потенциально связаны с функциональностью биомолекул. С другой стороны, быстрые (высокочастотные) моды описывают некоррелированные движения, не вызывающие заметных изменений в структуре. Методы, основанные на GNM, не обеспечивают реальной динамики, а только приближения, основанные на сочетании и интерполяции нормальных режимов.[8] Их применимость сильно зависит от того, насколько коллективным является движение.[8][9]
Другие специальные приложения
Есть несколько основных областей, в которых модель гауссовой сети и другие модели упругой сети оказались полезными.[10] К ним относятся:
- Сетевая модель на основе пружинных шариков: В модели сети на основе пружинных бусинок пружины и бусины используются как компоненты в сшитой сети. Пружины имеют поперечные связи для представления механического поведения материала и модели молекулярной динамики (MD) моста и модели конечных элементов (FE) (см. Рисунок 5). Бусинки представляют собой материальную массу кластерных связей. Каждая пружина используется для обозначения кластера полимерных цепей, а не части одной полимерной цепи. Это упрощение позволяет объединять различные модели в различных масштабах длины и значительно повышает эффективность моделирования. На каждой итерации в моделировании силы в пружинах прикладываются к узлам в центре бусинок, и вычисляются уравновешенные узловые перемещения по всей системе. В отличие от традиционного метода КЭ для получения напряжений и деформаций, модель пружина-бусинка обеспечивает смещения узлов и силы в пружинах. Эквивалентную деформацию и энергию деформации сетевой модели на основе пружины и борта можно определить и рассчитать, используя смещения узлов и характеристики пружины. Кроме того, результаты сетевой модели могут быть увеличены для получения структурного отклика на макроуровне с использованием анализа FE.[11][12]
- Разложение гибких / жестких областей и доменов белков [13][14][15]
- Характеристика функциональных движений и функционально важных участков / остатков белков, ферментов и крупных макромолекулярных ансамблей [16][11][17][18][19][20][21][22][23][24][25][26]
- Уточнение и динамика структурных данных низкого разрешения, например Крио-электронная микроскопия [27][28][29][30]
- Молекулярная замена для решения Рентгеновские структуры, когда конформационное изменение произошло по отношению к известной структуре[31]
- Интеграция с атомистическими моделями и симуляциями [32][33]
- Исследование путей и кинетики сворачивания / разворачивания.[34][35]
- Аннотация функционального значения в молекулярной эволюции [36][37]
Веб-серверы
На практике могут быть выполнены два вида вычислений. Первый тип (как таковой GNM) использует Матрица Кирхгофа.[1][2] Второй тип (более конкретно называемый моделью упругой сети или моделью анизотропной сети) использует Матрица Гессе связанный с соответствующим набором гармонических пружин.[38] Оба типа моделей можно использовать онлайн, используя следующие серверы.
Серверы GNM
- iGNM: база данных функциональных движений белков на основе GNM http://ignm.ccbb.pitt.edu [39]
- oGNM: онлайн-расчет динамики конструкций с использованием GNM https://web.archive.org/web/20070516042756/http://ignm.ccbb.pitt.edu/GNM_Online_Calculation.htm
ENM / ANM серверы
- Модель анизотропной сети веб сервер http://www.ccbb.pitt.edu/anm [40]
- elNemo: Веб-интерфейс к модели эластичной сети http://www.sciences.univ-nantes.fr/elnemo/
- AD-ENM: Анализ динамики модели упругой сети http://enm.lobos.nih.gov/
- WEBnm @: Веб-сервер для анализа белков в нормальном режиме http://apps.cbu.uib.no/webnma/home
Другие соответствующие серверы
- ProDy: интерфейс прикладного программирования (API) на Python, который объединяет анализы GNM и ANM, а также несколько инструментов анализа и визуализации молекулярной структуры и последовательности: http://prody.csb.pitt.edu [41][42]
- HingeProt: алгоритм предсказания петель белков с использованием моделей эластичных сетей http://www.prc.boun.edu.tr/appserv/prc/hingeprot/, или же http://bioinfo3d.cs.tau.ac.il/HingeProt/hingeprot.html
- DNABindProt: сервер для определения потенциальных участков связывания ДНК белков http://www.prc.boun.edu.tr/appserv/prc/dnabindprot/
- MolMovDB: База данных макромолекулярных движений: http://www.molmovdb.org/
Смотрите также
- Гауссово распределение
- Гармонический осциллятор
- Закон Гука
- Молекулярная динамика
- Нормальный режим
- Анализ главных компонентов
- Белковая динамика
- Эластичность резины
- Статистическая механика
Рекомендации
Основные источники
- Bahar, I .; Атилган, А. Р .; Эрман, Б. (1997). «Прямая оценка тепловых флуктуаций белка с использованием одного параметра гармонического потенциала». Складывание и дизайн. 2 (3): 173–181. Дои:10.1016 / с1359-0278 (97) 00024-2. PMID 9218955.
- Халилоглу, Т. Бахар; Эрман, Б. (1997). «Гауссова динамика свернутых белков». Phys. Rev. Lett. 79 (16): 3090–3093. Bibcode:1997PhRvL..79.3090H. Дои:10.1103 / Physrevlett.79.3090.
- Цуй Q, Бахар I, (2006). Анализ нормального режима: теория и приложения к биологическим и химическим системам, Chapman & Hall / CRC, Лондон, Великобритания
Конкретные цитаты
- ^ а б Bahar, I .; Атилган, А. Р .; Эрман, Б. (1997). «Прямая оценка тепловых флуктуаций белка с использованием одного параметра гармонического потенциала». Складывание и дизайн. 2 (3): 173–181. Дои:10.1016 / с1359-0278 (97) 00024-2. PMID 9218955.
- ^ а б Халилоглу, Т. Бахар; Эрман, Б. (1997). «Гауссова динамика свернутых белков». Phys. Rev. Lett. 79 (16): 3090–3093. Bibcode:1997PhRvL..79.3090H. Дои:10.1103 / Physrevlett.79.3090.
- ^ Флори, П.Дж. (1976). «Статистическая термодинамика случайных сетей». Proc. Рой. Soc. Лондон. А. 351 (1666): 351. Bibcode:1976RSPSA.351..351F. Дои:10.1098 / rspa.1976.0146.
- ^ Роуз, П. (1953). «Теория линейных вязкоупругих свойств разбавленных растворов рулонных полимеров». J. Chem. Phys. 21 (7): 1272. Bibcode:1953ЖЧФ..21.1272Р. Дои:10.1063/1.1699180.
- ^ Галле, В (2002). «Гибкость и упаковка в белках». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (3): 1274–1279. Bibcode:2002PNAS ... 99.1274H. Дои:10.1073 / pnas.032522499. ЧВК 122180. PMID 11818549.
- ^ Bahar, I .; Wallqvist, A .; Covell, D.G .; Джерниган, Р.Л. (1998). «Корреляция между водородным обменом в естественном состоянии и кооперативными колебаниями остатков из простой модели». Биохимия. 37 (4): 1067–1075. CiteSeerX 10.1.1.551.9055. Дои:10.1021 / bi9720641. PMID 9454598.
- ^ Bahar, I .; Атилган, А. Р .; Демирель, М. С .; Эрман, Б. (1998). «Колебательная динамика белков: значение медленных и быстрых режимов в отношении функции и стабильности». Phys. Rev. Lett. 80 (12): 2733–2736. Bibcode:1998ПхРвЛ..80.2733Б. Дои:10.1103 / Physrevlett.80.2733. S2CID 1070176.
- ^ а б Кмесик, Себастьян; Коуза, Максим; Бадачевска-Давид, Александра Е .; Клочковски, Анджей; Колинский, Анджей (2018). «Моделирование структурной гибкости белка и крупномасштабной динамики: крупномасштабное моделирование и модели упругих сетей». Международный журнал молекулярных наук. 19 (11): 3496. Дои:10.3390 / ijms19113496. ЧВК 6274762. PMID 30404229.
- ^ Ян, Лэй; Песня, Гуан; Джерниган, Роберт Л. (2007-08-01). «Насколько хорошо мы можем понять крупномасштабные движения белков, используя нормальные модели упругих сетевых моделей?». Биофизический журнал. 93 (3): 920–929. Bibcode:2007BpJ .... 93..920Y. Дои:10.1529 / biophysj.106.095927. ISSN 0006-3495. ЧВК 1913142. PMID 17483178.
- ^ Ченнубхотла, С; Рейдер, Эй Джей; Ян, LW; Бахар, я (2005). «Эластичные сетевые модели для понимания биомолекулярных механизмов: от ферментов до супрамолекулярных ансамблей». Phys. Биол. 2 (4): S173 – S180. Bibcode:2005ФБио ... 2С.173С. Дои:10.1088 / 1478-3975 / 2/4 / S12. PMID 16280623.
- ^ а б Чжан, Цзиньцзюнь (2015). «Оптимизированная модель сшитой сети для имитации линейного упругого отклика интеллектуального полимера». Журнал интеллектуальных материальных систем и структур. 27 (11): 1461–1475. Дои:10.1177 / 1045389X15595292.
- ^ Чжан, Цзиньцзюнь (2015). «Новая статистическая сетевая модель на основе пружинных шариков для самочувствительных интеллектуальных полимерных материалов». Журнал интеллектуальных материальных систем и структур. 24 (8): 085022. Bibcode:2015СМАС ... 24х5022З. Дои:10.1088/0964-1726/24/8/085022. HDL:2286 / R.I.35587.
- ^ Хинсен, К. (1999). «Анализ движений домена приближенными расчетами нормального режима». Белки. 33 (3): 417–429. Дои:10.1002 / (sici) 1097-0134 (19981115) 33: 3 <417 :: aid-prot10> 3.0.co; 2-8. PMID 9829700.
- ^ Рейдер, AJ .; Андерсон, G .; Исин, Б .; Khorana, H.G .; Bahar, I .; Кляйн-Ситараман, Дж. (2004). «Идентификация основных аминокислот, стабилизирующих родопсин». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 101 (19): 7246–7251. Bibcode:2004ПНАС..101.7246Р. Дои:10.1073 / pnas.0401429101. ЧВК 409904. PMID 15123809.
- ^ Kundu, S .; Соренсен, округ Колумбия; Филлипс, Г. Младший (2004). «Автоматическая разложение домена белков с помощью модели сети Гаусса». Белки. 57 (4): 725–733. Дои:10.1002 / prot.20268. PMID 15478120.
- ^ Чжан, Цзиньцзюнь (2015). «Новая статистическая сетевая модель на основе пружинных шариков для самочувствительных интеллектуальных полимерных материалов». Умные материалы и конструкции. 24 (8): 085022. Bibcode:2015СМАС ... 24х5022З. Дои:10.1088/0964-1726/24/8/085022. HDL:2286 / R.I.35587.
- ^ Кескин, О .; и другие. (2002). «Связь молекулярной гибкости с функцией: пример тубулина». Биофиз. J. 83 (2): 663–80. Bibcode:2002BpJ .... 83..663K. Дои:10.1016 / с0006-3495 (02) 75199-0. ЧВК 1302177. PMID 12124255.
- ^ Temiz NA & Bahar I. Связывание ингибитора изменяет направление движения домена в обратной транскриптазе ВИЧ-1, Proteins: Structure, Function and Genetics 49, 61-70, 2002.
- ^ Xu, C., Tobi, D. и Bahar, I. 2003 Аллостерические изменения в структуре белка, рассчитанные с помощью простой механической модели: переход гемоглобина T <-> R2, J. Mol. Биол., 333, 153.
- ^ Дрор Тоби и Ивет Бахар, Структурные изменения, вовлеченные в связывание белков, коррелируют с внутренними движениями белков в несвязанном состоянии, Proc Natl Acad Sci (США) 102, 18908-18913, 2005.
- ^ Шривастава, Индира Х .; Бахар, Ивет (2006). «Общий механизм открытия пор, разделяемый пятью различными калиевыми каналами». Biophys J. 90 (11): 3929–3940. Bibcode:2006BpJ .... 90.3929S. Дои:10.1529 / biophysj.105.080093. ЧВК 1459499. PMID 16533848.
- ^ Ян, LW; Бахар, я (2005). «Связь между каталитическим сайтом и коллективной динамикой: требование механохимической активности ферментов». Структура. 13 (6): 893–904. Дои:10.1016 / j.str.2005.03.015. ЧВК 1489920. PMID 15939021.
- ^ Ченнубхотла, Чакра; Бахар, Ивет (2006). "Марковские методы иерархической крупнозернистой динамики больших белков". Конспект лекций по информатике. 3909: 379–393. Дои:10.1007/11732990_32. ISBN 978-3-540-33295-4.
- ^ Ван, Ю. Рейдер; AJ; Bahar, I .; Джерниган, Р.Л. (2004). «Глобальные движения рибосом, выявленные с помощью модели эластичной сети». J. Struct. Биол. 147 (3): 302–314. Дои:10.1016 / j.jsb.2004.01.005. PMID 15450299.
- ^ Рейдер, Эй Джей; Влад, Даниил; Бахар, Ивет (2005). «Динамика созревания капсида бактериофага HK97». Структура. 13 (3): 413–21. Дои:10.1016 / j.str.2004.12.015. PMID 15766543.
- ^ Hamacher, K .; Trylska, J .; Маккаммон, Дж. (2006). «Карта зависимости белков в малой рибосомной субъединице». PLOS Comput. Биол. 2 (2): e10. Bibcode:2006PLSCB ... 2 ... 10 ч. Дои:10.1371 / journal.pcbi.0020010. ЧВК 1364506. PMID 16485038.
- ^ Ming, D .; и другие. (2002). «Как описать движение белка без аминокислотной последовательности и координат атомов». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (13): 8620–8625. Bibcode:2002PNAS ... 99.8620M. Дои:10.1073 / pnas.082148899. ЧВК 124334. PMID 12084922.
- ^ Tama, F .; Wriggers, W .; Брукс III, К. (2002). «Изучение глобальных искажений биологических макромолекул и сборок на основе структурной информации с низким разрешением и теории упругих сетей». J. Mol. Биол. 321 (2): 297–305. CiteSeerX 10.1.1.457.8. Дои:10.1016 / с0022-2836 (02) 00627-7. PMID 12144786.
- ^ Delarue, M .; Дюма, П. (2004). «Об использовании низкочастотных нормальных режимов для усиления коллективных движений при уточнении структурных моделей макромолекул». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 101 (18): 6957–6962. Bibcode:2004PNAS..101.6957D. Дои:10.1073 / pnas.0400301101. ЧВК 406448. PMID 15096585.
- ^ Micheletti, C .; Carloni, P .; Маритан, А. (2004). ""Точное и эффективное описание колебательной динамики белков «сравнение молекулярной динамики и гауссовских моделей». Белки. 55 (3): 635–45. arXiv:cond-mat / 0405145. Bibcode:2004секунд..5145М. Дои:10.1002 / prot.20049. PMID 15103627.
- ^ Suhre, K .; Sanejouand, Y.H. (2004). «О возможностях анализа в нормальном режиме для решения сложных проблем молекулярного замещения». Acta Crystallogr. D. 60 (4): 796–9. Дои:10.1107 / s0907444904001982. PMID 15039589.
- ^ Zhang, Z.Y .; Shi, Y.Y .; Лю, H.Y. (2003). «Моделирование молекулярной динамики пептидов и белков с усиленными коллективными движениями». Биофиз. J. 84 (6): 3583–93. Bibcode:2003BpJ .... 84.3583Z. Дои:10.1016 / с0006-3495 (03) 75090-5. ЧВК 1302944. PMID 12770868.
- ^ Micheletti, C .; Lattanzi, G .; Маритан, А. (2002). «Эластичные свойства белков: понимание процесса сворачивания и эволюционного отбора нативных структур». J. Mol. Биол. 321 (5): 909–21. arXiv:cond-mat / 0204400. Bibcode:2002секунд..4400М. Дои:10.1016 / с0022-2836 (02) 00710-6. PMID 12206770.
- ^ Micheletti, C .; и другие. (2002). «Ключевые этапы сворачивания белка с помощью решаемой модели: прогнозирование сайтов-мишеней для препаратов, ингибирующих ферменты». Белковая наука. 11 (8): 1878–87. arXiv:cond-mat / 0209325. Bibcode:2002секунд .. 9325M. Дои:10.1110 / пс. 3360102. ЧВК 2373687. PMID 12142442.
- ^ Портман, Дж. Дж .; Takada, S .; Волайнс, П. (2001). «Микроскопическая теория скоростей сворачивания белков. I. Тонкая структура профиля свободной энергии и маршруты сворачивания из вариационного подхода». J. Chem. Phys. 114 (11): 5069. arXiv:cond-mat / 0008454. Bibcode:2001ЖЧФ.114.5069П. Дои:10.1063/1.1334662.
- ^ Хамахер, К. (2008). «Связь эволюции последовательности HIV1-протеазы с ее лежащей в основе молекулярной механикой». Ген. 422 (1–2): 30–36. Дои:10.1016 / j.gene.2008.06.007. PMID 18590806.
- ^ Hamacher, K .; Маккаммон, Дж. (2006). «Вычисление аминокислотной специфичности колебаний в биомолекулярных системах». J. Chem. Теория вычислений. 2 (3): 873–8. Дои:10.1021 / ct050247s. PMID 26626694.
- ^ Тирион, М. (1996). «Упругие движения большой амплитуды в белках из однопараметрического атомного анализа». Phys. Rev. Lett. 77 (9): 1905–1908. Bibcode:1996ПхРвЛ..77.1905Т. Дои:10.1103 / Physrevlett.77.1905. PMID 10063201.
- ^ Ли, Х., Чанг, Ю. Ю., Ян, Л. В., и Бахар, И. (2016). iGNM 2.0: база данных гауссовой сетевой модели для структурной динамики биомолекул. Исследование нуклеиновых кислот, 44 (D1), D415-D422.
- ^ Атилган, АР; Durrell, SR; Джерниган, Р.Л .; Демирель, MC; Кескин, О .; Бахар, И. (2001). «Анизотропия флуктуационной динамики белков с моделью упругой сети». Биофиз. J. 80 (1): 505–515. Bibcode:2001BpJ .... 80..505A. Дои:10.1016 / с0006-3495 (01) 76033-х. ЧВК 1301252. PMID 11159421.
- ^ Бакан, А .; Meireles, L.M .; Бахар, И. (2011). «ProDy: динамика белка, выведенная из теории и экспериментов». Биоинформатика. 27 (11): 1575–1577. Дои:10.1093 / биоинформатика / btr168. ЧВК 3102222. PMID 21471012.
- ^ Бакан, А .; Dutta, A .; Mao, W .; Liu, Y .; Chennubhotla, C .; Lezon, T. R .; Бахар, И. (2014). «Evol и ProDy для согласования эволюции белковых последовательностей и структурной динамики». Биоинформатика. 30 (18): 2681–2683. Дои:10.1093 / биоинформатика / btu336. ЧВК 4155247. PMID 24849577.
![V_ {GNM} = frac {gamma} {2} left [sum_ {i, j} ^ {N} (Delta R_j-Delta R_i) ^ 2 ight] =
frac {gamma} {2} left [sum_ {i, j} ^ {N} Delta R_i Gamma_ {ij} Delta R_jight]](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5be28f13b07a00cf754058700cee674e9badb75)

![V_ {GNM} = frac {gamma} {2} [Delta X ^ TGamma Delta X + Delta Y ^ TGamma Delta Y + Delta Z ^ TGamma Delta Z]](https://wikimedia.org/api/rest_v1/media/math/render/svg/e69f61521a50a6c344b039f8d8c5e74a141c239c)













![<Delta R_i cdot Delta R_j> = frac {3 k_B T} {gamma} [ULambda ^ {- 1} U ^ T] _ {ij} = frac {3 k_B T} {gamma} sum_ {k = 1} ^ { N-1} lambda_k ^ {- 1} [u_k u_k ^ T] _ {ij}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cba38d6c9778162a706d15d897151e128670cd23)
![[Delta R_i cdot Delta R_j] _k = frac {3 k_B T} {gamma} lambda_k ^ {- 1} [u_k] _i [u_k] _j](https://wikimedia.org/api/rest_v1/media/math/render/svg/8284898bdd32ed64bd4ca2eb3c5274540809d2b4)
