WikiDer > Глутаминолиз
Глутаминолиз (глутамин + -лиз) представляет собой серию биохимических реакций, посредством которых аминокислота глутамин является лизированный к глутамат, аспартат, CO2, пируват, лактат, аланин и цитрат.[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]
Глутаминолитический путь
Глутаминолиз частично задействует стадии реакции из цикл лимонной кислоты и малат-аспартатный челнок.
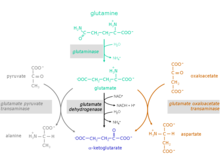
Этапы реакции от глутамина до α-кетоглутарата
Превращение аминокислоты глутамина в α-кетоглутарат происходит в два этапа реакции:
1. Гидролиз аминогруппы глутамина с образованием глутамата и аммоний.Катализирующий фермент: глутаминаза (EC 3.5.1.2)
2. Глутамат может выводиться из организма или метаболизироваться до α-кетоглутарата.
Для превращения глутамата в α-кетоглутарат возможны три различных реакции:
Катализирующие ферменты:
- глутаматдегидрогеназа (GlDH), EC 1.4.1.2
- глутаматпируваттрансаминаза (GPT), также называемая аланин трансаминаза (ALT), EC 2.6.1.2
- глутамат-оксалоацетат-трансаминаза (GOT), также называемая аспартат трансаминаза (AST), EC 2.6.1.1 (компонент челнока малата аспартата)
Вовлеченные стадии реакции цикла лимонной кислоты и малат-аспартат-челнок

- α-кетоглутарат + НАД+ + CoASH → сукцинил-КоА + НАДН + Н+ + CO2
катализирующий фермент: комплекс α-кетоглутаратдегидрогеназы
- сукцинил-КоА + GDP + Pя → сукцинат + GTP
катализирующий фермент: сукцинил-КоА-синтетаза, EC 6.2.1.4
- сукцинат + FAD → фумарат + FADH2
катализирующий фермент: сукцинатдегидрогеназа, EC 1.3.5.1
- фумарат + H2О → малат
катализирующий фермент: фумараза, EC 4.2.1.2
- малат + НАД+ → оксалоацетат + НАДН + Н+
катализирующий фермент: малатдегидрогеназа, EC 1.1.1.37 (компонент челнока малата аспартата)
- оксалоацетат + ацетил-CoA + H2O → цитрат + CoASH
катализирующий фермент: цитрат-синтаза, EC 2.3.3.1
Этапы реакции от малата до пирувата и лактата
Превращение малата в пируват и лактат катализируется
- НАД (Ф) зависимая малатдекарбоксилаза (яблочный фермент; ЕС 1.1.1.39 и 1.1.1.40) и
- лактатдегидрогеназа (LDH; EC 1.1.1.27)
согласно следующим уравнениям:
- малат + НАД (P)+→ пируват + НАД (Ф) Н + Н+ + CO2
- пируват + НАДН + Н+ → лактат + НАД+
Внутриклеточная компартментализация глутаминолитического пути
Реакции глутаминолитического пути частично протекают в митохондриях и частично в цитозоле (сравните метаболическую схему глутаминолитического пути).
Глутаминолиз: важный источник энергии в опухолевых клетках
Глутаминолиз происходит во всех пролиферирующих клетках,[21] Такие как лимфоциты, тимоциты, колоноциты, адипоциты и особенно в опухоль клетки.[1][2][3][4][5][6][7][8][10][11][12][13][14][16][18][19][22] В опухолевых клетках цикл лимонной кислоты сокращается из-за ингибирования фермента. аконитаза (EC 4.2.1.3) высокими концентрациями активные формы кислорода (ROS)[23][24] Аконитаза катализирует превращение цитрата в изоцитрат. С другой стороны, опухолевые клетки сверхэкспрессируют фосфат-зависимую глутаминазу и НАД (Ф) -зависимую малатдекарбоксилазу,[9][25][26][27][28] которые в сочетании с остальными стадиями реакции цикла лимонной кислоты от α-кетоглутарата до цитрата придают возможность нового пути производства энергии, разложения аминокислоты глутамина до глутамата, аспартата, пирувата CO2, лактат и цитрат.
Помимо гликолиз в опухолевых клетках глутаминолиз - еще один столп производства энергии. Высокие концентрации внеклеточного глутамина стимулируют рост опухоли и необходимы для трансформации клеток.[27][29] С другой стороны, снижение уровня глутамина коррелирует с фенотипическими и функциональными отклонениями. дифференциация ячеек.[30]
Энергетическая эффективность глутаминолиза в опухолевых клетках
- один АТФ путем прямого фосфорилирования GDP
- два АТФ от окисления FADH2
- три АТФ одновременно для НАДН + Н+ образуется в реакции α-кетоглутаратдегидрогеназы, реакции малатдегидрогеназы и реакции малатдекарбоксилазы.
Из-за низкой активности глутаматдегидрогеназы и глутаматпируваттрансаминазы в опухолевых клетках преобразование глутамата в альфа-кетоглутарат в основном происходит через глутаматоксалоацетаттрансаминазу.[5][31]
Преимущества глутаминолиза в опухолевых клетках
- Глютамин - самая распространенная аминокислота в плазме и дополнительный источник энергии в опухолевых клетках, особенно когда производство гликолитической энергии низкое из-за большого количества димерная форма М2-ПК.
- Глутамин и продукты его распада глутамат и аспартат являются предшественниками нуклеиновая кислота и серин синтез.
- Глутаминолиз нечувствителен к высоким концентрациям активных форм кислорода (АФК).[нужна цитата]
- Из-за усечения цикла лимонной кислоты количество ацетил-КоА проникает в цикл лимонной кислоты, и ацетил-КоА доступен для синтеза de novo жирные кислоты и холестерин. Жирные кислоты могут использоваться для синтеза фосфолипидов или могут высвобождаться.[32]
- Жирные кислоты представляют собой эффективный накопитель водорода. Таким образом, высвобождение жирных кислот является эффективным способом избавления от цитозольного водорода, производимого гликолитическим раствором. глицеральдегид-3-фосфатдегидрогеназа (GAPDH; EC 1.2.1.9) реакция.[33]
- Глутамат и жирные кислоты обладают иммунодепрессивным действием. Высвобождение обоих метаболитов может защитить опухолевые клетки от иммунных атак.[34][35][36]
- Обсуждалось, что пул глутамата может управлять эндергоническим захватом других аминокислот системой ASC.[17]
- Глутамин может быть преобразован в цитрат без производства НАДН, не связывая производство НАДН с биосинтезом.[21]
Смотрите также
цикл лимонной кислоты,малат-аспартатный челнок
Рекомендации
- ^ а б Кребс, HA; Беллами Д. (1960). «Взаимное превращение глутаминовой кислоты и аспарагиновой кислоты в дышащих тканях». Биохимический журнал. 75 (3): 523–529. Дои:10.1042 / bj0750523. ЧВК 1204504. PMID 14411856.
- ^ а б Reitzer, LJ; Wice BM; Кеннелл Д. (1979). «Доказательства того, что глутамин, а не сахар, является основным источником энергии для культивируемых клеток HeLa». Журнал биологической химии. 254 (8): 2669–2676. PMID 429309.
- ^ а б Зильке, HR; Сумбилла CM; Севдалян Д.А.; Хокинс Р.Л .; Озанд П.Т. (1980). «Лактат: основной продукт метаболизма глутамина диплоидными фибробластами человека». Журнал клеточной физиологии. 104 (3): 433–441. Дои:10.1002 / jcp.1041040316. PMID 7419614.
- ^ а б Мак Кин, WL (1982). «Гликолиз, глутаминолиз и пролиферация клеток». Международные отчеты по клеточной биологии. 6 (7): 635–650. Дои:10.1016/0309-1651(82)90125-4. PMID 6751566.
- ^ а б c Мореадит RW, RW; Ленингер А.Л. (1984). «Пути окисления глутамата и глутамина митохондриями опухолевых клеток». Журнал биологической химии. 259 (10): 6215–6221. PMID 6144677.
- ^ а б Зильке, HR; Zielke CL; Озанд П.Т. (1984). «Глютамин: основной источник энергии для культивируемых клеток млекопитающих». Слушания Федерации. 43 (1): 121–125. PMID 6690331.
- ^ а б Eigenbrodt, E; Fister P; Райнахер М (1985). «Новые взгляды на углеводный обмен в опухолевых клетках». Регулирование углеводного обмена. 2. С. 141–179. ISBN 978-0-8493-5263-8.
- ^ а б Лэнкс, KW (1987). «Конечные продукты метаболизма глюкозы и глутамина клетками L929». Журнал биологической химии. 262 (21): 10093–10097. PMID 3611053.
- ^ а б Доска, М; Humm S; Ньюсхолм Э.А. (1990). «Максимальная активность ключевых ферментов гликолиза, глутаминолиза, пентозофосфатного пути и цикла трикарбоновых кислот в нормальных, неопластических и подавленных клетках». Биохимический журнал. 265 (2): 503–509. Дои:10.1042 / bj2650503. ЧВК 1136912. PMID 2302181.
- ^ а б Медина, Массачусетс; Нуньес де Кастро I (1990). «Взаимодействие глутаминолиза и гликолиза в пролиферирующих клетках». Международный журнал биохимии. 22 (7): 681–683. Дои:10.1016 / 0020-711X (90) 90001-J. PMID 2205518.
- ^ а б Goossens, V; Grooten J; Фирс В. (1996). «Окислительный метаболизм глутамина. Модулятор цитотоксичности фактора некроза опухоли, опосредованной реактивным кислородом, в клетках фибросаркомы L929». Журнал биологической химии. 271 (1): 192–196. Дои:10.1074 / jbc.271.1.192. PMID 8550558.
- ^ а б Мазурек, S; Мишель А; Эйгенбродт Э (1997). «Влияние внеклеточного АМФ на пролиферацию и метаболизм клеточных линий рака груди с высокими и низкими скоростями гликолиза». Журнал биологической химии. 272 (8): 4941–4952. Дои:10.1074 / jbc.272.8.4941. PMID 9030554.
- ^ а б Eigenbrodt, E; Каллиновский Ф; Отт М; Mazurek S; Ваупель П. (1998). «Пируваткиназа и взаимодействие аминокислот и углеводного обмена в солидных опухолях». Противораковые исследования. 18 (5A): 3267–3274. PMID 9858894.
- ^ а б Пива, Т.Дж.; Макэвой-Боу Э (1998). «Окисление глутамина в клетках HeLa: роль и контроль укороченных циклов TCA в митохондриях опухолей». Журнал клеточной биохимии. 68 (2): 213–225. Дои:10.1002 / (SICI) 1097-4644 (19980201) 68: 2 <213 :: AID-JCB8> 3.0.CO; 2-Y. PMID 9443077.
- ^ Мазурек, S; Eigenbrodt E; Если K; Стейнберг П. (1999). «Изменения гликолитического и глутаминолитического путей после злокачественной трансформации овальных клеток печени крыс». Журнал клеточной физиологии. 181 (1): 136–146. Дои:10.1002 / (SICI) 1097-4652 (199910) 181: 1 <136 :: AID-JCP14> 3.0.CO; 2-T. PMID 10457361.
- ^ а б Мазурек, S; Zwerschke W; Jansen-Dürr P; Эйгенбродт Э (2001). «Влияние онкопротеина Е7 ВПЧ-16 вируса папилломы человека на гликолиз и глутаминолиз: роль пюваткиназы типа М2 и комплекса гликолитических ферментов». Биохимический журнал. 356 (Pt 1): 247–256. Дои:10.1042/0264-6021:3560247. ЧВК 1221834. PMID 11336658.
- ^ а б Аледо, JC (2004). «Распад глутамина в быстро делящихся клетках: отходы или вложение?». BioEssays. 26 (7): 778–785. Дои:10.1002 / bies.20063. PMID 15221859.
- ^ а б Rossignol, R; Gilkerson R; Aggeler R; Yamagata K; Remington SJ; Капальди Р.А. (2004). «Энергетический субстрат модулирует структуру митохондрий и окислительную способность раковых клеток». Исследования рака. 64 (3): 985–993. Дои:10.1158 / 0008-5472.CAN-03-1101. PMID 14871829.
- ^ а б Мазурек, S (2007). «Энергетический метаболом опухолевой клетки». Биоэнергетика молекулярных систем. С. 521–540. ISBN 978-3-527-31787-5.
- ^ DeBerardinis, RJ; Sayed N; Дитсворт Д; Томпсон CB (2008). «По кирпичику: обмен веществ и рост опухоли». Текущее мнение в области генетики и развития. 18 (1): 54–61. Дои:10.1016 / j.gde.2008.02.003. ЧВК 2476215. PMID 18387799.
- ^ а б Фернандес-де-Коссио-Диас, Хорхе; Васкес, Алексей (18.10.2017). «Пределы аэробного метаболизма в раковых клетках». Научные отчеты. 7 (1): 13488. Bibcode:2017НатСР ... 713488F. Дои:10.1038 / с41598-017-14071-у. ISSN 2045-2322. ЧВК 5647437. PMID 29044214.
- ^ Вольфром, К; Kadhom N; Polini G; Poggi J; Moatti N; Готье М (1989). «Глутаминовая зависимость фибробластов кожи человека: модуляция гексоз». Экспериментальные исследования клеток. 183 (2): 303–318. Дои:10.1016/0014-4827(89)90391-1. PMID 2767153.
- ^ Гарднер, PR; Райнери I; Эпштейн Л.Б .; Белый CW (1995). «Супероксидный радикал и железо модулируют активность аконитазы в клетках млекопитающих». Журнал биологической химии. 270 (22): 13399–13405. Дои:10.1074 / jbc.270.22.13399. PMID 7768942.
- ^ Kim, KH; Родригес AM; Каррико PM; Мелендес Я.А. (2001). «Возможные механизмы ингибирования роста опухолевых клеток супероксиддисмутазой марганца». Антиоксиданты и редокс-сигналы. 3 (3): 361–373. Дои:10.1089/15230860152409013. PMID 11491650.
- ^ Мацуно, Т; Гото I (1992). «Активность глутаминазы и глутаминсинтетазы при циррозе печени и гепатоцеллюлярной карциноме человека». Исследования рака. 52 (5): 1192–1194. PMID 1346587.
- ^ Аледо Дж. К., Сегура Дж. А., Медина М. А., Алонсо Ф. Дж., Нуньес де Кастро И., Маркес Дж. (1994). «Фосфат-активированная экспрессия глутаминазы во время развития опухоли». Письма FEBS. 341 (1): 39–42. Дои:10.1016 / 0014-5793 (94) 80236-X. PMID 8137919. S2CID 12702894.
- ^ а б Лобо C, Руис-Беллидо MA, Аледо JC, Маркес J, Нуньес Де Кастро I, Алонсо FJ (2000). «Ингибирование экспрессии глутаминазы антисмысловой мРНК снижает рост и опухолевость опухолевых клеток». Биохимический журнал. 348 (2): 257–261. Дои:10.1042/0264-6021:3480257. ЧВК 1221061. PMID 10816417.
- ^ Мазурек, S; Grimm H; Oehmke M; Weisse G; Teigelkamp S; Эйгенбродт Э (2000). «Опухоль M2-PK и глутаминолитические ферменты в метаболическом сдвиге опухолевых клеток». Противораковые исследования. 20 (6D): 5151–5154. PMID 11326687.
- ^ Turowski, GA; Рашид З; Hong F; Madri JA; Бассон, доктор медицины (1994). «Глютамин модулирует фенотип и стимулирует пролиферацию клеточных линий рака толстой кишки человека». Исследования рака. 54 (22): 5974–5980. PMID 7954430.
- ^ Спиттлер, А; Oehler R; Goetzinger P; Holzer S; Рейсснер СМ; Leutmezer J; Рат V; Wrba F; Fuegger R; Boltz-Nitulescu G; Рот Э (1997). «Низкие концентрации глутамина вызывают фенотипическую и функциональную дифференцировку миеломоноцитарных клеток U937». Журнал питания. 127 (11): 2151–2157. Дои:10.1093 / jn / 127.11.2151. PMID 9349841.
- ^ Мацуно, Т. (1991). «Путь окисления глутамата и его регуляция в линии HuH13 клеток гепатомы человека». Журнал клеточной физиологии. 148 (2): 290–294. Дои:10.1002 / jcp.1041480215. PMID 1679060.
- ^ Парло, РА; Коулман PS (1984). «Повышенная скорость экспорта цитрата из богатых холестерином митохондрий гепатомы. Усеченный цикл Кребса и другие метаболические разветвления холестерина митохондриальной мембраны». Журнал биологической химии. 259 (16): 9997–10003. PMID 6469976.
- ^ Мазурек, S; Grimm H; Boschek CB; Vaupel P; Эйгенбродт Э (2002). «Пируваткиназа типа M2: перекресток в метаболоме опухоли». Британский журнал питания. 87: S23 – S29. Дои:10.1079 / BJN2001455. PMID 11895152.
- ^ Эк, HP; Сверла П; Dröge W (1989). «Уровни глутамата в плазме, реактивность лимфоцитов и смерть у пациентов с карциномой бронхов». Журнал исследований рака и клинической онкологии. 115 (6): 571–574. Дои:10.1007 / BF00391360. PMID 2558118. S2CID 23057794.
- ^ Гримм, H; Тибелл А; Норрлинд Б; Blecher C; Wilker S; Швеммле К. (1994). «Иммунорегуляция родительскими липидами: влияние соотношения жирных кислот n-3 к n-6». Журнал парентерального и энтерального питания. 18 (5): 417–421. Дои:10.1177/0148607194018005417. PMID 7815672.
- ^ Цзян, РГ; Bryce RP; Хоробин Д.Ф. (1998). «Незаменимые жирные кислоты: молекулярные и клеточные основы их противоракового действия и клиническое значение». Критические обзоры в онкологии / гематологии. 27 (3): 179–209. Дои:10.1016 / S1040-8428 (98) 00003-1. PMID 9649932.