WikiDer > Опухоль М2-ПК - Википедия
Эта статья включает в себя список общих Рекомендации, но он остается в основном непроверенным, потому что ему не хватает соответствующих встроенные цитаты. (Июль 2009 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Опухоль М2-ПК является синонимом димерный форма пируваткиназа изофермент тип М2 (ПКМ2), ключевой фермент в метаболизм опухоли. Опухоль M2-PK может быть повышена при многих типах опухолей, а не является специфичной для органа. онкомаркер Такие как PSA. Повышенный уровень стула (фекалий) исследуется как метод скрининга на наличие колоректальные опухоли, и ЭДТА плазма уровни проходят тестирование на предмет возможного применения в ходе различных раки.
Бутерброд ELISA на основе двух моноклональные антитела которые специфически распознают опухоль M2-PK (димерная форма M2-PK) доступны для количественного определения опухоли M2-PK в образцах стула и плазмы с ЭДТА соответственно. Как биомаркерколичество M2-PK опухоли в стуле и EDTA-плазме отражает конкретный метаболический статус опухолей.
Раннее обнаружение колоректальных опухолей и полипов
M2-PK, измеренная в кал, является потенциальным онкомаркером для колоректальный рак. При измерении в кал с значение отсечки 4 Ед / мл, его чувствительность оценивается в 85% (при 95% доверительный интервал от 65 до 96%) для рака толстой кишки и 56% (доверительный интервал 41–74%) для рака прямой кишки.[1] Его специфичность составляет 95%.[2]
Тест M2-PK не зависит от скрытой крови (ELISA метод), поэтому он может обнаруживать кровоточащий или некровоточащий рак кишечника, а также полипы с высокой чувствительностью и высокой специфичностью без ложных отрицательных результатов, но могут возникать ложноположительные результаты.[3]
Большинство людей охотнее соглашаются на неинвазивные профилактические медицинские осмотры. Таким образом, измерение опухоли M2-PK в образцах стула с последующим наблюдением колоноскопия Чтобы прояснить опухоль M2-PK положительные результаты, может оказаться достижением в раннем обнаружении колоректальной карциномы. Маркировка CE Тест М2-ПК доступен в форме теста ELISA для количественных результатов или в виде теста на месте, чтобы получить результаты в течение нескольких минут.
Опухоль M2-PK также полезна для диагностики рак легких и лучше чем SCC и NSE онкомаркеры.[4] При почечно-клеточном раке (ПКР) чувствительность теста M2PK составляет 66,7% для метастатического ПКР и 27,5% для неметастатического ПКР, но тест M2PK не может обнаружить переходно-клеточную карциному мочевого пузыря, рак простаты и доброкачественную гиперплазию простаты.[5]
Наблюдение за раком
Исследования различных международных рабочих групп выявили значительно повышенное количество опухоли M2-PK в образцах плазмы с ЭДТА пациентов с опухолями почек, легких, молочной железы, шейки матки и желудочно-кишечного тракта (пищевода, желудка, поджелудочной железы, толстой и прямой кишки), а также меланома, которая коррелировала с стадия опухоли.
Комбинация Tumor M2-PK с подходящим классическим онкомаркером, таким как CEA для рака кишечника, CA 19-9 для рака поджелудочной железы и CA 72-4 для рака желудка, значительно увеличивает чувствительность для выявления различных видов рака.
Важным применением теста M2-PK опухоли в EDTA-плазме является последующее наблюдение во время терапии опухоли, чтобы контролировать успех или неудачу выбранного лечения, а также прогнозировать шансы на «излечение» и выживание.
Если уровни M2-PK в опухоли снижаются во время терапии, а затем остаются низкими после терапии, это указывает на успешное лечение. Увеличение значений M2-PK опухоли во время или после терапии указывает на рецидив и / или метастазирование.
Повышенные значения M2-PK в опухоли иногда также могут возникать при тяжелых воспалительные заболевания, которые необходимо исключить при дифференциальной диагностике.
Тетрамерно-димерный ПКМ2
Пируваткиназа катализирует последний этап гликолитическая последовательность, дефосфорилирование фосфоенолпирувата в пируват и отвечает за чистую выработку энергии в гликолитическом пути. В зависимости от различных метаболических функций тканей экспрессируются разные изоферменты пируваткиназы.
М2-ПК (ПКМ2) является преобладающей изоформой пируваткиназы в пролиферирующих клетках, таких как фибробласты, эмбриональные клетки и взрослые стволовые клетки и большинство тканей человека, включая легкие, мочевой пузырь, почки и тимус; M2-PK активируется во многих опухолях человека.[6]
M2-PK может встречаться в пролиферирующих клетках в двух разных формах:
- тетрамерная форма, состоящая из четырех субъединиц
- димерная форма, состоящая из двух субъединиц.
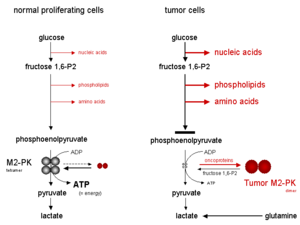
В тетрамерная форма М2-ПК имеет высокое сродство к своему субстрату, фосфоенолпирувату (PEP), и очень активен при физиологических концентрациях PEP. Кроме того, тетрамерная форма M2-PK связана с несколькими другими гликолитическими ферментами в так называемых гликолитический ферментный комплекс. Из-за непосредственной близости ферментов ассоциация внутри комплекса гликолитических ферментов приводит к высокоэффективному превращению глюкозы в лактат. Когда M2-PK находится в основном в высокоактивной тетрамерной форме, что имеет место в большинстве нормальных клеток, глюкоза в основном превращается в лактат с сопутствующим производством энергии.
Напротив, димерная форма М2-ПК имеет низкое сродство к фосфоенолпирувату, будучи почти неактивным при физиологических концентрациях PEP. Когда M2-PK находится в основном в димерной форме, что имеет место в опухолевых клетках, все фосфометаболиты выше пируваткиназы накапливаются и направляются в синтетические процессы, которые ответвляются от промежуточных продуктов гликолиза, таких как нуклеиновые кислоты, фосфолипиды и аминокислоты, важные строительные блоки для высокопролиферирующих клеток, таких как опухолевые клетки.
Вследствие ключевого положения пируваткиназы в гликолизе соотношение тетрамер: димер M2-PK определяет, будут ли атомы углерода глюкозы превращаться в пируват и лактат вместе с производством энергии (тетрамерная форма) или направляются в синтетические процессы ( димерная форма). В опухолевых клетках M2-PK находится в основном в димерной форме. Поэтому димерная форма M2-PK была названа Опухоль М2-ПК.
Димеризация M2-PK в опухолевых клетках индуцируется прямым взаимодействием M2-PK с различными онкопротеины.
Однако соотношение тетрамер: димер M2-PK не является постоянным.
Кислородное голодание или сильно накапливающиеся гликолитические промежуточные продукты, такие как фруктозо-1,6-бисфосфат (фруктоза 1,6-P2) или аминокислота серин, вызывают повторную ассоциацию димерной формы M2-PK с тетрамерной формой. Следовательно, из-за активации M2-PK глюкоза превращается в пируват и лактат при выработке энергии до тех пор, пока уровень фруктозы 1,6-P2 не упадет ниже определенного порогового значения, что позволяет диссоциации тетрамерной формы M2- ПК в димерную форму. После этого цикл колебаний начинается снова, когда уровни фруктозы 1,6-P2 достигают определенного верхнего порогового значения, которое вызывает тетрамеризацию M2-PK.
Когда M2-PK в основном находится в менее активной димерной форме, энергия образуется за счет разложения аминокислоты глутамина до аспартата, пирувата и лактата, что называется глутаминолиз.
В опухолевых клетках повышенная скорость производства лактата в присутствии кислорода называется Эффект варбурга.
Мутации
Впервые сообщалось о ферменте пируваткиназы M2 с двумя миссенс-мутациями, H391Y и K422R, обнаруженными в клетках из Синдром Блума пациенты, склонные к развитию рака. Результаты показывают, что, несмотря на наличие мутаций в межсубъединичном контактном домене, мутантные белки K422R и H391Y сохранили свою гомотетрамерную структуру, подобную белку дикого типа, но показали потерю активности на 75 и 20% соответственно. H391Y показал 6-кратное увеличение сродства к своему субстрату фосфоенолпирувату и вел себя как неаллостерический белок с нарушенным кооперативным связыванием. Однако у K422R сродство к фосфоенолпирувату значительно потеряно. В отличие от K422R, H391Y продемонстрировал повышенную термическую стабильность, стабильность в диапазоне значений pH, меньший эффект аллостерического ингибитора Phe и устойчивость к структурным изменениям при связывании активатора (фруктозо-1,6-бисфосфат) и ингибитора (Phe). Оба мутанта показали небольшой сдвиг оптимума pH с 7,4 до 7,0.[7] Совместная экспрессия гомотетрамерного PKM2 дикого типа и мутанта PKM2 в клеточной среде, приводящая к взаимодействию между ними на уровне мономера, была дополнительно подтверждена экспериментами in vitro. Перекрестное мономерное взаимодействие значительно изменяет олигомерное состояние PKM2, способствуя димеризации и гетеротетрамеризации. Исследование in silico предоставило дополнительную поддержку, показав, что гетероолигомеризация является энергетически выгодной. Гетероолигомерные популяции PKM2 показали измененную активность и аффинность, и их экспрессия привела к увеличению скорости роста Escherichia coli, а также клеток млекопитающих, наряду с увеличением скорости полиплоидии. Эти особенности, как известно, необходимы для прогрессирования опухоли.[8]
Возможный многофункциональный белок
Смотрите также
Рекомендации
- ^ Haug, U .; Rothenbacher, D .; Wente, M. N .; Seiler, C.M .; Stegmaier, C .; Бреннер, Х. (2007). «Опухоль M2-PK как маркер стула для колоректального рака: сравнительный анализ большой выборки пожилых людей, не прошедших отбор, и пациентов с колоректальным раком». Британский журнал рака. 96 (9): 1329–34. Дои:10.1038 / sj.bjc.6603712. ЧВК 2360192. PMID 17406361.
- ^ 4004.pdf В архиве 2014-10-09 в Wayback Machine
- ^ «Тест стула опухоли M2-PK». Получено 8 июня, 2013.
- ^ Оремек, Г; Kukshate, R; Сапуцис, Н; Циолковский, П (2007). «Значение онкомаркера TU M2-PK для диагностики рака легких». Клиническая Медицина. 85 (7): 56–58. PMID 17882813.
- ^ Ройгас Дж., Шульце Дж., Райтаровски С., Юнг К., Шнорр Д., Лёнинг С.А. (Сентябрь 2001 г.). «Опухоль пируваткиназы M2 в плазме крови пациентов с урологическими опухолями». Опухоль Биол. 22 (5): 282–5. Дои:10.1159/000050628. PMID 11553857.CS1 maint: несколько имен: список авторов (связь)
- ^ Блумлейн К., Грюнинг Н.М., Файхтингер Р.Г., Лехрах Х., Кофлер Б., Ральсер М. (2011). «Нет доказательств сдвига в экспрессии пируваткиназы PKM1 на PKM2 во время туморогенеза». Oncotarget. 2 (5): 393–400. Дои:10.18632 / oncotarget.278. ЧВК 3248187. PMID 21789790.
- ^ Ахтар К., Гупта В., Коул А., Алам Н., Бхат Р., Бамезай Р. Н. (май 2009 г.). «Дифференциальное поведение миссенс-мутаций в межсубъединичном контактном домене изофермента пируваткиназы M2 человека». J. Biol. Chem. 284 (18): 11971–81. Дои:10.1074 / jbc.M808761200. ЧВК 2673266. PMID 19265196.
- ^ Гупта В., Калайарасан П., Фахим М., Сингх Н., Икбал М.А., Бамезай Р.Н. (май 2010 г.). «Доминирующие негативные мутации влияют на олигомеризацию изофермента пируваткиназы M2 человека и способствуют клеточному росту и полиплоидии». J. Biol. Chem. 285 (22): 16864–73. Дои:10.1074 / jbc.M109.065029. ЧВК 2878009. PMID 20304929.
- ^ Гупта В., Бамезай Р.Н. (сентябрь 2010 г.). «Пируваткиназа-M2 человека:» Многофункциональный белок"". Белковая наука. 19 (11): 2031–44. Дои:10.1002 / pro.505. ЧВК 3005776. PMID 20857498.
Табурет
- Hardt PD, Mazurek S, Toepler M, Schlierbach P, Bretzel RG, Eigenbrodt E, Kloer HU (2004). «Фекальная опухоль пируваткиназа M2: новый чувствительный инструмент для скрининга колоректального рака. Брит. J». Рак. 91 (5): 980–984. Дои:10.1038 / sj.bjc.6602033. ЧВК 2409989. PMID 15266315.
- Косс К., Макстон Д., Янковский ЯЗ. Потенциальное использование фекальной димерной пируваткиназы M2 (Tumor M2-PK) в скрининге на колоректальный рак (CRC). Выписка из Недели болезней пищеварения, май 2005 г .; Чикаго, США.
- Mc Loughlin R, Shiel E, Sebastian S, Ryan B, O´Connor HJ, O´Morain C. Tumor M2-PK, новый инструмент для скрининга колоректального рака. Выдержка из Недели болезней пищеварения, май 2005 г., Чикаго / США
Плазма
- Cerwenka H, Aigner R, Bacher H, Werkgartner G, El-Shabrawi A, Quehenberger F, Mischinger HJ (1999). «TUM2-PK (опухоль типа пируваткиназы M2), CA19-9 и CEA у пациентов с доброкачественными, злокачественными и метастазирующими поражениями поджелудочной железы». Anticancer Res. 19 (1B): 849–52. PMID 10216504.
- Каура Б., Багга Р., Патель Ф. Д. (2004). «Оценка опухоли изофермента пируваткиназы (Tu M2-PK) в качестве онкомаркера карциномы шейки матки». J. Obstet. Gynaecol. Res. 30 (3): 193–196. Дои:10.1111 / j.1447-0756.2004.00187.x. PMID 15210041.
- Ким Ч.В., Ким Джи, Пак Ш.и др. (Ноябрь 2003 г.). «Полезность плазменной М2-пируваткиназы опухоли в диагностике рака желудочно-кишечного тракта». Корейский журнал гастроэнтерологии = Taehan Sohwagi Hakhoe Chi. 42 (5): 387–93. PMID 14646575.
- Люфтнер Д., Местерхарм Дж., Акривакис С., Гепперт Р., Петридес П. Е., Вернеке К. Д., Поссингер К. (2000). «Опухоль M2-пируваткиназы экспрессии при распространенном раке молочной железы». Anticancer Res. 20 (6D): 5077–5082. PMID 11326672.
- Оремек Г.М., Тейгелькамп С., Крамер В., Эйгенбродт Э., Усадель К.Х. (1999). «Изофермент пируваткиназы опухоли M2 (Tu M2-PK) в качестве онкомаркера рака почек». Anticancer Res. 19 (4A): 2599–2601. PMID 10470201.
- Шнайдер Дж, Морр Х., Велковски Х.Г., Вайсе Дж., Эйгенбродт Э. (2000). «Количественное определение опухолевой M2-пируваткиназы в плазме крови пациентов с раком легкого по сравнению с другими заболеваниями легких». Обнаружение и профилактика рака. 24 (6): 531–5. PMID 11198266.
- Шнайдер Дж, Шульце Дж (2003). «Сравнение опухолевой M2-пируваткиназы (Tumor M2-PK), карциноэмбрионального антигена (CEA), углеводных антигенов CA 19-9 и CA 724 в диагностике рака желудочно-кишечного тракта». Anticancer Res. 23 (6D): 5089–5095. PMID 14981971.
- Угурель С., Белл Н., Сукер А., Цимпфер А., Риттген В., Шадендорф Д. (2005). «Пируваткиназа M2 опухолевого типа (TuM2-PK) как новый плазменный опухолевый маркер при меланоме». Int. J. Рак. 117 (5): 825–830. Дои:10.1002 / ijc.21073. PMID 15957165.
- Вентруччи М., Чиполла А., Раккини С., Касадей Р., Симони П., Гулло Л. (2004). «Опухолевая M2-пируваткиназа, новый метаболический маркер рака поджелудочной железы». Копать землю. Dis. Sci. 49 (7–8): 1149–1155. Дои:10.1023 / B: DDAS.0000037803.32013.aa. PMID 15387337.
- Вексель Х.В., Петри Э., Бихлер К.Х., Фейл Г. (1999). «Маркер рака почки (ПКР): димерная форма пируваткиназы типа M2 (Tu M2-PK)». Anticancer Res. 19 (4A): 2583–2590. PMID 10470199.
- Чжан Б., Чен Дж.Й., Чен Д.Д., Ван ГБ, Шэнь П. (2004). «Экспрессия пируваткиназы M2 типа опухоли при раке желудка, колоректальном раке и контроле». Мир J. Gastroenterol. 10 (11): 1643–1646. Дои:10.3748 / wjg.v10.i11.1643. ЧВК 4572770. PMID 15162541.
Научное обоснование
- Mazurek S, Boschek CB, Hugo F, Eigenbrodt E (2005). «Пируваткиназа типа M2 и ее роль в росте и распространении опухоли». Семин. Рак Биол. 15 (4): 300–308. Дои:10.1016 / j.semcancer.2005.04.009. PMID 15908230.