WikiDer > UTP - глюкозо-1-фосфатуридилилтрансфераза
| UTP - глюкозо-1-фосфатуридилилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Человеческий UTP - мультфильм глюкозо-1-фосфатуридилилтрансферазы, созданный в пимоле | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.7.7.9 | ||||||||
| Количество CAS | 9026-22-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
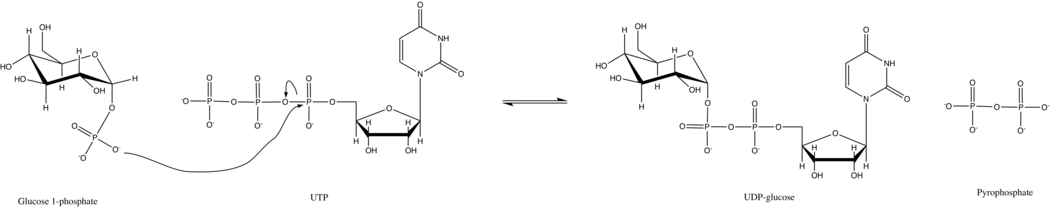
UTP - глюкозо-1-фосфатуридилилтрансфераза также известен как глюкозо-1-фосфат уридилилтрансфераза (или UDP – глюкозопирофосфорилаза) является ферментом, участвующим в углеводный обмен. Он синтезирует UDP-глюкоза из глюкозо-1-фосфат и UTP; т.е.
UTP - глюкозо-1-фосфатуридилтрансфераза - это фермент, обнаруженный во всех трех домены (бактерии, эукария, и археи), так как это ключевой игрок в гликогенез и клеточная стенка синтез. Его роль в метаболизме сахара широко изучалась на растениях, чтобы понять рост растений и увеличить сельскохозяйственное производство. Недавно, человек UTP - глюкозо-1-фосфатуридилилтрансфераза была изучена и кристаллизована, обнаружив другой тип регуляции, чем у других ранее изученных организмов. Его значение проистекает из множества применений UDP-глюкозы, включая галактоза метаболизм, синтез гликогена, гликопротеин синтез и гликолипид синтез.[1][2]
Структура
Структура UTP-глюкозо-1-фосфатуридилилтрансферазы значительно различается между прокариоты и эукариоты, но у эукариот первичная, вторичная и третичная структуры фермента вполне консервативны.[3] У многих видов УТФ-глюкозо-1-фосфатуридилилтрансфераза обнаруживается как гомополимер состоящий из идентичных субъединиц в симметричной четвертичной структуре.[4][5] Количество субъединиц варьируется в зависимости от вида: например, у кишечная палочка, фермент находится в виде тетрамера, тогда как в Burkholderia xenovorans, фермент димерный.[5][6] У людей и дрожжей фермент активен как октамер, состоящий из двух тетрамеров, наложенных друг на друга с консервативными гидрофобными остатками на границах раздела между субъединицами.[7][8] Напротив, у растений фермент имеет консервативные заряженные остатки, образующие поверхность раздела между субъединицами.
У человека каждая субъединица фермента содержит несколько остатков (L113, N251 и N328), которые являются высококонсервативными у эукариот. А Россман фолд мотив участвует в связывании UTP нуклеотид а сахар-связывающий домен (остатки T286-G293) координируется с глюкозным кольцом.[9] А миссенс-мутация (G115D) в области фермента, содержащей активный центр (который является консервативным у эукариот), вызывает резкое снижение ферментативной активности in vitro.[10]
Примеры
Человеческие гены, кодирующие белки с активностью UTP-глюкозо-1-фосфат-уридилилтрансферазы, включают два изоформы с молекулярной массой 56,9 и 55,7 кДа соответственно.[11]
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Функция
UTP - глюкозо-1-фосфатуридилтрансфераза широко распространена в природе из-за своей важной роли в генерации UDP-глюкоза, центральное соединение в метаболизме углеводов. В листьях растений УТФ - глюкозо-1-фосфат уридилилтрансфераза является ключевой частью сахарозы. биосинтез путь, снабжение Уридиндифосфат глюкоза к Сахарозо-фосфатсинтаза который превращает UDP-глюкозу и D-фруктозо-6-фосфат в сахарозо-6-фосфат.[12] Он также может частично отвечать за расщепление сахарозы в других тканях с использованием UDP-глюкозы.
У высших животных фермент очень активен в тканях, участвующих в гликогенез, в том числе печень и мышцы.[13] Исключением является мозг, который имеет высокий уровень гликоген но низкий специфическая деятельность УТФ - глюкозо-1-фосфат уридилилтрансфераза.[14] В клетках животных UTP — глюкозо-1-фосфатуридилтрансфераза обнаруживается преимущественно в цитоплазме.
UTP - глюкозо-1-фосфат уридилилтрансфераза также требуется для метаболизм галактозы у животных и микроорганизмов. В метаболизме галактозы фермент галактозо-1-фосфатуридилилтрансфераза переносит фосфат из UDP-глюкозы в галактозо-1-фосфат с образованием UDP-галактозы, которая затем превращается в UDP-глюкозу.[15] Бактерии с дефектной UTP-глюкозо-1-фосфатуридиллилтрансферазой не могут включать галактозу в свои клеточные стенки.[16]
Механизм
В первичной реакции этого фермента фосфатная группа на глюкозо-1-фосфат заменяет фосфоангидридную связь на UTP. Эта реакция легко обратима, и Свободная энергия Гиббса близка к нулю. Однако в типичных клеточных условиях неорганическая пирофосфатаза быстро гидролизует пирофосфат продукта и стимулирует реакцию Принцип Ле Шателье.
UTP - глюкозо-1-фосфатуридилилтрансфераза использует упорядоченный последовательный Bi Bi механизм как для прямой, так и для обратной реакции.[17] В дрожжах действие фермента простое. Кинетика Михаэлиса-Ментен и не выставляется сотрудничество между субъединицами октамера.[8]
Подобно другому сахару нуклеотидилтрансферазыUTP - активность глюкозо-1-фосфатуридилилтрансферазы требует двух двухвалентных катионов для стабилизации связывания отрицательно заряженных фосфатных групп.[18] Магний обычно выполняет эту роль, но другие ионы, такие как марганец(II), кобальт(II), и никель(II) также можно заменить с ~ 75% снижением оптимальной активности.[19] Эксперименты по рентгеновской кристаллографии показали, что один Mg2+ ион координируется фосфорильным кислородом на глюкозо-1-фосфате и α-фосфорильным кислородом на UTP.[5] Помимо стабилизации отрицательно заряженных фосфатов, Mg2+ Считается, что глюкозо-1-фосфат нуклеофильная атака α-фосфора UTP.[20]
Регулирование
Несмотря на то, что UDP-глюкозопирофосфорилаза функционально схожа у разных видов, она имеет разные структуры и механизмы регуляции у разных организмов.
Микроорганизмы
В дрожжах УТФ-глюкозо-1-фосфатуридилтрансфераза регулируется фосфорилированием Киназа PAS.[21] Это фосфорилирование обратимо и контролирует распределение потока сахара в направлении гликогена и синтеза клеточной стенки.
Растения
UTP - глюкозо-1-фосфатуридилилтрансфераза в растения регулируется через олигомеризация и возможно фосфорилирование.[22] В ячмене было показано, что UDP-глюкозопирофосфорилаза активна только в мономерной форме, но легко образует олигомеры, предполагая, что олигомеризация может быть формой регуляции фермента. В рисе холодовой стресс снижает N-гликозилирование фермента, который, как считается, изменяет активность фермента в ответ на холод.[23]
В Арабидопсис, есть два изоферменты УТФ - глюкозо-1-фосфат уридилилтрансфераза: UGP1 и UGP2.[24] Эти два изофермента имеют почти идентичную активность и отличаются всего 32 аминокислотами, каждая из которых расположена на внешней поверхности белка вдали от активного сайта. Эти незначительные различия могут позволить дифференциальную аллостерическую регуляцию активности изоферментов. UGP1 и UGP2 по-разному экспрессируются в разных частях растения. Экспрессия UGP1 широко экспрессируется в большинстве тканей, тогда как UGP2 экспрессируется в основном в цветках, что позволяет предположить, что UGP1 является основной формой фермента, а UGP2 выполняет вспомогательную функцию. Действительно, экспрессия UGP2 увеличивается в ответ на стрессоры, такие как дефицит фосфата, указывая на то, что UGP2, вероятно, функционирует как резервный для UGP1, когда растение находится в состоянии стресса окружающей среды.
Животные
Контроль активности UTP-глюкозо-1-фосфатуридилтрансферазы достигается в первую очередь генетическими средствами (т.е. регуляцией транскрипция и перевод). Подобно большинству ферментов, UTP-глюкозо-1-фосфатуридилилтрансфераза ингибируется своим продуктом, UDP-глюкозой. Однако фермент не подвержен значительным аллостерическая регуляция, что логично, учитывая широкое использование UDP-глюкозы в различных метаболических путях.
Люди
У человека UDP-глюкозопирофосфорилаза активна как октамер.[7] Активность фермента также изменяется O-гликозилирование.[25] Как и у других видов млекопитающих, у человека есть две разные изоформы, которые продуцируются альтернативное сращивание гена.[3][11][26] Изоформы различаются только 11 аминокислотами на N-конце, и никаких существенных различий в их функциональной активности выявлено не было.
Актуальность болезни
В людях, галактоземия заболевание, которое влияет на развитие новорожденных и детей, поскольку они не могут усваивать сахар. галактоза должным образом. Предполагается, что сверхэкспрессия UDP-глюкозопирофосфорилазы может облегчить симптомы у людей с галактоземией.[27]
В рак ячеек, которые обычно имеют высокие показатели гликолиз и уменьшился гликоген содержание, активность UTP-глюкозо-1-фосфат уридилилтрансферазы часто снижается до 50-60% по сравнению с нормальными клетками.[28] Аномально низкая активность UTP-глюкозо-1-фосфатуридиллилтрансферазы обусловлена снижением уровня фермента и подавлением других ферментов гликогенного пути, включая гликогенсинтаза и фосфоглюкомутаза.
Было обнаружено, что UTP - глюкозо-1-фосфатуридилтрансфераза является важным фактором вирулентности для различных патогенов, включая бактерии и простейшие.[29][30] Например, было обнаружено, что фермент необходим для биосинтеза капсульного полисахарида, важного фактор вирулентности из Пневмококк, бактериальная причина пневмонии, бронхита и других проблем с дыханием.[31] В результате фермент привлек внимание как потенциальная мишень для фармацевтических препаратов. Однако для достижения специфичности лекарственные средства должны быть разработаны так, чтобы специфически воздействовать на аллостерические сайты на поверхности белка, потому что активный сайт высоко консервативен у разных видов.[3]
UDP-глюкозопирофосфорилаза (UGP2) было недавно обнаружено, что оно связано с новым расстройством нервного развития у людей, известным как [32] также упоминается как Синдром Бараката-Перенталера.[33] Это расстройство было впервые описано у 22 человек из 15 семей с тяжелой эпилептической энцефалопатией, задержкой нервного развития с отсутствием практически всех этапов развития, трудноизлечимыми припадками, прогрессирующей микроцефалией, нарушением зрения и аналогичными незначительными дисморфизмами. Баракат и его коллеги идентифицировали повторяющуюся гомозиготную мутацию у всех пораженных индивидуумов (chr2: 64083454A> G), которая мутирует сайт начала трансляции более короткой изоформы белка UGP2. Следовательно, более короткая изоформа белка больше не может продуцироваться у пациентов, несущих гомозиготную мутацию. Функциональные исследования той же группы показали, что короткая изоформа белка обычно преимущественно экспрессируется в человеческом мозге. Следовательно, повторяющаяся мутация приводит к тканеспецифическому отсутствию UGP2 в головном мозге, что приводит к измененному метаболизму гликогена, усилению реакции развернутого белка и преждевременной дифференцировке нейронов. Другие биаллельные мутации потери функции в UGP2 вероятно летальны, поскольку человеческие эмбриональные стволовые клетки, лишенные как коротких, так и длинных изоформ UGP2, неспособны дифференцироваться в кардиомиоциты и клетки крови. Следовательно, идентификация этого нового заболевания также показывает, что специфичные для изоформы мутации start-loss, вызывающие потерю экспрессии тканевой изоформы необходимого белка, могут вызывать генетическое заболевание, даже если отсутствие белка в масштабах всего организма несовместимо с жизнью. Терапии синдрома Бараката-Перенталера в настоящее время не существует.
использованная литература
- ^ Сандхофф К., ван Эхтен Г., Шредер М., Шнабель Д., Сузуки К. (август 1992 г.). «Метаболизм гликолипидов: роль гликолипид-связывающих белков в функции и патобиохимии лизосом». Сделки Биохимического Общества. 20 (3): 695–9. Дои:10.1042 / bst0200695. PMID 1426613.
- ^ Алонсо, доктор медицины, Ломако Дж., Ломако В.М., Уилан В.Дж. (сентябрь 1995 г.). «Новый взгляд на биогенез гликогена». Журнал FASEB. 9 (12): 1126–37. Дои:10.1096 / fasebj.9.12.7672505. PMID 7672505. S2CID 40281321.
- ^ а б c Фюринг Дж. И., Крамер Дж. Т., Шнайдер Дж., Барух П., Герарди-Шахн Р., Федоров Р. (апрель 2015 г.). «Четвертичный механизм обеспечивает сложные биологические функции октамерной человеческой UDP-глюкозопирофосфорилазы, ключевого фермента клеточного метаболизма». Научные отчеты. 5 (1): 9618. Bibcode:2015НатСР ... 5Э9618Ф. Дои:10.1038 / srep09618. ЧВК 5381698. PMID 25860585.
- ^ Ким Х., Чой Дж., Ким Т., Локанатх Н.К., Ха С.К., Су С.В., Хван Х.Й., Ким К.К. (апрель 2010 г.). «Структурные основы механизма реакции UDP-глюкозопирофосфорилазы». Молекулы и клетки. 29 (4): 397–405. Дои:10.1007 / s10059-010-0047-6. PMID 20238176. S2CID 25022544.
- ^ а б c Тоден Дж. Б., Холден Х. М. (июль 2007 г.). «Геометрия активного центра глюкозо-1-фосфатуридилилтрансферазы». Белковая наука. 16 (7): 1379–88. Дои:10.1110 / пс. 072864707. ЧВК 2206702. PMID 17567737.
- ^ Болезни, Сиэтлский центр структурной геномики инфекционных заболеваний (2016 г.). «Кристаллическая структура UDP-глюкозопирофоспорилазы / UTP-глюкозо-1-фосфатуридилилтрансферазы Burkholderia xenovorans». Будут опубликованы. Дои:10.2210 / pdb5j49 / pdb.
- ^ а б Ю Q, Чжэн X (март 2012 г.). «Кристаллическая структура UDP-глюкозопирофосфорилазы человека демонстрирует эффект фиксации, который влияет на ферментативную активность». Биохимический журнал. 442 (2): 283–91. Дои:10.1042 / BJ20111598. PMID 22132858.
- ^ а б Робен А., Плитцко Дж. М., Кёрнер Р., Бёттхер Ю. М., Зигерс К., Хайер-Хартл М., Брахер А. (декабрь 2006 г.). «Структурные основы сборки субъединиц в UDP-глюкозопирофосфорилазе из Saccharomyces cerevisiae». Журнал молекулярной биологии. 364 (4): 551–60. Дои:10.1016 / j.jmb.2006.08.079. PMID 17010990.
- ^ Клечковский Л.А., Гейслер М., Фитцек Э., Вильчинска М. (ноябрь 2011 г.). «Общая структурная схема для растительных пирофосфорилаз, производящих UDP-сахар». Биохимический журнал. 439 (3): 375–9. Дои:10.1042 / BJ20110730. PMID 21992098.
- ^ Флорес-Диас М., Алапе-Хирон А., Перссон Б., Поллеселло П., Моос М., фон Эйхель-Штрейбер С., Телестам М., Флорин I (сентябрь 1997 г.). «Клеточный дефицит UDP-глюкозы, вызванный единственной точечной мутацией в гене UDP-глюкозопирофосфорилазы». Журнал биологической химии. 272 (38): 23784–91. Дои:10.1074 / jbc.272.38.23784. PMID 9295324.
- ^ а б «UGP2 - UTP - глюкозо-1-фосфатуридиллилтрансфераза - Homo sapiens (человек) - ген и белок UGP2». www.uniprot.org. Получено 2017-03-06.
- ^ Мендичино Дж (декабрь 1960 г.). «Синтез фосфата сахарозы в зародышах пшеницы и зеленых листьях». Журнал биологической химии. 235: 3347–52. PMID 13769376.
- ^ Тернквист, Ричард Л .; Хансен, Р. Горт (1973-01-01). «2-уридиндифосфорил-глюкозопирофосфорилаза». В Boyer, Пол Д. (ред.). Ферменты. Групповой перенос. Часть А: перенос нуклеотидила Перенос нуклеозидила Перенос ацила и перенос фосфорила. 8. Академическая пресса. С. 51–71. Дои:10.1016 / S1874-6047 (08) 60062-1. ISBN 9780121227081.
- ^ Вильяр-Паласи С., Ларнер Дж. (Март 1960 г.). «Инсулино-опосредованное действие на активность UDPG-гликоген-трансглюкозилазы мышц». Biochimica et Biophysica Acta. 39: 171–3. Дои:10.1016/0006-3002(60)90142-6. PMID 13842294.
- ^ Bosch AM (август 2006 г.). «Возвращение к классической галактоземии». Журнал наследственных метаболических заболеваний. 29 (4): 516–25. Дои:10.1007 / s10545-006-0382-0. PMID 16838075. S2CID 16382462.
- ^ Сундарараджан Т.А., Рапин А.М., Калькар Х.М. (декабрь 1962 г.). «Биохимические наблюдения за мутантами E. coli, дефектными по уридиндифосфоглюкозе». Труды Национальной академии наук Соединенных Штатов Америки. 48 (12): 2187–93. Bibcode:1962ПНАС ... 48.2187С. Дои:10.1073 / pnas.48.12.2187. ЧВК 221142. PMID 13979281.
- ^ Цубои К.К., Фукунага К., Петриччиани Дж.С. (февраль 1969 г.). «Очистка и специфические кинетические свойства эритроцитарной уридиндифосфатглюкозопирофосфорилазы». Журнал биологической химии. 244 (3): 1008–15. PMID 5782905.
- ^ Zea CJ, Camci-Unal G, Pohl NL (июль 2008 г.). «Термодинамика связывания двухвалентного магния и марганца с уридинфосфатами: последствия для гипомагниемии, связанной с диабетом, и биокатализа углеводов». Центральный журнал химии. 2 (1): 15. Дои:10.1186 / 1752-153х-2-15. ЧВК 2490692. PMID 18627619.
- ^ Густафсон Г.Л., Гандер Дж.Э. (март 1972 г.). «Уридиндифосфатглюкозопирофосфорилаза из Sorghum vulgare. Очистка и кинетические свойства». Журнал биологической химии. 247 (5): 1387–97. PMID 5012314.
- ^ Сивараман Дж., Сове В., Мэтт А, Сайглер М. (ноябрь 2002 г.). «Кристаллическая структура глюкозо-1-фосфат-тимидилилтрансферазы Escherichia coli (RffH) в комплексе с dTTP и Mg2 +». Журнал биологической химии. 277 (46): 44214–9. Дои:10.1074 / jbc.M206932200. PMID 12171937.
- ^ Раттер Дж., Пробст Б.Л., Макнайт С.Л. (октябрь 2002 г.). «Координированная регуляция сахарного потока и трансляции киназой PAS». Ячейка. 111 (1): 17–28. Дои:10.1016 / s0092-8674 (02) 00974-1. PMID 12372297. S2CID 6883785.
- ^ Клечковский Л.А., Гейслер М., Церешко И., Йоханссон Х. (март 2004 г.). «UDP-глюкозопирофосфорилаза. Старый белок с новыми хитростями». Физиология растений. 134 (3): 912–8. Дои:10.1104 / стр.103.036053. ЧВК 523891. PMID 15020755.
- ^ Komatsu S, Yamada E, Furukawa K (январь 2009 г.). «Холодовой стресс изменяет конканавалин А-позитивный паттерн гликозилирования белков, экспрессируемых в базальных частях оболочки рисового листа». Аминокислоты. 36 (1): 115–23. Дои:10.1007 / s00726-008-0039-4. PMID 18278531. S2CID 1797342.
- ^ Менг М., Гейслер М., Йоханссон Х., Хархольт Дж., Шеллер Х.В., Меллерович Э.Дж., Клечковски Л.А. (май 2009 г.). «UDP-глюкозопирофосфорилаза не ограничивает скорость, но необходима для Arabidopsis». Физиология растений и клеток. 50 (5): 998–1011. Дои:10.1093 / pcp / pcp052. PMID 19366709.
- ^ Уэллс, Лэнс; Харт, Джеральд В. (2003-07-03). «O-GlcNAc исполняется двадцать лет: функциональное значение для посттрансляционной модификации ядерных и цитозольных белков с сахаром». Письма FEBS. 546 (1): 154–158. Дои:10.1016 / S0014-5793 (03) 00641-0. ISSN 1873-3468. PMID 12829252. S2CID 24587552.
- ^ Дагглби Р.Г., Чао Ю.К., Хуан Дж. Г., Пэн Х.Л., Чанг ХЙ (Январь 1996 г.). «Различия в последовательностях кДНК мышц и печени человека для UDP-глюкозопирофосфорилазы и кинетических свойств рекомбинантных ферментов, экспрессируемых в Escherichia coli». Европейский журнал биохимии. 235 (1–2): 173–9. Дои:10.1111 / j.1432-1033.1996.00173.x. PMID 8631325.
- ^ Лай К., Эльзас Л.Дж. (май 2000 г.). «Сверхэкспрессия человеческой UDP-глюкозопирофосфорилазы спасает дрожжи с дефицитом галактозо-1-фосфатуридилтрансферазы». Сообщения о биохимических и биофизических исследованиях. 271 (2): 392–400. Дои:10.1006 / bbrc.2000.2629. PMID 10799308.
- ^ Нигам В. Н., Макдональд Х. Л., Кантеро А. (февраль 1962 г.). «Ограничивающие факторы для хранения гликогена в опухолях. I. Ограничивающие ферменты». Исследования рака. 22 (2): 131–8. PMID 14479721.
- ^ Цзян СС, Линь Т.Ю., Ван В.Б., Лю М.С., Сюэ ПР, Лиав С.Дж. (май 2010 г.). «Характеристика мутантов UDP-глюкозодегидрогеназы и UDP-глюкозопирофосфорилазы Proteus mirabilis: дефектность в устойчивости к полимиксину B, скопление и вирулентность». Противомикробные препараты и химиотерапия. 54 (5): 2000–9. Дои:10.1128 / AAC.01384-09. ЧВК 2863647. PMID 20160049.
- ^ Klein KA, Fukuto HS, Pelletier M, Romanov G, Grabenstein JP, Palmer LE, Ernst R, Bliska JB (февраль 2012 г.). «Скрининг гибридизации сайта транспозона идентифицирует galU и wecBC как важные для выживания Yersinia pestis в мышиных макрофагах». Журнал бактериологии. 194 (3): 653–62. Дои:10.1128 / JB.06237-11. ЧВК 3264090. PMID 22139502.
- ^ Bonofiglio L, García E, Mollerach M (октябрь 2005 г.). «Биохимическая характеристика пневмококковой глюкозо-1-фосфат-уридилилтрансферазы (GalU), необходимой для биосинтеза капсул». Современная микробиология. 51 (4): 217–21. Дои:10.1007 / s00284-005-4466-0. PMID 16132460. S2CID 13591083.
- ^ Перенталер Э., Никончук А., Юсефи С., Бердовски В.М., Альсагоб М., Капо I и др. (Март 2020 г.). «Потеря UGP2 в головном мозге приводит к тяжелой эпилептической энцефалопатии, что подчеркивает, что биаллельные изоформ-специфичные мутации старт-потери основных генов могут вызывать генетические заболевания». Acta Neuropathologica. 139 (3): 415–442. Дои:10.1007 / s00401-019-02109-6. ЧВК 7035241. PMID 31820119.
- ^ "# 618744: Эпилептическая энцефалопатия, младенческий возраст 83; EIEE83". Онлайн-менделевское наследование в человеке (OMIM).
внешняя ссылка
- UDP + глюкоза + пирофосфорилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)