WikiDer > ДНК-полимераза Т7 - Википедия
| ДНК-направленная ДНК-полимераза | |||||||
|---|---|---|---|---|---|---|---|
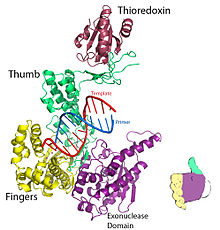 Рисунок 1. Кристаллическая структура репликационного комплекса ДНК Т7. Отрисовано из PDB 1T7P. | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | 5 | ||||||
| Количество CAS | 9012-90-2 | ||||||
| UniProt | P00581 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 2.7.7.7 | ||||||
| |||||||
ДНК-полимераза Т7 является фермент использовался во время Репликация ДНК из Бактериофаг Т7. Во время этого процесса ДНК-полимераза «Читает» существующие нити ДНК и создает две новые нити, соответствующие уже существующим. ДНК-полимераза Т7 требует фактора хозяина, Кишечная палочка тиоредоксин,[1] для выполнения своей функции. Это помогает стабилизировать связывание необходимого белка с праймером-шаблоном для улучшения процессивность более чем в 100 раз, что является уникальной особенностью этого фермента.[2] Он является членом семейства ДНК-полимераз А, в которое входят: Кишечная палочка ДНК-полимераза I и ДНК-полимераза Taq.
Эта полимераза имеет различные применения в сайт-направленный мутагенез[3] а также фермент с высокой точностью, подходящий для ПЦР.[4] Он также служил предшественником секвеназы,[5] сконструированный фермент, оптимизированный для Секвенирование ДНК.[6]
Механизм
Перенос фосфорила
фигура 2. Перенос нуклеотидила ДНК-полимеразой.
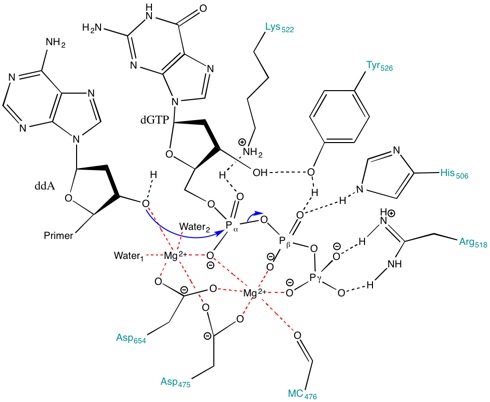
ДНК-полимераза Т7 катализирует перенос фосфорила [7] в течение Репликация ДНК из Фаг Т7. Как показано в фигура 2, 3 ’ гидроксил группа грунтовка действует как нуклеофил и атакует фосфодиэфирная связь из нуклеозид 5’-трифосфат (дТМП-ПП). Эта реакция добавляет нуклеозид монофосфат в ДНК и высвобождает пирофосфат (PPi). Обычно реакция зависит от металла, и катионы, такие как Mg2+ часто присутствуют в активном центре фермента.[7]
Для ДНК-полимеразы Т7 пальцы, ладонь и большой палец (Рисунок 1) расположите праймер-матрицу так, чтобы 3’-конец цепи праймера располагался рядом с сайтом связывания нуклеотидов (расположен на пересечении пальцев и большого пальца).[8] Базовая пара, образованная между нуклеотид а основа шаблона хорошо входит в паз между пальцами и концом праймера с 3-мя концами.[8] Два мг2+ ионы образуют октаэдрическую координатную сетку с кислородом лиганд а также сблизить реактивный гидроксил праймера и α-фосфат нуклеотида, тем самым снижая энтропийная стоимость из нуклеофильное присоединение.[8] В ограничивающий шаг в каталитический цикл происходит после связывания нуклеозидтрифосфата и до того, как он включается в ДНК (что соответствует закрытию субдомена пальцев вокруг ДНК и нуклеотида).[8]
Роль Mg2+ ионы и аминокислотные остатки в активном центре
Аминокислоты, присутствующие в активном центре, способствуют созданию стабилизирующей среды для протекания реакции. Аминокислоты, такие как Lys522, Tyr526, Его506 и Arg518 вести себя как доноры водородных связей. В позвоночник карбонил из Ala476, Asp475 и Asp654 форма координировать облигации с Mg2+ ионы.
Asp475 и Asp654 образуют мостик с Mg2+ катионы, чтобы правильно их ориентировать. Mg2+ ион справа (Рисунок 3) взаимодействует с отрицательно заряженными атомами кислорода альфа (α), бета (β) и гамма (γ) фосфатов для выравнивания ножничная связка для праймера атаковать.[8] Даже если нет общая база в пределах активный сайт чтобы депротонировать гидроксил праймера, пониженный pka гидроксила, связанного с металлом, способствует образованию 3’-гидроксида нуклеофила.[8] Ионы металлов и Lys522 контактируют с кислородом без образования мостиков на α-фосфате, чтобы стабилизировать отрицательный заряд, развивающийся на α-фосфоре во время образования связи с нуклеофилом.
Более того, боковая цепь Lys522 также перемещается, чтобы нейтрализовать отрицательно заряженную пирофосфатную группу. Боковые цепи Tyr526, His506, Arg518 и кислород из карбонильной группы основной цепи Ala476 принимают участие в водородная связь сети и способствуют выравниванию субстрата для переноса фосфорила.[8]
Дополнительные белки

Пока фаг Т7 опосредует Репликация ДНК Подобно высшим организмам, система Т7, как правило, проще по сравнению с другими системами репликации. В дополнение к Т7 ДНК-полимераза (также известный как gp5), T7 ответственный Для правильного функционирования требуется только четыре дополнительных белка: тиоредоксин хозяина, gp4, gp2.5 и gp1.7.
Тиоредоксин хозяина
Полимераза Т7 сама по себе имеет очень низкий процессивность. Он отделяется от грунтовка-шаблон после включения примерно 15 нуклеотидов. При инфицировании хозяина полимераза Т7 связывается с хозяином. тиоредоксин в соотношении 1: 1. В гидрофобное взаимодействие между тиоредоксином и полимеразой Т7 помогает стабилизировать связывание полимеразы Т7 с грунтовка-шаблон. Кроме того, связывание тиоредоксина увеличивает процессивность полимеразы Т7 почти в 80 раз.[9] Точный механизм того, как комплекс полимеразы тиоредоксин-Т7 может достигать такого увеличения процессивности, все еще неизвестен. Связывание тиоредоксина открывает большое количество основных аминокислота остатки полимеразы Т7 в области большого пальца. Несколько исследований предполагают, что электростатическое взаимодействие между этими положительно заряженными основными остатками с отрицательно заряженным фосфатным остовом ДНК и другие вспомогательные белки ответственны за повышенную процессивность в комплексе gp5 / тиоредоксин.[9][10][11]
gp4
gp4 - гексамерный белок, содержащий два функциональных домена: геликаза домен и прима Домен геликазы раскручивает двухцепочечную ДНК, обеспечивая матрицу для репликации. В С-концевой хвост геликазного домена содержит несколько отрицательно заряженных кислотных остатков, которые контактируют с открытым основным остатком полимеразы Т7 / тиоредоксина. Эти взаимодействия помогают загрузить комплекс полимераза Т7 / тиоредоксин на вилка репликации. Примазный домен катализирует синтез коротких олигорибонуклеотиды. Эти олигорибонуклеотиды, называемые грунтовки, являются дополнительными к цепочке матрицы и используются для инициирования Репликация ДНК. В системе Т7 примазный домен одной субъединицы взаимодействует с примазным доменом соседней субъединицы. Это взаимодействие между примазными доменами действует как тормоз для остановки геликазы, когда это необходимо, что обеспечивает ведущий стенд синтез в ногу с отставший стенд синтез.[11]
gp2.5
| Одноцепочечный ДНК-связывающий белок | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | 2.5 | ||||||
| UniProt | P03696 | ||||||
| |||||||
gp2.5 имеет аналогичную функцию одноцепочечный ДНК-связывающий белок. gp2.5 защищает одноцепочечную ДНК, образующуюся во время репликации, и координирует синтез ведущих и отстающих цепей за счет взаимодействия между ее кислотным C-концевым хвостом и gp5 / тиоредоксином.[11]
gp1.7
| Нуклеотидкиназа | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | 1.7 | ||||||
| UniProt | P03781 | ||||||
| |||||||
gp1.7 представляет собой нуклеозидмонофосфаткиназу, которая катализирует превращение дезоксинуклеозид-5'-монофосфатов в ди- и трифосфатные нуклеотиды, что объясняет чувствительность полимеразы Т7 к дидезоксинуклеотиды (видеть Секвеназа ниже).[11]
Характеристики
Процессивность
Первичная субъединица gp5 ДНК-полимеразы Т7 сама по себе имеет низкую процессивность и диссоциирует от ДНК после включения всего нескольких нуклеотидов. Чтобы стать эффективно процессивным, ДНК-полимераза Т7 рекрутирует хозяина. тиоредоксин с образованием комплекса тиоредоксин-gp5. Тиоредоксин связывает тиоредоксин-связывающий домен gp5, тем самым стабилизируя гибкую ДНК-связывающую область gp5. Стабилизация этой области gp5 алостерически увеличивает степень взаимодействия поверхности белка с дуплексной частью праймер-матрицы. Полученный в результате комплекс тиоредоксин-gp5 увеличивает сродство полимеразы Т7 к концу праймера примерно в 80 раз и действует процессивно примерно на 800 стадий включения нуклеотидов.[12]
Механизм, принятый полимеразой Т7 для достижения своей процессивности, отличается от многих других полимераз тем, что он не зависит от Зажим ДНК или загрузчик зажима. Вместо этого комплексу ДНК-полимеразы Т7 требуются только три белка для процессной полимеризации ДНК: полимераза Т7 (gp5), тиоредоксин Escherichia coli и одноцепочечный ДНК-связывающий белок gp2.5.[13] Хотя эти три белка являются единственными, необходимыми для матричной одноцепочечной полимеризации ДНК, в естественных биологических условиях тиоредоксин-gp5 взаимодействует с gp4-геликазой, которая обеспечивает матрицу одноцепочечной ДНК (рис. 4). Во время синтеза ведущей цепи тиоредоксин-gp5 и gp4 образуют комплекс с высоким сродством, увеличивая общую процессивность полимеразы примерно до 5 т.п.н.[14][15]
Экзонуклеазная активность
ДНК-полимераза Т7 обладает 3’-5 ’одно- и двухцепочечной ДНК. экзонуклеаза Мероприятия. Эта экзонуклеазная активность активируется, когда вновь синтезированное основание неправильно спаривается с цепью матрицы. Удаление неправильно введенных оснований действует как механизм корректуры, повышая точность полимеразы Т7.[4] Во время ранней характеристики экзонуклеазной активности было обнаружено, что катализируемое железом окисление полимеразы Т7 дает модифицированный фермент со значительно сниженной экзонуклеазной активностью. Это открытие привело к разработке и использованию полимеразы Т7 в качестве секвеназа в ранних методах секвенирования ДНК.[16]
Механизм, с помощью которого ДНК-полимераза Т7 определяет включение несовпадающего основания, все еще остается предметом изучения. Однако некоторые исследования предоставили доказательства того, что изменения натяжения нити матричной ДНК, вызванные несоответствием пар оснований, могут вызывать активацию экзонуклеазы. Wuite et al. наблюдали, что приложение натяжения более 40 пН к матричной ДНК приводило к 100-кратному увеличению экзонуклеазной активности.[17]
Приложения
Удлинения цепи в сайт-направленном мутагенезе
Сайт-направленный мутагенез это молекулярная биология метод, который используется для внесения конкретных и преднамеренных изменений в Последовательность ДНК из ген и любой генные продукты. Этот метод был разработан в то время, когда самой высококачественной коммерчески доступной ДНК-полимеразой для преобразования олигонуклеотида в полную комплементарную цепь ДНК был большой (по Кленову) фрагмент ДНК-полимеразы 1 E. coli. Однако этап лигирования может стать проблемой с олигонуклеотидом. мутагенез. То есть, когда ДНК-лигаза действует неэффективно по сравнению с ДНК-полимеразой, смещение цепи олигонуклеотида может снизить частоту мутантов. С другой стороны, ДНК-полимераза Т7 не выполняет синтез замещения цепи; и, таким образом, может быть использован для получения высоких частот мутантов для точечных мутантов независимо от лигирования.[18]
Синтез второй цепи кДНК
Клонирование кДНК - основная технология анализа экспрессии геномов. Полноразмерную первую цепь можно синтезировать с помощью коммерчески доступных обратных транскриптаз. Синтез второй цепи когда-то был основным ограничением клонирования кДНК. Для синтеза второй цепи были разработаны две группы методов, различающихся механизмом инициирования. В первой группе методов инициация синтеза второй цепи происходит в последовательности первой цепи. Однако требуется переваривание 3'-конца первой цепи, что приводит к потере последовательностей, соответствующих 5'-концу мРНК. Во второй группе методов инициация синтеза второй цепи происходит вне последовательности первой цепи. Эта группа методов не требует переваривания 3'-конца первой нити. Однако ограничение этой группы методов связано с удлинением. Клонирование с помощью ДНК-полимеразы Т7 помогает преодолеть это ограничение, позволяя переваривать поли (dT) тракт во время реакции синтеза второй цепи. Следовательно, размер тракта, синтезированного с помощью терминальной трансферазы, не обязательно должен находиться в пределах данного диапазона размеров, и полученные клоны содержат тракт ограниченного размера. Кроме того, благодаря высокой 3’-экзонуклеазной активности ДНК-полимеразы Т7 может быть получен высокий выход полноразмерной второй цепи.[19]
Секвеназа (секвенирование ДНК)
В Секвенирование по Сэнгеру, одна из основных проблем, связанных с ДНК-полимеразами, - это дискриминация дидезоксинуклеотидов, нуклеотидов, обрывающих цепь. Большинство известных ДНК-полимераз сильно дискриминируют ddNTP; и, таким образом, высокое отношение ddNTP к dNTP должно использоваться для эффективного обрыва цепи. ДНК-полимераза Т7 дискриминирует ddNTP только в несколько раз; и, таким образом, требует гораздо более низкой концентрации ddNTP для обеспечения высокой однородности полос ДНК на геле. Однако его сильная 3’-5 ’экзонуклеазная активность может нарушить секвенирование, поскольку, когда концентрация dNTP падает, экзонуклеазная активность увеличивается, что приводит к отсутствию чистого синтеза ДНК или деградации ДНК. Чтобы использовать для секвенирования ДНК, ДНК-полимераза Т7 была модифицирована для удаления ее экзонуклеазной активности химическим путем (Sequenase 1.0) или путем делеции остатков (Sequenase Version 2.0).[4][20]
Рекомендации
- ^ Марк Д.Ф., Ричардсон СС (март 1976 г.). «Тиоредоксин Escherichia coli: субъединица ДНК-полимеразы бактериофага Т7». Труды Национальной академии наук Соединенных Штатов Америки. 73 (3): 780–4. Bibcode:1976ПНАС ... 73..780М. Дои:10.1073 / пнас.73.3.780. ЧВК 336002. PMID 768986.
- ^ Tabor S, Huber HE, Richardson CC (ноябрь 1987 г.). «Тиоредоксин Escherichia coli придает процессивность ДНК-полимеразной активности белка гена 5 бактериофага Т7». Журнал биологической химии. 262 (33): 16212–23. PMID 3316214.
- ^ Венкитараман А.Р. (апрель 1989 г.). «Использование модифицированной ДНК-полимеразы Т7 (версия 2.0 секвеназы) для сайт-направленного мутагенеза олигонуклеотидов». Исследования нуклеиновых кислот. 17 (8): 3314. Дои:10.1093 / nar / 17.8.3314. ЧВК 317753. PMID 2726477.
- ^ а б c Чжу Б. (16 апреля 2014 г.). «ДНК-полимераза бактериофага Т7 - секвеназа». Границы микробиологии. 5: 181. Дои:10.3389 / fmicb.2014.00181. ЧВК 3997047. PMID 24795710.
- ^ «ДНК-полимераза термосеквеназы».
- ^ Воет Д., Воет Дж. Г. (2011). Биохимия (4-е изд.). Хобокен, Нью-Джерси: Джон Уайли и сыновья. ISBN 9780470917459.
- ^ а б Фершт, Алан (1985). Структура и механизм фермента (2-е изд.). Нью-Йорк: W.H. Фримен. ISBN 9780716716143.
- ^ а б c d е ж грамм Дубле С., Элленбергер Т. (декабрь 1998 г.). «Механизм действия ДНК-полимеразы Т7». Текущее мнение в структурной биологии. 8 (6): 704–12. Дои:10.1016 / s0959-440x (98) 80089-4. PMID 9914251.
- ^ а б Бедфорд Э., Табор С., Ричардсон С.С. (январь 1997 г.). «Тиоредоксин-связывающий домен ДНК-полимеразы бактериофага Т7 придает процессивность ДНК-полимеразе I Escherichia coli». Труды Национальной академии наук Соединенных Штатов Америки. 94 (2): 479–84. Bibcode:1997PNAS ... 94..479B. Дои:10.1073 / пнас.94.2.479. ЧВК 19538. PMID 9012809.
- ^ Гош С., Хамдан С.М., Кук Т.Э., Ричардсон С.К. (ноябрь 2008 г.). «Взаимодействие тиоредоксина Escherichia coli, фактора процессивности, с ДНК-полимеразой и геликазой бактериофага Т7». Журнал биологической химии. 283 (46): 32077–84. Дои:10.1074 / jbc.M805062200. ЧВК 2581581. PMID 18757858.
- ^ а б c d Ли SJ, Ричардсон CC (октябрь 2011 г.). «Хореография репликации ДНК бактериофага Т7». Современное мнение в области химической биологии. 15 (5): 580–6. Дои:10.1016 / j.cbpa.2011.07.024. ЧВК 3195405. PMID 21907611.
- ^ Ричардсон, CC (1983). «Бактериофаг Т7: минимальные требования для репликации дуплексной молекулы ДНК». Клетка. 33 (2): 315–317. Дои:10.1016/0092-8674(83)90411-7. PMID 6344999.
- ^ Кельман З., Гурвиц Дж., О'Доннелл М. (февраль 1998 г.). «Процессивность ДНК-полимераз: два механизма, одна цель». Структура. 6 (2): 121–5. Дои:10.1016 / s0969-2126 (98) 00014-8. PMID 9519403.
- ^ Акабеков Б., Акабеков С.Р., Ли С.Дж., Табор С., Кульчик А.В., Ричардсон С.К. (август 2010 г.). «Конформационная динамика ДНК-полимеразы бактериофага Т7 и фактор ее процессивности, тиоредоксина Escherichia coli». Труды Национальной академии наук Соединенных Штатов Америки. 107 (34): 15033–8. Bibcode:2010PNAS..10715033A. Дои:10.1073 / pnas.1010141107. ЧВК 2930546. PMID 20696935.
- ^ Хамдан С.М., Джонсон Д.Е., Таннер Н.А., Ли Дж. Б., Кимрон Ю., Табор С., ван Ойен А. М., Ричардсон С.С. (август 2007 г.). «Динамические взаимодействия ДНК-геликазы и ДНК-полимеразы обеспечивают процессивное движение репликационной вилки» (PDF). Молекулярная клетка. 27 (4): 539–49. Дои:10.1016 / j.molcel.2007.06.020. PMID 17707227.
- ^ Табор С., Ричардсон СС (ноябрь 1987 г.). «Селективное окисление экзонуклеазного домена ДНК-полимеразы бактериофага Т7». Журнал биологической химии. 262 (32): 15330–3. PMID 2824455.
- ^ Wuite GJ, Smith SB, Young M, Keller D, Bustamante C (март 2000 г.). «Одномолекулярные исследования влияния натяжения матрицы на активность ДНК-полимеразы Т7». Природа. 404 (6773): 103–6. Bibcode:2000Натурал 404..103Вт. Дои:10.1038/35003614. PMID 10716452. S2CID 2270107.
- ^ Бебенек К., Кункель Т.А. (июль 1989 г.). «Использование нативной ДНК-полимеразы Т7 для сайт-направленного мутагенеза». Исследования нуклеиновых кислот. 17 (13): 5408. Дои:10.1093 / nar / 17.13.5408. ЧВК 318147. PMID 2668888.
- ^ Бодескот М., Брисон О. (сентябрь 1994 г.). «Эффективный синтез второй цепи кДНК с использованием ДНК-полимеразы Т7». ДНК и клеточная биология. 13 (9): 977–85. Дои:10.1089 / dna.1994.13.977. PMID 7522464.
- ^ Фуллер, CW; McArdle, BF; Гриффин, AM; Гриффин, HG (1996). Секвенирование ДНК с использованием секвенирования версии 2.0 ДНК-полимеразы Т7. Методы молекулярной биологии. 58. С. 373–87. Дои:10.1385 / 0-89603-402-X: 373. ISBN 0-89603-402-X. PMID 8713887.