WikiDer > Тирозин
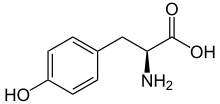 L-Тирозин | |
 L-Тирозин при физиологическом pH | |
| Имена | |
|---|---|
| Название ИЮПАК (S) -Тирозин | |
| Другие имена L-2-амино-3- (4-гидроксифенил) пропановая кислота | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.419 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C9ЧАС11NО3 | |
| Молярная масса | 181.191 г · моль−1 |
| 0,0453 г / 100 мл | |
| -105.3·10−6 см3/ моль | |
| Опасности | |
| Паспорт безопасности | Видеть: страница данных |
| NFPA 704 (огненный алмаз) | |
| Страница дополнительных данных | |
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ |
| УФ, ИК, ЯМР, РС | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
L-Тирозин или же тирозин (символ Тюр или же Y)[1] или же 4-гидроксифенилаланин один из 20 стандартных аминокислоты которые используются клетки к синтезировать белки. Это заменимая аминокислота с полярная боковая группа. Слово «тирозин» происходит от Греческий Tyrós, смысл сыр, поскольку он был впервые обнаружен в 1846 году немецким химиком Юстус фон Либих в белке казеин из сыра.[2][3] Это называется тирозил когда упоминается как функциональная группа или боковая цепь. Хотя тирозин обычно классифицируется как гидрофобный аминокислота, она более гидрофильна, чем фенилаланин.[4] это закодированный посредством кодоны ОАК и UAU в информационная РНК.
Функции
Помимо того, что протеиногенная аминокислота, тирозин играет особую роль в силу фенол функциональность. Он встречается в белках, входящих в состав преобразование сигнала процессов и функционирует как приемник фосфатных групп, которые передаются посредством протеинкиназы. Фосфорилирование гидроксильной группы может изменять активность целевого белка или может образовывать часть сигнального каскада через связывание с доменом SH2.
Остаток тирозина также играет важную роль в фотосинтез. В хлоропласты (фотосистема II), он действует как донор электронов в снижение окисленных хлорофилл. В этом процессе он теряет атом водорода своей фенольной ОН-группы. Этот радикал впоследствии восстанавливается в фотосистеме II четырьмя остовными кластерами марганца.
Диетические требования и источники
В Рекомендуемая диета (рекомендуемая диета, RDA) для фенилаланина и тирозина составляет 33 мг на килограмм веса тела или 15 мг на фунт.[5][нужен лучший источник] Для человека весом 70 кг это 2,31 г (фенилаланин + тирозин).
Тирозин, который также может синтезироваться в организме из фенилаланин, содержится во многих высокихбелок пищевые продукты, такие как курица, индюк, рыбы, молоко, йогурт, творог, сыр, арахис, миндаль, семена тыквы, семена кунжута, соевые продукты и лимская фасоль, но и в авокадо и бананы.[6] Например, яичный белок содержит около 250 мг на яйцо,[5] в то время как постная говядина / баранина / свинина / лосось / курица / индейка содержит около 1 г на порцию в 3 унции (85 г).[5]
Биосинтез

У растений и большинства микроорганизмов тыр производится через префенат, промежуточное звено на путь шикимата. Префенат окислительно декарбоксилированный с сохранением гидроксил группа, чтобы дать п-гидроксифенилпируват, который является трансаминированный с помощью глутамат в качестве источника азота для получения тирозина и α-кетоглутарат.
Млекопитающие синтезировать тирозин из незаменимой аминокислоты фенилаланин (phe), который получают с пищей. Преобразование phe к тыр катализируется фермент фенилаланингидроксилаза, монооксигеназа. Этот фермент катализирует реакцию, вызывающую присоединение гидроксильной группы к концу ароматического кольца с 6 атомами углерода. фенилаланин, так что он становится тирозином.
Метаболизм
Фосфорилирование и сульфатирование
Некоторые остатки тирозина могут быть отмечен (по гидроксильной группе) с фосфатной группой (фосфорилированный) к протеинкиназы. В фосфорилированной форме тирозин называется фосфотирозин. Фосфорилирование тирозина считается одним из ключевых шагов в передаче сигнала и регуляции ферментативной активности. Фосфотирозин можно обнаружить с помощью специфических антитела. Остатки тирозина также можно модифицировать добавлением сульфатной группы, процесс, известный как сульфатирование тирозина.[7] Сульфатирование тирозина катализируется тирозилпротеинсульфотрансферазой (TPST). Как и упомянутые выше фосфотирозиновые антитела, недавно антитела[требуется разъяснение] были описаны, которые конкретно определяют сульфотирозин.
Предшественник нейротрансмиттеров и гормонов
В дофаминергических клетках в мозг, тирозин превращается в L-ДОПА посредством фермент тирозингидроксилаза (TH). TH - это ограничивающий скорость фермент участвует в синтезе нейротрансмиттер дофамин. Затем дофамин может быть преобразован в другие катехоламины, Такие как норэпинефрин (норадреналин) и адреналин (адреналин).
В щитовидная железа гормоны трийодтиронин (Т3) и тироксин (Т4) в коллоид из щитовидная железа также происходят из тирозина.
Предшественник алкалоидов
Латекс Папавер сомниферум, опийный мак, превращает тирозин в алкалоид морфий и был установлен биосинтетический путь от тирозина до морфина с использованием радиоактивно меченного углеродом-14 тирозина для отслеживания пути синтеза in vivo.[нужна цитата]
Предшественник природных фенолов
Тирозин аммиаклиаза (TAL) - это фермент в пути биосинтеза природных фенолов. Он превращает L-тирозин в п-кумаровая кислота.
Предшественник пигментов
Тирозин также является предшественником пигмента. меланин.
Роль в синтезе коэнзима Q10
Тирозин (или его предшественник фенилаланин) необходим для синтеза структуры бензохинона, которая является частью Коэнзим Q10.
Деградация

Разложение L-тирозина (син. параграф-гидроксифенилаланин) начинается с α-кетоглутарата зависимого трансаминирование сквозь тирозинтрансаминаза к параграф-гидроксифенилпируват. Позиционное описание параграф, сокращенно п, означают, что гидроксильная группа и боковая цепь фенильного кольца расположены напротив друг друга (см. иллюстрацию ниже).
Следующая стадия окисления катализируется п-гидроксифенилпируват диоксигеназа и отщепление CO2 гомогентизат (2,5-дигидроксифенил-1-ацетат).[11] Чтобы разделить ароматическое кольцо гомогентизата, дополнительная диоксигеназа, гомогентизат 1,2-диоксигеназа необходимо. Таким образом, за счет включения еще одного O2 молекула малейлацетоацетат создано.
Фумарилацетоацетат создан малейлацетоацетат СНГ-транс-изомераза путем вращения карбоксильной группы, образованной из гидроксильной группы путем окисления. Этот цис-транс-изомераза содержит глутатион как кофермент. Фумарилацетоацетат окончательно расщепляется ферментом фумарилацетоацетат гидролаза за счет добавления молекулы воды.
Тем самым фумарат (также метаболит цикла лимонной кислоты) и ацетоацетат (3-кетобутироат) высвобождаются. Ацетоацетат - это кетоновое тело, который активируется сукцинил-КоА, и после этого он может быть преобразован в ацетил-КоА, который, в свою очередь, может окисляться цикл лимонной кислоты или использоваться для синтез жирных кислот.
Флоретиновая кислота также является метаболитом тирозина в моче крыс.[12]
Орто- и метатирозин

Три структурные изомеры L-тирозина известны. В дополнение к обычной аминокислоте L-тирозин, которая является пара-изомер (параграф-тыр, п-tyr или 4-гидроксифенилаланин), есть два дополнительных региоизомера, а именно мета-тирозин (также известен как 3-гидроксифенилаланин, L-м-тирозин, и м-тыр) и орто-тирозин (о-тир или 2-гидроксифенилаланин), встречающиеся в природе. В м-тыр и о-tyr изомеры, которые встречаются редко, возникают в результате неферментативных свободный радикал гидроксилирование фенилаланина в условиях окислительный стресс.[13][14]
м-тирозин и его аналоги (редко встречающиеся в природе, но доступные синтетически) нашли применение в болезнь Паркинсона, Болезнь Альцгеймера и артрит.[15]
Медицинское использование
Тирозин является предшественником нейротрансмиттеры и увеличивает уровни нейромедиаторов в плазме (особенно дофамина и норадреналина),[16] но практически не влияет на настроение у нормальных людей.[17][18][19] Тем не менее, ряд исследований показал, что тирозин полезен в условиях стресса, холода, усталости (у мышей),[20] длительная работа и недосыпание,[21][22] со снижением уровня гормона стресса,[23] снижение вызванной стрессом потери веса, наблюдаемое в испытаниях на животных,[20] и улучшения когнитивной и физической работоспособности[18][24][25] видели в человеческих испытаниях.
Тирозин, по-видимому, не оказывает значительного влияния на когнитивные или физические способности в нормальных условиях.[26][27] но помогает лучше поддерживать рабочую память во время многозадачности.[28]
Промышленный синтез
L-тирозин и его производные (L-ДОПА, меланин, фенилпропаноиды, и др.) используются в фармацевтические препараты, пищевые добавки, и пищевые добавки. Ранее для производства L-тирозина использовались два метода. Первый включает извлечение нужной аминокислоты из гидролизатов белка с использованием химического подхода. Второй использует ферментативный синтез из фенолов, пирувата и аммиака за счет использования тирозинфеноллиаза.[29] Достижения в генная инженерия и появление промышленная ферментация перенесли синтез L-тирозина на использование искусственно созданных штаммов Кишечная палочка.[30][31][32]
Смотрите также
- Альбинизм
- Алькаптонурия
- Беталаин
- Йодированные производные тирозина
- Поли реакция
- Тирамин
- Сульфатирование тирозина
- Тирозинемия
Рекомендации
- ^ «Номенклатура и символика аминокислот и пептидов». Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983 г. В архиве из оригинала от 9 октября 2008 г.. Получено 5 марта 2018.
- ^ «Тирозин». Колумбийская электронная энциклопедия, 6-е изд.. Infoplease.com - Издательство Колумбийского университета. 2007 г.. Получено 2008-04-20.
- ^ Дуглас Харпер (2001). «Тирозин». Интернет-словарь этимологии. Получено 2008-04-20.
- ^ «Аминокислоты - Тирозин». www.biology.arizona.edu. Получено 2018-01-31.
- ^ а б c 10 лучших продуктов с самым высоким содержанием тирозина
- ^ «Тирозин». Медицинский центр Университета Мэриленда. Получено 2011-03-17.
- ^ Хоффайнс А.Дж., Дамок Э., Бриджес К.Г., Лири Дж.А., Мур К.Л. (2006). «Обнаружение и очистка тирозин-сульфатированных белков с использованием нового моноклонального антитела против сульфтирозина». J. Biol. Chem. 281 (49): 37877–87. Дои:10.1074 / jbc.M609398200. ЧВК 1764208. PMID 17046811.CS1 maint: использует параметр авторов (связь)
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ Зеа-Рей, Александра В .; Крус-Камино, Эктор; Васкес-Канту, Диана Л .; Gutiérrez-García, Valeria M .; Сантос-Гусман, Хесус; Канту-Рейна, Консуэло (27 ноября 2017 г.). «Заболеваемость преходящей неонатальной тирозинемией среди населения Мексики». Журнал врожденных ошибок метаболизма и скрининга. 5: 232640981774423. Дои:10.1177/2326409817744230.
- ^ Бут, А Н; Masri, M S; Роббинс, Д. Дж .; Эмерсон, О. Х .; Джонс, Фортун; Дело, F (1960). «Метаболизм тирозина с фенольной кислотой в моче». Журнал биологической химии. 235 (9): 2649–2652.
- ^ Мольнар Г.А., Вагнер З., Марко Л., Ко Сеги Т., Мохас М., Кочиш Б., Матус З., Вагнер Л., Тамаско М., Мазак И., Лачи Б., Надь Дж., Виттманн И. (2005). «Экскреция орто-тирозина с мочой при сахарном диабете и почечной недостаточности: данные о продукции гидроксильных радикалов». Почка Int. 68 (5): 2281–7. Дои:10.1111 / j.1523-1755.2005.00687.x. PMID 16221230.CS1 maint: использует параметр авторов (связь)
- ^ Мольнар Г.А., Немеш В., Биро З., Лудани А., Вагнер З., Виттманн I (2005). «Накопление гидроксильных маркеров свободных радикалов, мета, орто-тирозина и ДОФА в катарактных линзах сопровождается более низким содержанием белка и фенилаланина в водорастворимой фазе». Свободный Радич. Res. 39 (12): 1359–66. Дои:10.1080/10715760500307107. PMID 16298866.CS1 maint: использует параметр авторов (связь)
- ^ Хамфри, Кара Э .; Фурегати, Маркус; Лаумен, Курт; Ла Веккья, Луиджи; Лейтерт, Томас; Müller-Hartwieg, J. Constanze D .; Фогтле, Маркус (2007). «Оптимизированный синтез L-m-тирозина, пригодный для химического увеличения масштаба». Исследования и разработки в области органических процессов. 11 (6): 1069–1075. Дои:10.1021 / op700093y.
- ^ Расмуссен Д.Д., Ишизука Б., Куигли М.Э., Йен СС (1983). «Влияние приема тирозина и триптофана на концентрацию катехоламинов в плазме и 3,4-дигидроксифенилуксусной кислоты». J. Clin. Эндокринол. Метаб. 57 (4): 760–3. Дои:10.1210 / jcem-57-4-760. PMID 6885965.CS1 maint: использует параметр авторов (связь)
- ^ Литвуд П.Д., Поллет П. (1982). «Изменения настроения, вызванные диетой у нормальных людей». Журнал психиатрических исследований. 17 (2): 147–54. Дои:10.1016/0022-3956(82)90016-4. PMID 6764931.CS1 maint: использует параметр авторов (связь)
- ^ а б Deijen JB, Orlebeke JF (1994). «Влияние тирозина на когнитивные функции и артериальное давление при стрессе». Brain Res. Бык. 33 (3): 319–23. Дои:10.1016/0361-9230(94)90200-3. PMID 8293316.CS1 maint: использует параметр авторов (связь)
- ^ Либерман Х. Р., Коркин С., Спринг Б. Дж., Вуртман Р. Дж., Гроудон Дж. Х. (1985). «Влияние диетических предшественников нейромедиаторов на поведение человека». Am J Clin Nutr. 42 (2): 366–370. Дои:10.1093 / ajcn / 42.2.366. PMID 4025206.CS1 maint: использует параметр авторов (связь)
- ^ а б Хао С., Авраам Й., Бонн О., Берри Э.М. (2001). «Потеря веса тела, вызванная разделением, нарушение поведения чередования и вегетативного тонуса: эффекты тирозина». Pharmacol. Biochem. Поведение. 68 (2): 273–81. Дои:10.1016 / S0091-3057 (00) 00448-2. PMID 11267632.CS1 maint: использует параметр авторов (связь)
- ^ Мэджилл Р.А., Уотерс В.Ф., Брей Г.А., Волауфова Дж., Смит С.Р., Либерман Х.Р., МакНевин Н., Райан Д.Х. (2003). «Эффекты тирозина, фентермина, кофеина D-амфетамина и плацебо на когнитивные и двигательные нарушения во время лишения сна». Пищевая неврология. 6 (4): 237–46. Дои:10.1080/1028415031000120552. PMID 12887140.CS1 maint: использует параметр авторов (связь)
- ^ Нери Д.Ф., Вигманн Д., Стэнни Р.Р., Шаппелл С.А., Маккарди А., Маккей Д.Л. (1995). «Влияние тирозина на когнитивные способности во время длительного бодрствования». Авиация, космос и экологическая медицина. 66 (4): 313–9. PMID 7794222.CS1 maint: использует параметр авторов (связь)
- ^ Рейнштейн Д.К., Ленерт Х., Вуртман Р.Дж. (1985). «Диетический тирозин подавляет повышение уровня кортикостерона в плазме после острого стресса у крыс». Life Sci. 37 (23): 2157–63. Дои:10.1016/0024-3205(85)90566-1. PMID 4068899.CS1 maint: использует параметр авторов (связь)
- ^ Deijen JB, Wientjes CJ, Vullinghs HF, Cloin PA, Langefeld JJ (1999). «Тирозин улучшает когнитивные способности и снижает кровяное давление у курсантов после недели курса боевой подготовки». Brain Res. Бык. 48 (2): 203–9. Дои:10.1016 / S0361-9230 (98) 00163-4. PMID 10230711.CS1 maint: использует параметр авторов (связь)
- ^ Махони CR, Кастеллани Дж., Крамер FM, Янг А., Либерман HR (2007). «Добавки тирозина смягчают ухудшение рабочей памяти во время воздействия холода». Физиология и поведение. 92 (4): 575–82. Дои:10.1016 / j.physbeh.2007.05.003. PMID 17585971.CS1 maint: использует параметр авторов (связь)
- ^ Chinevere TD, Sawyer RD, Creer AR, Conlee RK, Parcell AC (2002). «Влияние приема L-тирозина и углеводов на выполнение упражнений на выносливость». J. Appl. Физиол. 93 (5): 1590–7. Дои:10.1152 / japplphysiol.00625.2001. PMID 12381742.CS1 maint: использует параметр авторов (связь)
- ^ Strüder HK, Hollmann W, Platen P, Donike M, Gotzmann A, Weber K (1998). «Влияние пароксетина, аминокислот с разветвленной цепью и тирозина на реакции нейроэндокринной системы и утомляемость у людей». Horm. Метаб. Res. 30 (4): 188–94. Дои:10.1055 / с-2007-978864. PMID 9623632.CS1 maint: использует параметр авторов (связь)
- ^ Томас-младший, Локвуд, Пенсильвания, Сингх, Деустер, Пенсильвания (1999). «Тирозин улучшает рабочую память в многозадачной среде». Pharmacol. Biochem. Поведение. 64 (3): 495–500. Дои:10.1016 / S0091-3057 (99) 00094-5. PMID 10548261.CS1 maint: использует параметр авторов (связь)
- ^ Лютке-Эверсло Т., Сантос С. Н., Стефанопулос Г. (2007). «Перспективы биотехнологического производства L-тирозина и его применения». Appl Microbiol Biotechnol. 77 (4): 751–62. Дои:10.1007 / s00253-007-1243-у. PMID 17968539.CS1 maint: использует параметр авторов (связь)
- ^ Чавес-Бехар М., Баез-Виверос Дж., Мартинес А., Боливар Ф., Госсет Дж. (2012). «Биотехнологическое производство L-тирозина и производных соединений». Биохимия процесса. 47 (7): 1017–1026. Дои:10.1016 / j.procbio.2012.04.005.CS1 maint: использует параметр авторов (связь)
- ^ Lutke-Eversloh T, Santos CN (2007). «Перспективы биотехнологического производства L-тирозина и его применения». Appl. Microbiol. Биотехнология. 77 (4): 751–762. Дои:10.1007 / s00253-007-1243-у. PMID 17968539.CS1 maint: использует параметр авторов (связь)
- ^ Чавес-Бехар М., Баез-Виверос Дж., Мартинес А., Боливар Ф., Госсет Дж. (2012). «Биотехнологическое производство L-тирозина и производных соединений». Биохимия процесса. 47 (7): 1017–1026. Дои:10.1016 / j.procbio.2012.04.005.CS1 maint: использует параметр авторов (связь)



