WikiDer > Алкалоид

Алкалоиды являются классом базовый, встречающиеся в природе органические соединения которые содержат хотя бы один азот атом. В эту группу также входят некоторые родственные соединения с нейтральным[2] и даже слабо кислый характеристики.[3] Некоторые синтетические соединения аналогичной структуры также можно назвать алкалоидами.[4] В добавление к углерод, водород и азот, алкалоиды могут также содержать кислород, сера и, реже, другие элементы, такие как хлор, бром, и фосфор.[5]
Алкалоиды продуцируются множеством организмов, включая бактерии, грибы, растения, и животные.[6] Их можно очистить из сырых экстрактов этих организмов путем кислотно-щелочная экстракция, или экстракция растворителем с последующим силикагелем колоночная хроматография.[7] Алкалоиды имеют широкий спектр фармакологический мероприятия, включая противомалярийный (например хинин), противоастма (например эфедрин), противораковое средство (например гомогаррингтонин),[8] холиномиметик (например галантамин),[9] сосудорасширяющий (например винкамин), антиаритмический (например хинидин), обезболивающее (например морфий),[10] антибактериальный (например хелеритрин),[11] и антигипергликемический виды деятельности (например пиперин).[12][неудачная проверка] Многие нашли применение в традиционный или же современная медицина, или как отправные точки для открытие лекарств. Другие алкалоиды обладают психотропный (например псилоцин) и стимулятор виды деятельности (например кокаин, кофеин, никотин, теобромин),[13] и использовались в энтеогенный ритуалы или как рекреационные наркотики. Алкалоиды могут быть токсичный тоже (например атропин, тубокурарин).[14] Хотя алкалоиды действуют на различные метаболические системы человека и других животных, они почти всегда вызывают Горький вкус.[15]
Граница между алкалоидами и другими азотсодержащими природными соединениями нечеткая.[16] Такие соединения как аминокислота пептиды, белки, нуклеотиды, нуклеиновая кислота, амины, и антибиотики обычно не называют алкалоидами.[2] Природные соединения, содержащие азот в экзоциклический позиция (мескалин, серотонин, дофамини др.) обычно классифицируются как амины а не как алкалоиды.[17] Некоторые авторы, однако, считают алкалоиды частным случаем аминов.[18][19][20]
Именование
Название «алкалоиды» (нем. Алкалоид) был введен в 1819 году немецким химиком Карл Фридрих Вильгельм Мейснер, и происходит от позднего латинского корня щелочь (что, в свою очередь, происходит от арабского аль-калви означает «пепел растений») и суффикс -οειδής -('подобно').[nb 1] Однако широкое употребление этот термин получил только после публикации обзорной статьи Оскара Якобсена в химическом словаре Альберт Ладенбург в 1880-х гг.[21][22]
Не существует уникального метода наименования алкалоидов.[23] Многие индивидуальные названия образуются путем добавления суффикса «ине» к названию вида или рода.[24] Например, атропин изолирован от растения Атропа белладонна; стрихнин получается из семян Стрихниновое дерево (Strychnos nux-vomica Л.).[5] Когда из одного растения извлекается несколько алкалоидов, их названия часто отличаются вариациями суффикса: «идин», «анин», «алин», «иннин» и т. Д. Также существует не менее 86 алкалоидов, в названиях которых содержится корень «вин». "потому что они извлечены из барвинок такие растения как Винча розовая (Катарантус розовый);[25] они называются барвинок алкалоиды.[26][27][28]
История

Растения, содержащие алкалоиды, использовались людьми с древних времен в лечебных и рекреационных целях. Например, лекарственные растения были известны в Месопотамия примерно с 2000 г. до н.э.[29] В Одиссея Гомер сослался на подарок Елене египетской царицей - наркотик, приносящий забвение. Считается, что подарком был наркотик, содержащий опиум.[30] В китайской книге о комнатных растениях, написанной в 1-3 веках до нашей эры, упоминается медицинское использование эфедра и опийные маки.[31] Также, кока листья использовались индейцами Южной Америки с древних времен.[32]
Экстракты из растений, содержащие токсичные алкалоиды, такие как аконитин и тубокурарин, использовались с древних времен для отравления стрел.[29]
Исследования алкалоидов начались в 19 веке. В 1804 году немецкий химик Фридрих Сертюрнер выделено из опиума «снотворное действие» (лат. Principium somniferum), который он назвал «морфием», имея в виду Морфеус, греческий бог снов; на немецком и некоторых других центральноевропейских языках это все еще название препарата. Термин «морфин», используемый в английском и французском языках, был дан французским физиком. Жозеф Луи Гей-Люссак.
Значительный вклад в химию алкалоидов в первые годы ее разработки внесли французские исследователи. Пьер Жозеф Пеллетье и Джозеф Бьенэме Кавенту, кто открыл хинин (1820) и стрихнин (1818). Примерно в то же время было открыто несколько других алкалоидов, в том числе ксантин (1817), атропин (1819), кофеин (1820), Coniine (1827), никотин (1828), колхицин (1833), спартеин (1851), и кокаин (1860).[33] Развитие химии алкалоидов ускорилось появлением спектроскопический и хроматографический методов в 20 веке, так что к 2008 году было идентифицировано более 12 000 алкалоидов.[34]
Первый полный синтез алкалоида был осуществлен в 1886 году немецким химиком. Альберт Ладенбург. Он произвел Coniine путем взаимодействия 2-метилпиридина с ацетальдегид и сокращение полученный 2-пропенилпиридин с натрием.[35][36]
Классификации
По сравнению с большинством других классов природных соединений алкалоиды характеризуются большим структурным разнообразием. Единой классификации нет.[37] Первоначально, когда знания о химической структуре отсутствовали, полагались на ботаническую классификацию исходных растений. Эта классификация сейчас считается устаревшей.[5][38]
Более поздние классификации основаны на сходстве углеродного скелета (например, индол-, изохинолин-, и пиридин-подобный) или биохимический предшественник (орнитин, лизин, тирозин, триптофан, так далее.).[5] Однако они требуют компромиссов в пограничных случаях;[37] Например, никотин содержит пиридиновый фрагмент из никотинамид и пирролидин часть из орнитина[39] и поэтому может быть отнесен к обоим классам.[40]
Алкалоиды часто делятся на следующие основные группы:[41]
- «Истинные алкалоиды» содержат азот в гетероцикл и происходят из аминокислоты.[42] Их характерные примеры: атропин, никотин, и морфий. В эту группу также входят некоторые алкалоиды, которые помимо азотного гетероцикла содержат терпен (например, Evonine[43]) или пептидных фрагментов (например эрготамин[44]). Пиперидиновые алкалоиды Coniine и Coniceine могут рассматриваться как истинные алкалоиды (а не псевдоалкалоиды: см. ниже)[45] хотя они не происходят из аминокислот.[46]
- «Протоалкалоиды», содержащие азот (но не азотный гетероцикл), а также происходят из аминокислот.[42] Примеры включают мескалин, адреналин и эфедрин.
- Алкалоиды полиаминов - производные путресцин, спермидин, и спермин.
- Пептидные и циклопептидные алкалоиды.[47]
- Псевдоалкалоиды - алкалоидоподобные соединения, не содержащие аминокислот.[48] В эту группу входят терпен-как и стероидный препарат-подобные алкалоиды,[49] а также пурин-подобные алкалоиды, такие как кофеин, теобромин, теакрин и теофиллин.[50] Некоторые авторы относят к псевдоалкалоидам такие соединения, как эфедрин и катинон. Они происходят из аминокислоты фенилаланин, но получают свой атом азота не от аминокислоты, а через трансаминирование.[50][51]
Некоторые алкалоиды не имеют углеродного скелета, характерного для их группы. Так, галантамин и гомоапорфины не содержат изохинолин фрагмент, но, как правило, относятся к изохинолиновым алкалоидам.[52]
Основные классы мономерных алкалоидов перечислены в таблице ниже:
| Учебный класс | Основные группы | Основные этапы синтеза | Примеры |
|---|---|---|---|
| Алкалоиды с азотными гетероциклами (истинные алкалоиды) | |||
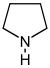
| Пирролидин производные[53] | Орнитин или же аргинин → путресцин → N-метилпутресцин → N-метил-Δ1-пирролин [54] | Кускогигрин, гигрин, гигролин, стахидрин[53][55] | |
| Тропан производные[56] | Группа атропина Замена в позициях 3, 6 или 7 | Орнитин или же аргинин → путресцин → N-метилпутресцин → N-метил-Δ1-пирролин [54] | Атропин, скополамин, гиосциамин[53][56][57] |
| Кокаиновая группа Замена в позициях 2 и 3 | Кокаин, экгонин [56][58] | ||
| Пирролизидин производные[59] | Неэфиры | В растениях: орнитин или же аргинин → путресцин → гомоспермидин → ретронецин [54] | Ретронецин, гелиотридин, лабурнин [59][60] |
| Сложный сложные эфиры монокарбоновых кислот | Индицин, линделофин, саррацин [59] | ||
| Макроциклические диэфиры | Платифиллин, триходесмин[59] | ||
| 1-аминопирролизидины (Lolines) | В грибы: L-пролин + L-гомосерин → N- (3-амино-3-карбоксипропил) пролин → норлолин[61][62] | Лолайн, N-формиллолин, N-ацетилолин[63] | |
| Пиперидин производные[64] | Лизин → кадаверин → Δ1-пиперидин [65] | Седамин, лобелин, анаферин, пиперин [45][66] | |
| Октановая кислота → coniceine → Coniine [46] | Coniine, coniceine [46] | ||
| Хинолизидин производные[67][68] | Люпинин группа | Лизин → кадаверин → Δ1-пиперидин [69] | Люпинин, нуфаридин [67] |
| Цитизин группа | Цитизин [67] | ||
| Спартеин группа | Спартеин, лупанин, анахигрин[67] | ||
| Матрина группа. | Матрин, оксиматрин, алломатридин[67][70][71] | ||
| Ормосанин группа | Ормосанин, пиптантин[67][72] | ||
| Индолизидин производные[73] | Лизин → δ-полуальдегид α-аминоадипиновая кислота → пипеколиновая кислота → 1 индолизидинон [74] | Свейнсонин, кастаноспермин [75] | |
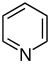
| Пиридин производные[76][77] | Простые производные пиридина | Никотиновая кислота → дигидроникотиновая кислота → 1,2-дигидропиридин [78] | Тригонеллин, рицинин, Arecoline [76][79] |
| Полициклические неконденсирующиеся производные пиридина | Никотин, норникотин, анабазин, анатабин [76][79] | ||
| Полициклические конденсированные производные пиридина | Актинидин, горечавка, педикулинин [80] | ||
| Сесквитерпен производные пиридина | Никотиновая кислота, изолейцин [20] | Эвонин, гиппократин, триптонин [77][78] | |
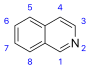
| Изохинолин производные и родственные алкалоиды [81] | Простые производные изохинолина [82] | Тирозин или же фенилаланин → дофамин или же тирамин (для алкалоидов Амариллис) [83][84] | Сальсолин, лофоцерин [81][82] |
| Производные 1- и 3-изохинолинов [85] | N-метилкоридальдин, нороксигидрастинин [85] | ||
| Производные 1- и 4-фенилтетрагидроизохинолинов [82] | Криптостилин [82][86] | ||
| Производные 5-нафтил-изохинолина [87] | Анцистрокладин [87] | ||
| Производные 1- и 2-бензил-изохинолинов [88] | Папаверин, лауданозин, сендаверин | ||
| Cularine группа[89] | Куларин, ягонин [89] | ||
| Павины и изопавины [90] | Аргемонин, амуренсин [90] | ||
| Бензопирроколины [91] | Криптаустолин [82] | ||
| Протоберберины [82] | Берберин, канадина, офиокарпин, мекамбридин, коридалин [92] | ||
| Фталидизохинолины [82] | Гидрастин, наркотик (Носкапин) [93] | ||
| Спиробензилизохинолины [82] | Фумарицин [90] | ||
| Ипекакуана алкалоиды[94] | Эметин, протоэметин, ипекозид [94] | ||
| Бензофенантридины [82] | Сангвинарин, оксинитидин, коринолоксин [95] | ||
| Апорфины [82] | Glaucine, коридин, лириоденин [96] | ||
| Проапорфины [82] | Пронуциферин, глазиовин [82][91] | ||
| Гомоапорфины [97] | Крейсигинин, мультифлорамин [97] | ||
| Гомопропорфины [97] | Бульбокодин [89] | ||
| Морфины[98] | Морфий, кодеин, тебаин, Sinomenine [99] | ||
| Гомоморфины [100] | Крейсигинин, андроцимбин [98] | ||
| Трополоизохинолины [82] | Имерубрин [82] | ||
| Азофлуорантены [82] | Руфесцин, имелутин [101] | ||
| Амариллис алкалоиды[102] | Ликорин, амбеллин, тазеттин, галантамин, монтанин [103] | ||
| Эритрина алкалоиды[86] | Эризодин, эритроидин [86] | ||
| Фенантрен производные [82] | Атеросперминин [82][92] | ||
| Протопины [82] | Протопин, оксомурамин, корикавидин [95] | ||
| Аристолактам [82] | Дорифлавин [82] | ||
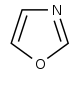
| Оксазол производные[104] | Тирозин → тирамин [105] | Аннулолин, полординол, тексалин, техамин[106] | |
| Изоксазол производные | Иботеновая кислота → Muscimol | Иботеновая кислота, Мусцимол | |
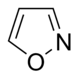
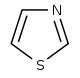
| Тиазол производные[107] | 1-дезокси-D-ксилулоза 5-фосфат (DOXP), тирозин, цистеин [108] | Ностоцикламид, тиострептон [107][109] | |
| Хиназолин производные[110] | Производные 3,4-дигидро-4-хиназолона | Антраниловая кислота или же фенилаланин или же орнитин [111] | Фебрифугин[112] |
| Производные 1,4-дигидро-4-хиназолона | Гликорин, арборн, гликозминин[112] | ||
| Производные пирролидина и пиперидина хиназолина | Вазицин (пеганин) [104] | ||
| Акридин производные[104] | Антраниловая кислота [113] | Рутакридон, акроникин[114][115] | |
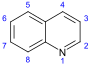
| Хинолин производные[116][117] | Простые производные хинолиновых производных 2 – хинолоны и 4-хинолон | Антраниловая кислота → 3-карбоксихинолин [118] | Куспарин, эхинопсин, эвокарпин[117][119][120] |
| Трициклические терпеноиды | Флиндерсин[117][121] | ||
| Производные фуранохинолина | Диктамнин, fagarine, скиммианин[117][122][123] | ||
| Хинины | Триптофан → триптамин → стриктозидин (с секологанин) → коринантал → синхонинон [84][118] | Хинин, хинидин, цинхонин, цинхонидин [121] | |
| Индол производные[99] | Неизопреновые индольные алкалоиды | ||
| Простые производные индола [124] | Триптофан → триптамин или же 5-гидрокситриптофан [125] | Серотонин, псилоцибин, диметилтриптамин (ДМТ), буфотенин [126][127] | |
| Простые производные от β-карболин [128] | Харман, гармин, гармалин, eleagnine [124] | ||
| Алкалоиды пирролоиндола [129] | Физостигмин (эзерин), эфирамин, физовенин, эптастигмин[129] | ||
| Семитерпеноидные индольные алкалоиды | |||
| Алкалоиды спорыньи[99] | Триптофан → чаноклавин → агроклавин → элимоклавин → паспалевая кислота → лизергиновая кислота [129] | Эрготамин, эргобазин, эргозин[130] | |
| Монотерпеноидные индольные алкалоиды | |||
| Коринанта тип алкалоидов[125] | Триптофан → триптамин → стриктозидин (с секологанин) [125] | Аджмалицин, сарпагин, вобазин, аджмалин, йохимбин, Резерпин, митрагинин,[131][132] группа стрихнин и (Стрихнин бруцин, аквамицин, vomicine [133]) | |
| Ибогаалкалоиды типа[125] | Ибогамин, ибогаин, voacangine[125] | ||
| Аспидоспермаалкалоиды типа[125] | Винкамин, барвинок алкалоиды,[26][134] винкотин, аспидоспермин[135][136] | ||
| Имидазол производные[104] | Прямо из гистидин[137] | Гистамин, пилокарпин, пилозин, Стивенсин[104][137] | |
| Пурин производные[138] | Ксантозин (образуется при биосинтезе пурина) → 7 метилксантозин → 7-метил ксантин → теобромин → кофеин [84] | Кофеин, теобромин, теофиллин, сакситоксин [139][140] | |
| Алкалоиды с азотом в боковой цепи (протоалкалоиды) | |||
| β-Фенилэтиламин производные[91] | Тирозин или же фенилаланин → диоксифенилаланин → дофамин → адреналин и мескалин тирозин → тирамин фенилаланин → 1-фенилпропан-1,2-дион → катинон → эфедрин и псевдоэфедрин [20][51][141] | Тирамин, эфедрин, псевдоэфедрин, мескалин, катинон, катехоламины (адреналин, норадреналин, дофамин)[20][142] | |
| Колхицин алкалоиды [143] | Тирозин или же фенилаланин → дофамин → осенний → колхицин [144] | Колхицин, колхамин[143] | |
| Мускарин [145] | Глютаминовая кислота → 3-кетоглутаминовая кислота → мускарин (с пировиноградная кислота)[146] | Мускарин, алломускарин, эпимускарин, эпиалломускарин[145] | |
| Бензиламин[147] | Фенилаланин с валин, лейцин или же изолейцин[148] | Капсаицин, дигидрокапсаицин, нордигидрокапсаицин, ванилиламин[147][149] | |
| Алкалоиды полиаминов | |||
| Путресцин производные[150] | орнитин → путресцин → спермидин → спермин[151] | Paucine [150] | |
| Спермидин производные[150] | Лунарин, кодонокарпин[150] | ||
| Спермин производные[150] | Вербасенин, афеландрин [150] | ||
| Пептидные (циклопептидные) алкалоиды | |||
| Пептидные алкалоиды с 13-членным циклом [47][152] | Тип Nummularine C | Из разных аминокислот [47] | Нуммуларин С, Нуммуларин S [47] |
| Зизифин тип | Зизифин А, сативанин Н [47] | ||
| Пептидные алкалоиды с 14-членным циклом [47][152] | Тип франгуланина | Франгуланин, скутианин J [152] | |
| Скутианин типа А | Скутианин А [47] | ||
| Целочисленный тип | Целочисленный, дискаринный D [152] | ||
| Амфибин F типа | Амфибин F, спинанин А [47] | ||
| Амфибин типа В | Амфибин B, лотусин C [47] | ||
| Пептидные алкалоиды с 15-членным циклом [152] | Мукронин типа А | Мукронин А [44][152] | |
| Псевдоалкалоиды (терпены и стероиды) | |||
| Дитерпены [44] | Ликоктониновый тип | Мевалоновая кислота → Изопентенил пирофосфат → геранилпирофосфат [153][154] | Аконитин, дельфинин [44][155] |
| Стероиды[156] | Холестерин, аргинин[157] | Соласодин, соланидин, вералкамин, батрахотоксин[158] | |
Характеристики

Большинство алкалоидов содержат кислород в своей молекулярной структуре; эти соединения обычно представляют собой бесцветные кристаллы в условиях окружающей среды. Бескислородные алкалоиды, такие как никотин[159] или же Coniine,[35] обычно являются летучими, бесцветными, маслянистыми жидкостями.[160] Некоторые алкалоиды окрашены, как берберин (желтый) и сангвинарин (апельсин).[160]
Большинство алкалоидов являются слабыми основаниями, но некоторые, например, теобромин и теофиллин, находятся амфотерный.[161] Многие алкалоиды плохо растворяются в воде, но легко растворяются в ней. органические растворители, Такие как диэтиловый эфир, хлороформ или же 1,2-дихлорэтан. Кофеин,[162] кокаин,[163] кодеин[164] и никотин[165] слабо растворимы в воде (с растворимостью ≥1 г / л), тогда как другие, в том числе морфий[166] и йохимбин[167] очень слабо растворимы в воде (0,1–1 г / л). Алкалоиды и кислоты образуют соли разной силы. Эти соли обычно легко растворяются в воде и этиловый спирт и плохо растворяется в большинстве органических растворителей. Исключения включают скополамин гидробромид, растворимый в органических растворителях, и водорастворимый сульфат хинина.[160]
Большинство алкалоидов имеют горький вкус или ядовиты при проглатывании. Производство алкалоидов в растениях, по-видимому, развилось в ответ на кормление травоядными животными; однако некоторые животные развили способность выводить токсины из алкалоидов.[168] Некоторые алкалоиды могут вызывать дефекты развития у потомства животных, которые потребляют, но не могут детоксифицировать алкалоиды. Одним из примеров является алкалоид циклопамин, производится в листьях кукурузная лилия. В течение 1950-х годов до 25% ягнят, рожденных от овец, которые паслись на кукурузной лилии, имели серьезные деформации лица. Они варьировались от деформированных челюстей до циклопия (см. картинку). После десятилетий исследований, в 1980-х годах, соединение, ответственное за эти деформации, было идентифицировано как алкалоид 11-дезоксиджервин, позже переименованный в циклопамин.[169]
Распространение в природе
Алкалоиды генерируется различными живыми организмами, особенно высшие растения - от 10 до 25% из них содержат алкалоиды.[170][171] Поэтому в прошлом термин «алкалоид» ассоциировался с растениями.[172]
Содержание алкалоидов в растениях обычно находится в пределах нескольких процентов и неоднородно по тканям растений. В зависимости от вида растений максимальная концентрация наблюдается в листьях (черная белена), фрукты или же семена (Стрихниновое дерево), корень (Раувольфия серпентина) или лаять (хинное дерево).[173] Кроме того, разные ткани одного и того же растения могут содержать разные алкалоиды.[174]
Помимо растений, алкалоиды содержатся в некоторых типах растений. грибы, Такие как псилоцибин в грибах рода Псилоцибе, и у животных, таких как буфотенин в шкуре некоторых жаб [23] и ряд насекомых, особенно муравьев.[175] Многие морские организмы также содержат алкалоиды.[176] Немного амины, Такие как адреналин и серотонин, которые играют важную роль у высших животных, похожи на алкалоиды по своей структуре и биосинтезу и иногда называются алкалоидами.[177]
Добыча
Из-за структурного разнообразия алкалоидов не существует единого метода их извлечения из природного сырья.[178] Большинство методов используют свойство большинства алкалоидов растворяться в органических растворителях. [7] но не в воде, а у их солей противоположная тенденция.
Большинство растений содержат несколько алкалоидов. Их смесь сначала экстрагируется, а затем отделяются отдельные алкалоиды.[179] Перед экстракцией растения тщательно измельчают.[178][180] Большинство алкалоидов присутствует в сырых растениях в виде солей органических кислот.[178] Извлеченные алкалоиды могут оставаться солями или превращаться в основания.[179] Базовая экстракция достигается обработкой сырья щелочными растворами и экстракцией оснований алкалоидов органическими растворителями, такими как 1,2-дихлорэтан, хлороформ, диэтиловый эфир или бензол. Затем примеси растворяются слабыми кислотами; это превращает основания алкалоидов в соли, которые смываются водой. При необходимости водный раствор солей алкалоидов снова подщелачивают и обрабатывают органическим растворителем. Процесс повторяется до тех пор, пока не будет достигнута желаемая чистота.
При кислотной экстракции сырье растительного происхождения обрабатывают слабым кислым раствором (например, уксусная кислота в воде, этаноле или метаноле). Затем добавляется основание для превращения алкалоидов в основные формы, которые экстрагируются органическим растворителем (если экстракция проводилась спиртом, его сначала удаляют, а остаток растворяют в воде). Раствор очищают, как описано выше.[178][181]
Алкалоиды отделяются от их смеси, используя их различную растворимость в определенных растворителях и различную реакционную способность с определенными реагентами или дистилляция.[182]
Ряд алкалоидов идентифицируют из насекомые, среди которых огненный муравей яд алкалоиды, известные как соленопсины получили большее внимание исследователей.[183] Эти алкалоиды насекомых могут быть эффективно экстрагированы путем погружения живых огненных муравьев в растворитель. [7] или центрифугированием живых муравьев [184] с последующей очисткой хроматографией на силикагеле.[185] Отслеживание и дозирование экстрагированных алкалоидов муравьев соленопсина было описано как возможное на основании их пика поглощения около 232 нанометров.[186]
Биосинтез
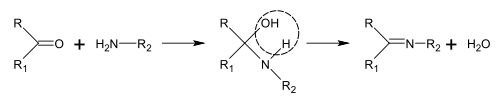
Биологические предшественники большинства алкалоидов: аминокислоты, Такие как орнитин, лизин, фенилаланин, тирозин, триптофан, гистидин, аспарагиновая кислота, и антраниловая кислота.[187] Никотиновая кислота может быть синтезирован из триптофана или аспарагиновой кислоты. Способы биосинтеза алкалоидов слишком многочисленны и их сложно классифицировать.[84] Однако существует несколько типичных реакций, участвующих в биосинтезе различных классов алкалоидов, включая синтез Базы Шиффа и Реакция Манниха.[187]
Синтез оснований Шиффа
Основания Шиффа могут быть получены взаимодействием аминов с кетонами или альдегидами.[188] Эти реакции являются обычным методом получения связей C = N.[189]
При биосинтезе алкалоидов такие реакции могут происходить внутри молекулы,[187] например, при синтезе пиперидина:[40]
Реакция Манниха
Неотъемлемый компонент реакции Манниха, помимо амина и карбонил соединение, является карбанион, который играет роль нуклеофила в нуклеофильное присоединение к иону, образованному реакцией амина и карбонила.[189]
Реакция Манниха может протекать как межмолекулярно, так и внутримолекулярно:[190][191]
Димерные алкалоиды
Помимо описанных выше мономерных алкалоидов, существуют еще димерный, и даже тример и тетрамерный алкалоиды, образующиеся при конденсации двух, трех и четырех мономерных алкалоидов. Димерные алкалоиды обычно образуются из мономеров одного типа по следующим механизмам:[192]
- Реакция Манниха, в результате чего, например, воакамин
- Реакция Майкла (виллалстонин)
- Конденсация альдегидов с аминами (токсиферином)
- Окислительное добавление фенолов (даурицин, тубокурарин)
- Лактонизация (карпаин).
Есть также димерные алкалоиды, образованные из двух различных мономеров, таких как барвинок алкалоиды винбластин и винкристин,[26][134] которые образуются из соединения катарантин и виндолин.[193][194] Новее полусинтетический химиотерапевтическое средство винорелбин используется при лечении немелкоклеточный рак легкого.[134][195] Это еще одно производное димера виндолина и катарантина, которое синтезируется из ангидровинбластин,[196] начиная с лейрозин[197][198] или сами мономеры.[134][194]
Биологическая роль
Роль алкалоидов для живых организмов, производящих их, до сих пор неясна.[199] Первоначально предполагалось, что алкалоиды являются конечными продуктами азот метаболизм в растениях, как мочевина у млекопитающих. Позже было показано, что концентрация алкалоидов меняется со временем, и эта гипотеза была опровергнута.[16] Номер муравьи предлагается также производить алкалоиды как яд компоненты, однако точные пути биосинтеза эмпирически не продемонстрированы.[175][200]
Большинство известных функций алкалоидов связано с защитой. Например, апорфин алкалоид лириоденин произведенный тюльпанное дерево защищает его от грибов-паразитов. Кроме того, наличие в растении алкалоидов предотвращает появление насекомых и хордовый животные от еды. Однако некоторые животные адаптированы к алкалоидам и даже используют их в собственном метаболизме.[201] Такие вещества, связанные с алкалоидами, как серотонин, дофамин и гистамин важные нейротрансмиттеры у животных. Известно также, что алкалоиды регулируют рост растений.[202] Одним из примеров организма, который использует алкалоиды для защиты, является Utetheisa ornatrix, более известный как декоративный мотылек. Пирролизидиновые алкалоиды делают этих личинок и взрослых бабочек неприятными для многих их естественных врагов, таких как кокцинелидные жуки, зеленые златоглазки, насекомоядные полужесткокрылые и насекомоядные летучие мыши.[203] Другой пример использования алкалоидов встречается в ядовитая моль болиголов (Agonopterix alstroemeriana). Эта моль питается своим высокотоксичным и богатым алкалоидами растением-хозяином. яд болиголов (Conium maculatum) во время личиночной стадии. A. asltroemeriana может получить двойную пользу от токсичности природных алкалоидов, как из-за невкусности вида для хищников, так и из-за способности A. alstroemeriana распознавать Conium maculatum как правильное место для откладки яиц.[204] А огненный муравей яд алкалоид, известный как соленопсин было продемонстрировано, что защищает королев инвазивные огненные муравьи во время основания новых гнезд, тем самым играя центральную роль в распространении этого вида муравьев-вредителей по всему миру.[205]
Приложения
В медицине
Использование алкалоидсодержащих растений в медицине имеет долгую историю, поэтому, когда в 19 веке были выделены первые алкалоиды, они сразу же нашли применение в клинической практике.[206] Многие алкалоиды все еще используются в медицине, обычно в форме широко используемых солей, включая следующие:[16][207]
Многие синтетические и полусинтетические препараты представляют собой структурные модификации алкалоидов, которые были разработаны для усиления или изменения основного эффекта препарата и уменьшения нежелательных побочных эффектов.[208] Например, налоксон, опиоидный рецептор антагонист, является производной от тебаин что присутствует в опиум.[209]
В сельском хозяйстве
До разработки широкого спектра относительно малотоксичных синтетических пестициды, некоторые алкалоиды, такие как соли никотина и анабазин, использовались как инсектициды. Их использование было ограничено их высокой токсичностью для человека.[210]
Использование в качестве психоактивных препаратов
Препараты растений, содержащие алкалоиды и их экстракты, а позднее и чистые алкалоиды, издавна использовались в качестве психоактивные вещества. Кокаин, кофеин, и катинон находятся стимуляторы из Центральная нервная система.[211][212] Мескалин и многие индольные алкалоиды (такие как псилоцибин, диметилтриптамин и ибогаин) имеют галлюциногенный эффект.[213][214] Морфий и кодеин сильные наркотические обезболивающие.[215]
Есть алкалоиды, которые сами по себе не обладают сильным психоактивным действием, но предшественники для полусинтетических психоактивных препаратов. Например, эфедрин и псевдоэфедрин используются для производства меткатинон и метамфетамин.[216] Тебаин используется в синтезе многих обезболивающих, таких как оксикодон.
Смотрите также
Примечания
- ^ В предпоследнем предложении своей статьи W. Meissner (1819) «Über Pflanzenalkalien: II. Über ein neues Pflanzenalkali (Alkaloid)» (О щелочах растений: II. О новом щелоче (алкалоиде) растений), Journal für Chemie und Physik, 25 : 379–381; доступно онлайн по адресу: Хати Траст - Мейснер писал: "Überhaupt scheint es mir auch angemessen, die bis jetzt bekannten Pflanzenstoffe nicht mit dem Namen Alkalien, sondern Alkaloide zu belegen, da sie doch in manchen Eigenschaften von den Alkalien sehr abweichen, sie würzenschaften de flénden, sie würzenschaften, sie würzenschaften, sie würzenschaften de la zurdenne. "(I. e, В общем, мне кажется уместным навязать известным в настоящее время растительным веществам не название «щелочи», а «алкалоиды», так как они по некоторым свойствам сильно отличаются от щелочей; среди разделов химии растений они, таким образом, найдут свое место перед растительными кислотами (поскольку «Алкалоид» предшествует «Säure» (кислота), но следует за «Щелочником»]).
Рекомендации
- ^ Андреас Луч (2009). Молекулярная, клиническая и экологическая токсикология. Springer. п. 20. ISBN 978-3-7643-8335-0.
- ^ а б ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "алкалоиды". Дои:10.1351 / goldbook.A00220
- ^ Р. Х. Ф. Манске. Алкалоиды. Химия и физиология. Том VIII. - Нью-Йорк: Академическая пресса, 1965, с. 673
- ^ Роберт Алан Льюис. Словарь токсикологии Льюиса. CRC Press, 1998, стр. 51 ISBN 1-56670-223-2
- ^ а б c d Химическая энциклопедия: алкалоиды. xumuk.ru
- ^ Робертс, М. Ф. (Маргарет Ф.) (1998). Алкалоиды: биохимия, экология и медицина. Подмигнуть, Майкл. Бостон, Массачусетс: Springer США. ISBN 9781475729054. OCLC 851770197.
- ^ а б c Гонсалвеш Патерсон Фокс, Эдуардо; Расс Солис, Дэниел; Деласари душ Сантуш, Люсилен; Апаресидо душ Сантуш Пинту, Хосе Роберто; Рибейру да Силва Менегассо, Анали; Кардосо Масиел Коста Силва, Рафаэль; Серхио Пальма, Марио; Корреа Буэно, Одаир; де Алькантара Мачадо, Эднильдо (апрель 2013 г.). «Простой и быстрый метод извлечения целого яда огненных муравьев (Insecta: Formicidae: Solenopsis)». Токсикон. 65: 5–8. Дои:10.1016 / j.toxicon.2012.12.009. HDL:11449/74946. PMID 23333648.
- ^ Киттакуп П., Махидол С., Ручирават С. (2014). «Алкалоиды как важная основа в терапевтических препаратах для лечения рака, туберкулеза и отказа от курения». Curr Top Med Chem. 14 (2): 239–252. Дои:10.2174/1568026613666131216105049. PMID 24359196.
- ^ Руссо П., Фрустачи А., Дель Буфало А., Фини М., Чезарио А. (2013). «Многоцелевые препараты растительного происхождения, действующие на болезнь Альцгеймера». Curr Med Chem. 20 (13): 1686–93. Дои:10.2174/0929867311320130008. PMID 23410167.
- ^ Раймонд С. Синатра; Джонатан С. Яр; Дж. Майкл Уоткинс-Питчфорд (2010). Суть обезболивающих и анальгетиков. Издательство Кембриджского университета. С. 82–90. ISBN 978-1139491983.
- ^ Cushnie TP, Cushnie B, Lamb AJ (2014). «Алкалоиды: обзор их антибактериальной, антибиотико-усиливающей и антивирулентной активности». Противомикробные агенты Int J. 44 (5): 377–386. Дои:10.1016 / j.ijantimicag.2014.06.001. PMID 25130096.
- ^ Цю С, Сун Х, Чжан АХ, Сюй ХЙ, Ян Г.Л., Хань И, Ван Сдж (2014). «Природные алкалоиды: основные аспекты, биологические роли и перспективы на будущее». Чин Дж Нат Мед. 12 (6): 401–406. Дои:10.1016 / S1875-5364 (14) 60063-7. PMID 24969519.
- ^ "Алкалоид". 2007-12-18.
- ^ Грабители JE, Speedie MK, Тайлер В.Е. (1996). «Глава 9: Алкалоиды». Фармакогнозия и фармакобиотехнология. Филадельфия: Липпинкотт, Уильямс и Уилкинс. С. 143–185. ISBN 978-0683085006.
- ^ Роудс, Дэвид Ф (1979). «Эволюция химической защиты растений от травоядных». В Rosenthal, Gerald A .; Янзен, Даниэль Х (ред.). Травоядные животные: их взаимодействие с вторичными метаболитами растений. Нью-Йорк: Academic Press. п. 41. ISBN 978-0-12-597180-5.
- ^ а б c Роберт А. Мейерс Энциклопедия физических наук и технологий - Алкалоиды, 3-е издание. ISBN 0-12-227411-3
- ^ Леланд Дж. Чеке Натуральные продукты из растений Второе издание. - КПР, 2006, с. 30 ISBN 0-8493-2976-0
- ^ А. Уильям Джонсон Приглашение к органической химии, Джонс и Бартлетт, 1999, стр. 433 ISBN 0-7637-0432-6
- ^ Радж К. Бансал Учебник по органической химии. 4-е издание, New Age International, 2004 г., стр. 644 ISBN 81-224-1459-1
- ^ а б c d Анишевский, п. 110
- ^ Гессе, стр. 1–3
- ^ Оскар Якобсен, «Алкалоид» в: Ладенбург, Handwörterbuch der Chemie (Бреслау, Германия: Эдуард Тревендт, 1882 г.), т. 1, стр. 213–422.
- ^ а б Гессе, п. 5
- ^ Суффикс «ine» - это суффикс отчества женского рода греческого происхождения и означает «дочь»; отсюда, например, «атропин» означает «дочь Атропы» (белладонны): Разработка систематических названий простых алканов В архиве 2012-03-16 в Wayback Machine. yale.edu
- ^ Гессе, п. 7
- ^ а б c ван дер Хейден, Роберт; Джейкобс, Дениз I .; Snoeijer, Wim; Халлард, Дидье; Верпоорте, Роберт (2004). "The Catharanthus алкалоиды: фармакогнозия и биотехнология ». Современная лекарственная химия. 11 (5): 607–628. Дои:10.2174/0929867043455846. PMID 15032608.
- ^ Купер, Раймонд; Дикин, Джеффри Джон (2016). «Дар Африки миру». Ботанические чудеса: химия растений, изменивших мир. CRC Press. С. 46–51. ISBN 9781498704304.
- ^ Равинья, Энрике (2011). «Алкалоиды барвинка». Эволюция открытия лекарств: от традиционных лекарств к современным лекарствам. Джон Уайли и сыновья. С. 157–159. ISBN 9783527326693.
- ^ а б Анишевский, п. 182
- ^ Гессе, п. 338
- ^ Гессе, п. 304
- ^ Гессе, п. 350
- ^ Гессе, стр. 313–316
- ^ Бегли, Натуральные продукты в растениях.
- ^ а б Кониин[постоянная мертвая ссылка]. Большая Советская Энциклопедия (1969–1978)
- ^ Гессе, п. 204
- ^ а б Гессе, п. 11
- ^ Орехов, п. 6
- ^ Анишевский, п. 109
- ^ а б Дьюик, п. 307
- ^ Гессе, п. 12
- ^ а б Племенков, п. 223
- ^ Анишевский, п. 108
- ^ а б c d Гессе, п. 84
- ^ а б Гессе, п. 31 год
- ^ а б c Дьюик, п. 381
- ^ а б c d е ж грамм час я Димитрис К. Гурнелиф; Грегори Г. Ласкарисб; Роберт Верпоорте (1997). «Циклопептидные алкалоиды». Nat. Prod. Представитель. 14 (1): 75–82. Дои:10.1039 / NP9971400075. PMID 9121730.
- ^ Анишевский, п. 11
- ^ Племенков, п. 246
- ^ а б Анишевский, п. 12
- ^ а б Дьюик, п. 382
- ^ Гессе, стр.44, 53
- ^ а б c Племенков, п. 224
- ^ а б c Анишевский, п. 75
- ^ Орехов, п. 33
- ^ а б c Химическая энциклопедия: алкалоиды тропана. xumuk.ru
- ^ Гессе, п. 34
- ^ Анишевский, п. 27
- ^ а б c d Химическая энциклопедия: пирролизидиновые алкалоиды. xumuk.ru
- ^ Племенков, п. 229
- ^ Бланкеншип Дж. Д., Хаускнехт Дж. Б., Пал С., Буш Л. П., Гроссман Р. Б., Шардл С. Л. (2005). «Биосинтетические предшественники пирролизидинов грибов, алкалоиды лолина». ChemBioChem. 6 (6): 1016–1022. Дои:10.1002 / cbic.200400327. PMID 15861432. S2CID 13461396.
- ^ Фолкнер-младший, Хуссайни С.Р., Бланкеншип Д.Д., Пал С., Бранан Б.М., Гроссман Р.Б., Шардл С.Л. (2006). «О последовательности образования связей в биосинтезе алкалоидов лолина». ChemBioChem. 7 (7): 1078–1088. Дои:10.1002 / cbic.200600066. PMID 16755627. S2CID 34409048.
- ^ Шардл К.Л., Гроссман Р.Б., Нагабхиру П., Фолкнер-младший, Маллик Ю.П. (2007). «Лолайн алкалоиды: валюта мутуализма». Фитохимия. 68 (7): 980–996. Дои:10.1016 / j.phytochem.2007.01.010. PMID 17346759.
- ^ Племенков, п. 225
- ^ Анишевский, п. 95
- ^ Орехов, п. 80
- ^ а б c d е ж Химическая энциклопедия: хинолизидиновые алкалоиды. xumuk.ru
- ^ Saxton, Vol. 1, стр. 93
- ^ Анишевский, п. 98
- ^ Saxton, Vol. 1, стр. 91
- ^ Джозеф П. Майкл (2002). «Индолизидиновые и хинолизидиновые алкалоиды». Nat. Prod. Представитель. 19 (5): 458–475. Дои:10.1039 / b208137g. PMID 14620842.
- ^ Saxton, Vol. 1, стр. 92
- ^ Дьюик, п. 310
- ^ Анишевский, п. 96
- ^ Анишевский, п. 97
- ^ а б c Племенков, п. 227
- ^ а б Химическая энциклопедия: пиридиновые алкалоиды. xumuk.ru
- ^ а б Анишевский, п. 107
- ^ а б Анишевский, п. 85
- ^ Племенков, п. 228
- ^ а б Гессе, п. 36
- ^ а б c d е ж грамм час я j k л м п о п q р s т Химическая энциклопедия: изохинолиновые алкалоиды. xumuk.ru
- ^ Анишевский, стр. 77–78
- ^ а б c d Бегли, Биосинтез алкалоидов
- ^ а б Saxton, Vol. 3, стр. 122
- ^ а б c Гессе, п. 54
- ^ а б Гессе, п. 37
- ^ Гессе, п. 38
- ^ а б c Гессе, п. 46
- ^ а б c Гессе, п. 50
- ^ а б c Кеннет В. Бентли (1997). «β-Фенилэтиламины и изохинолиновые алкалоиды» (PDF). Nat. Prod. Представитель. 14 (4): 387–411. Дои:10.1039 / NP9971400387. PMID 9281839.
- ^ а б Гессе, п. 47
- ^ Гессе, п. 39
- ^ а б Гессе, п. 41 год
- ^ а б Гессе, п. 49
- ^ Гессе, п. 44
- ^ а б c Saxton, Vol. 3, стр. 164
- ^ а б Гессе, п. 51
- ^ а б c Племенков, п. 236
- ^ Saxton, Vol. 3, стр. 163
- ^ Saxton, Vol. 3, стр. 168
- ^ Гессе, п. 52
- ^ Гессе, п. 53
- ^ а б c d е Племенков, п. 241
- ^ Бросси, Vol. 35, стр. 261
- ^ Бросси, Vol. 35. С. 260–263.
- ^ а б Племенков, п. 242
- ^ Бегли, Кофактор биосинтеза
- ^ Джон Р. Льюис (2000). «Amaryllidaceae, мускарин, имидазол, оксазол, тиазол, пептидные алкалоиды и другие разные алкалоиды». Nat. Prod. Представитель. 17 (1): 57–84. Дои:10.1039 / a809403i. PMID 10714899.
- ^ Химическая энциклопедия: алкалоиды хиназолина. xumuk.ru
- ^ Анишевский, п. 106
- ^ а б Анишевский, п. 105
- ^ Ричард Б. Герберт; Герберт, Ричард Б .; Герберт, Ричард Б. (1999). «Биосинтез растительных алкалоидов и азотистых микробных метаболитов». Nat. Prod. Представитель. 16 (2): 199–208. Дои:10.1039 / a705734b.
- ^ Племенков, стр.231, 246
- ^ Гессе, п. 58
- ^ Племенков, п. 231
- ^ а б c d Химическая энциклопедия: алкалоиды хинолина. xumuk.ru
- ^ а б Анишевский, п. 114
- ^ Орехов, п. 205
- ^ Гессе, п. 55
- ^ а б Племенков, п. 232
- ^ Орехов, п. 212
- ^ Анишевский, п. 118
- ^ а б Анишевский, п. 112
- ^ а б c d е ж Анишевский, п. 113
- ^ Гессе, п. 15
- ^ Saxton, Vol. 1, стр. 467
- ^ Дьюик, стр. 349–350
- ^ а б c Анишевский, п. 119
- ^ Гессе, п. 29
- ^ Гессе, стр. 23–26
- ^ Saxton, Vol. 1, стр. 169
- ^ Saxton, Vol. 5, стр. 210
- ^ а б c d Кеглевич, Петер; Хазаи, Ласло; Калаус, Дьёрдь; Сантай, Чаба (2012). «Модификации основных скелетов винбластина и винкристина». Молекулы. 17 (5): 5893–5914. Дои:10.3390 / молекулы17055893. ЧВК 6268133. PMID 22609781.
- ^ Гессе, стр. 17–18
- ^ Дьюик, п. 357
- ^ а б Анишевский, п. 104
- ^ Гессе, п. 72
- ^ Гессе, п. 73
- ^ Дьюик, п. 396
- ^ Путь PlantCyc: биосинтез эфедрина В архиве 10 декабря 2011 г. Wayback Machine
- ^ Гессе, п. 76
- ^ а б Химическая энциклопедия: алкалоиды колхицина. xumuk.ru
- ^ Анишевский, п. 77
- ^ а б Гессе, п. 81 год
- ^ Бросси, Vol. 23, стр. 376
- ^ а б Гессе, п. 77
- ^ Бросси, Vol. 23, стр. 268
- ^ Бросси, Vol. 23, стр. 231
- ^ а б c d е ж Гессе, п. 82
- ^ Биосинтез спермина
- ^ а б c d е ж Племенков, п. 243
- ^ Химическая энциклопедия: терпены. xumuk.ru
- ^ Бегли, Натуральные продукты: обзор
- ^ Атта-ур-Рахман и М. Икбал Чоудхари (1997). «Дитерпеноид и стероидные алкалоиды». Nat. Prod. Представитель. 14 (2): 191–203. Дои:10.1039 / np9971400191. PMID 9149410.
- ^ Гессе, п. 88
- ^ Дьюик, п. 388
- ^ Племенков, п. 247
- ^ Никотин. Большая Советская Энциклопедия (1969–1978)
- ^ а б c Гринкевич, п. 131
- ^ Г. А. Спиллер Кофеин, CRC Press, 1997 ISBN 0-8493-2647-8
- ^ "Кофеин". DrugBank. Получено 12 февраля 2013.
- ^ "Кокаин". DrugBank. Получено 12 февраля 2013.
- ^ "Кодеин". DrugBank. Получено 12 февраля 2013.
- ^ «Никотин». DrugBank. Получено 12 февраля 2013.
- ^ "Морфий". DrugBank. Получено 12 февраля 2013.
- ^ «Йохимбин». DrugBank. Архивировано из оригинал 30 января 2013 г.. Получено 12 февраля 2013.
- ^ Fattorusso, п. 53
- ^ Томас Акамович; Колин С. Стюарт; Т. У. Пенникотт (2004). Ядовитые растения и родственные токсины, Том 2001. КАБИ. п. 362. ISBN 978-0-85199-614-1.
- ^ Анишевский, п. 13
- ^ Орехов, п. 11
- ^ Гессе, стр.4
- ^ Гринкевич, стр. 122–123
- ^ Орехов, п. 12
- ^ а б Тушар, Аксель; Айли, Самира; Фокс, Эдуардо; Эскубас, Пьер; Оривель, Жером; Николсон, Грэм; Дежан, Ален (2016-01-20). «Арсенал биохимических токсинов из ядовитых муравьев». Токсины. 8 (1): 30. Дои:10.3390 / токсины8010030. ISSN 2072-6651. ЧВК 4728552. PMID 26805882.
- ^ Fattorusso, п. XVII
- ^ Анишевский, стр. 110–111
- ^ а б c d Гессе, п. 116
- ^ а б Гринкевич, п. 132
- ^ Гринкевич, п. 5
- ^ Гринкевич, стр. 132–134
- ^ Гринкевич, стр. 134–136
- ^ Фокс, Эдуардо Гонсалвеш Патерсон (2016). «Ядовитые токсины огненных муравьев». В Гопалакришнаконе, П .; Кальвет, Хуан Дж. (Ред.). Геномика и протеомика яда. Springer Нидерланды. С. 149–167. Дои:10.1007/978-94-007-6416-3_38. ISBN 978-94-007-6415-6.
- ^ Fox, Eduardo G.P .; Сюй, Мэн; Ван, Лэй; Чен, Ли; Лу, Юн-Юэ (2018-05-01). «Быстрое доение свежего яда острокрылых перепончатокрылых». Токсикон. 146: 120–123. Дои:10.1016 / j.toxicon.2018.02.050. ISSN 0041-0101. PMID 29510162.
- ^ Чен, Цзянь; Cantrell, Charles L .; Шан, Хань-у; Рохас, Мария Г. (2009-04-22). «Пиперидиновые алкалоиды из ядовитой железы красного завезенного огненного муравья (Hymenoptera: Formicidae)». Журнал сельскохозяйственной и пищевой химии. 57 (8): 3128–3133. Дои:10.1021 / jf803561y. ISSN 0021-8561. PMID 19326861.
- ^ Fox, Eduardo G.P .; Сюй, Мэн; Ван, Лэй; Чен, Ли; Лу, Юн-Юэ (2018-06-01). «Газовая хроматография и УФ-спектроскопия ядов перепончатокрылых, полученных тривиальным центрифугированием». Краткие данные. 18: 992–998. Дои:10.1016 / j.dib.2018.03.101. ISSN 2352-3409. ЧВК 5996826. PMID 29900266.
- ^ а б c Племенков, п. 253
- ^ Племенков, п. 254
- ^ а б Дьюик, п. 19
- ^ Племенков, п. 255
- ^ Дьюик, п. 305
- ^ Гессе, стр. 91–105
- ^ Хирата, К .; Миямото, К .; Миура, Ю. (1994). "Катарантус розовый L. (Барвинок): Производство виндолина и катарантина в культурах с множественными побегами ». В Bajaj, Ю. П. С. (ред.). Биотехнология в сельском и лесном хозяйстве 26. Лекарственные и ароматические растения. VI. Springer-Verlag. стр.46–55. ISBN 9783540563914.
- ^ а б Гансойер, Андреас; Юстисия, Хосе; Фань, Чун-Ан; Воргулл, Деннис; Пистерт, Фредерик (2007). «Восстановительное образование связи C — C после раскрытия эпоксида посредством переноса электрона». В Крише, Майкл Дж. (ред.). Катализируемое металлом образование восстановительных связей C — C: отход от предварительно приготовленных металлоорганических реагентов. Темы современной химии. 279. Springer Science & Business Media. С. 25–52. Дои:10.1007/128_2007_130. ISBN 9783540728795.
- ^ Фаллер, Брайан А.; Панди, Трайлокья Н. (2011). «Безопасность и эффективность винорелбина в лечении немелкоклеточного рака легкого». Понимание клинической медицины: онкология. 5: 131–144. Дои:10.4137 / CMO.S5074. ЧВК 3117629. PMID 21695100.
- ^ Нго, Куок Ань; Русси, Фанни; Кормье, Энтони; Торет, Сильвиана; Кноссов, Марсель; Генар, Даниэль; Герит, Франсуаза (2009). «Синтез и биологическая оценка Алкалоиды барвинка и гибриды фомопсина ". Журнал медицинской химии. 52 (1): 134–142. Дои:10.1021 / jm801064y. PMID 19072542.
- ^ Хардуэн, Кристоф; Дорис, Эрик; Руссо, Бернар; Миосковски, Чарльз (2002). «Краткий синтез ангидровинбластина из лейрозина». Органические буквы. 4 (7): 1151–1153. Дои:10.1021 / ol025560c. PMID 11922805.
- ^ Морсилло, Сара П .; Мигель, Делия; Campaña, Araceli G .; Сьенфуэгос, Луис Альварес де; Юстисия, Хосе; Куерва, Хуан М. (2014). "Недавние применения Cp2TiCl в синтезе природных продуктов ». Границы органической химии. 1 (1): 15–33. Дои:10.1039 / c3qo00024a.
- ^ Анишевский, п. 142
- ^ Пианаро, Адриана; Fox, Eduardo G.P .; Bueno, Odair C .; Марсайоли, Анита Дж. (15 мая 2012 г.). «Экспресс-анализ конфигурации соленопсинов». Тетраэдр: асимметрия. 23 (9): 635–642. Дои:10.1016 / j.tetasy.2012.05.005. ISSN 0957-4166.
- ^ Гессе, стр. 283–291
- ^ Анишевский, стр. 142–143
- ^ МЫ. Коннер (2009). Тигровая ночная бабочка и шерстистые медведи - поведение, экология и эволюция Arctiidae. Нью-Йорк: Издательство Оксфордского университета. С. 1–10. ISBN 0195327373.
- ^ Кастельс, Ева; Беренбаум, Май Р. (июнь 2006 г.). «Лабораторное разведение Agonopterix alstroemeriana, дефолиативной ядовитой моли (Conium maculatum L.) и влияние пиперидиновых алкалоидов на предпочтение и производительность». Экологическая энтомология. 35 (3): 607–615. Дои:10.1603 / 0046-225x-35.3.607. S2CID 45478867 - через ResearchGate.
- ^ Fox, Eduardo G.P .; У, Сяоцин; Ван, Лэй; Чен, Ли; Лу Юн-Юэ; Сюй Ицзюань (01.02.2019). «Изозоленопсин А из яда королевы быстро выводит из строя конкурентов огненных муравьев». Токсикон. 158: 77–83. Дои:10.1016 / j.toxicon.2018.11.428. ISSN 0041-0101. PMID 30529381. S2CID 54481057.
- ^ Гессе, п. 303
- ^ Гессе, стр. 303–309
- ^ Гессе, п. 309
- ^ Дьюик, п. 335
- ^ Дьердь Матолчи, Миклош Надаси, Виктор Андриска Химия пестицидов, Elsevier, 2002, стр. 21–22. ISBN 0-444-98903-X
- ^ Веселовская, п. 75
- ^ Гессе, п. 79
- ^ Веселовская, п. 136
- ^ Ибогаин: Материалы Первой Международной конференции (Книга Алкалоидов 56). 1950. с. 8. ISBN 978-0-12-469556-6.
- ^ Веселовская, п. 6
- ^ Веселовская, стр. 51–52
Библиография
| Викискладе есть медиафайлы по теме Алкалоид. |
| В Wikiquote есть цитаты, связанные с: Алкалоид |
- Анишевский, Тадеуш (2007). Алкалоиды - секреты жизни. Амстердам: Эльзевир. ISBN 978-0-444-52736-3.
- Бегли, Тадг П. (2009). Энциклопедия химической биологии. ChemBioChem. 10. Вайли. С. 1569–1570. Дои:10.1002 / cbic.200900262. ISBN 978-0-471-75477-0.
- Бросси, Арнольд (1989). Алкалоиды: химия и фармакология. Академическая пресса.
- Дьюик, Пол М (2002). Лекарственные натуральные продукты. Биосинтетический подход. Второе издание. Вайли. ISBN 978-0-471-49640-3.
- Fattorusso, E .; Тальятела-Скафати, О. (2008). Современные алкалоиды: структура, выделение, синтез и биология. Wiley-VCH. ISBN 978-3-527-31521-5.
- Гринкевич Н.И. Сафронич Л.Н. (1983). Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. М.
- Гессен, Манфред (2002). Алкалоиды: проклятие или благословение природы?. Wiley-VCH. ISBN 978-3-906390-24-6.
- Кнунянц, ИЛ (1988). Химическая энциклопедия. Советская энциклопедия.
- Орехов А.П. (1955). Химия алкалоидов (Акад. 2 изд.). М .: СССР.
- Племенков, В.В. (2001). Введение в химию природных соединений. Казань.
- Сакстон, Дж. Э. (1971). Алкалоиды. Специализированный периодический отчет. Лондон: Химическое общество.
- Веселовская, Н.Б .; Коваленко, А.Е (2000). Наркотики. Москва: Триада-Х.
- Подмигивание, М. (2009). «Механизм действия и токсикология токсинов растений и ядовитых растений». Mitt. Юлиус Кюн-Инст. 421: 93–112. Получено 18 марта 2014.