WikiDer > Хигенамин
Эта статья нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Декабрь 2018 г.) |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 1 - [(4-Гидроксифенил) метил] -1,2,3,4-тетрагидроизохинолин-6,7-диол | |
| Другие имена норкоклаурин, деметилкоклаурин | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| КЕГГ | |
| MeSH | хигенамин |
PubChem CID | |
| UNII |
|
| |
| |
| Характеристики | |
| C16ЧАС17NО3 | |
| Молярная масса | 271.316 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хигенамин (норкоклаурин) представляет собой химическое соединение, которое содержится в различных растениях, включая Nandina domestica (фрукты), Aconitum carmichaelii (корень), Asarum heterotropioides, Galium divaricatum (стебель и лоза), Annona squamosa, и Nelumbo nucifera (семена лотоса).
Хигенамин входит в состав пищевых добавок для спорта и похудания, продаваемых в США.[1] Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США получало сообщения о побочных эффектах добавок, содержащих хигенамин, с 2014 года, но риски для здоровья от хигенамина остаются недостаточно изученными.[1]
Законность
Хигенамин, также известный как норкоклаурин HCl, разрешено использовать в составе пищевых добавок в Великобритания, Европа, то Соединенные Штаты Америки и Канада. Его основное применение - пищевые добавки, разработанные для контроля веса, и спортивные добавки.[1] Традиционные составы с хигенамином использовались в китайской медицине на протяжении тысячелетий и поступают из различных источников, включая фрукты и орхидеи. Нет исследований, сравнивающих безопасность современных составов (на основе синтетического хигенамина) с традиционными составами. Тем не менее, он не будет добавлен в каталог «новых пищевых продуктов» ЕС, в котором подробно описаны все пищевые добавки, для которых перед использованием требуется сертификат оценки безопасности.[2]
Наряду со многими другими β2 агонисты, хигенамин запрещен Всемирное антидопинговое агентство для использования в спорте.[3] В 2016 году французский футболист Мамаду Сахо был временно заблокирован УЕФА после положительного результата теста на хигенамин, из-за которого игрок пропустил финал Лиги Европы 2016 года. Запрет был снят после того, как игрок успешно доказал, что не было существенной халатности, так как вещество не было в списке запрещенных, несмотря на препараты той же категории - β2 агонисты - запрещены.[4][5][6][7]
Фармакология
Поскольку хигенамин присутствует в растениях, которые ранее использовались в традиционная медицина, фармакология этого соединения привлекла научный интерес.
На животных моделях было продемонстрировано, что хигенамин β2 агонист адренорецепторов.[8][9][10][11][12] Адренергические рецепторы или адренорецепторы относятся к классу G-белковые рецепторы, и являются наиболее заметными рецепторами в жировой мембрана, помимо того, что она экспрессируется в ткани скелетных мышц. Эти рецепторы жировой мембраны классифицируются как α- или β-адренорецепторы. Хотя у этих адренорецепторов один и тот же посланник, циклический аденозинмонофосфат (цАМФ) конкретный путь трансдукции зависит от типа рецептора (α или β). Хигенамин частично оказывает свое действие за счет активации фермента, аденилатциклаза, ответственный за повышение клеточной концентрации вторичного адренергического мессенджера цАМФ.[13]
На модели грызунов было обнаружено, что хигенамин продуцирует кардиотонический, сосудистая релаксация и бронходилататор последствия.[14][15] В частности, хигенамин через механизм бета-адренорецепторов индуцировал релаксацию у крыс. кавернозное тело, что привело к улучшению расширение сосудов и эректильная функция.
В связи с улучшением сосудорасширяющих сигналов на животных моделях было показано, что хигенамин обладает антиагрегант и антитромботический активность через цАМФ-зависимый путь, предполагающий, что хигенамин может способствовать усилению вазодилатации и целостности артерий.[8][13][15][16]
На людях хигенамин изучается в качестве исследуемого препарата в Китае для использования в качестве фармакологического средства при сердечных стресс-тестах, а также для лечения ряда сердечных заболеваний, включая брадиаритмию.[1] Испытания на людях были относительно небольшими (от 10 до 120 субъектов), и хигенамин вводили внутривенно, чаще всего с использованием постепенных инфузий 2,5 или 5 мг.[1] Хигенамин постоянно увеличивал частоту сердечных сокращений, но по-разному влиял на артериальное давление. В одном небольшом исследовании описывалось влияние хигенамина на сердечный выброс: хигенамин привел к увеличению фракции выброса у 15 пациентов с сердечными заболеваниями.[1]
Токсичность
Безопасность перорального приема хигенамина для людей неизвестна. Во время исследования острой токсичности мышам перорально вводили соединение в дозе 2 г на кг веса тела. Во время исследования ни одна мышь не погибла.[17] В испытаниях на людях внутривенного введения хигенамина субъекты, получавшие хигенамин, сообщали об одышке, учащенном сердцебиении, головокружении, головных болях, стеснении в груди.[1]
Биосинтез
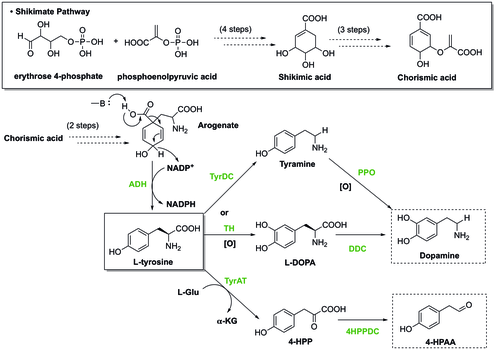
(S) -Норкоклаурин / хигенамин находится в центре бензилизохинолин биосинтез алкалоидов (BIA). Несмотря на большое структурное разнообразие, биосинтез BIAs все имеет общий первый коммитированный промежуточный (S) -норкоклаурин.[18] (S) -норкоклаурин образуется путем конденсации двух производных тирозина, дофамина и 4-гидроксифенилацетальдегида (4-HPAA).
В растениях тирозин синтезируется через Путь Шикимата, во время которого последняя стадия включает декарбоксилирование и дегидрирование арогената с получением L-тирозин. Чтобы генерировать дофамин от тирозина есть два пути. В одном из путей тирозин подвергается декарбоксилированию, катализируемому тирозиндекарбоксилазой (TyrDC), чтобы стать тирамином, за которым затем следует окисление полифенолоксидазы (PPO) с образованием дофамина.[19][20] В качестве альтернативы тирозин может окисляться тирозингидроксилазой (TH) с образованием L-ДОПА, который затем декарбоксилируется DOPA декарбоксилазой (DDC) с образованием дофамина. Кроме того, другой исходный материал, 4-HPAA, образуется в результате первого трансаминирования тирозин-трансаминазой (TyrAT) с образованием 4-гидроксилфенилпирувата (4-HPP) и последующего декарбоксилирования декарбоксилазой 4-HPP. [20]
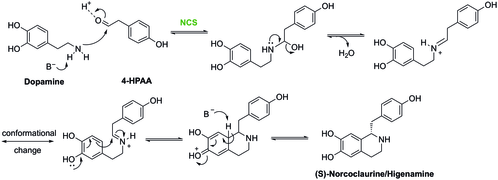
Конденсация дофамина и 4-HPAA с образованием (S) -норкоклаурина катализируется (S) -норкоклауринсинтаза (NCS).[21] Такая реакция - один из видов Реакция Пикте-Шпенглера. В этой реакции Asp-141 и Glu-110 в активном центре NCS участвуют в активации амина и карбонила соответственно для облегчения образования имина. Затем молекула будет циклизована по механизму, показанному ниже, с образованием (S) -ноклаурина.
Рекомендации
- ^ а б c d е ж грамм Коэн, Питер А .; Трэвис, Джон К .; Кейзерс, Питер Х. Дж .; Boyer, Frederick E .; Венхуис, Бастиан Дж. (6 сентября 2018 г.). «Стимулятор хигенамин при похудании и спортивные добавки». Клиническая токсикология. 57 (2): 125–130. Дои:10.1080/15563650.2018.1497171. PMID 30188222. S2CID 52165506.
- ^ "Каталог новинок". Безопасности пищевых продуктов. Европейская комиссия.
- ^ «Запрещенные вещества в любое время». Список запрещенных веществ и методов. Всемирное антидопинговое агентство. 1 января 2016 г.. Получено 21 августа 2016.
- ^ «Мамаду Сако: защитник Ливерпуля находится под следствием из-за неудавшейся проверки на наркотики». BBC. 23 апреля 2016 г.
- ^ «Евро-2016: Мамаду Сахо может сыграть за Францию, поскольку УЕФА решает не продлевать запрет». BBC. 28 мая 2016.
- ^ «Мамаду Сахо - решение УЕФА вызывает ключевые вопросы». Эхо. 28 мая 2016.
- ^ «Мамаду Сахо по-прежнему пропустит ЕВРО-2016, несмотря на то, что его лишили допинга». Получить французский футбол. 29 мая 2016.
- ^ а б Цукияма М., Уэки Т., Ясуда Й, Кикучи Х., Акаиси Т., Окумура Х., Абэ К. (октябрь 2009 г.). «Бета2-адренорецептор-опосредованная релаксация трахеи, индуцированная хигенамином из Nandina domestica Thunberg». Planta Medica. 75 (13): 1393–9. Дои:10.1055 / с-0029-1185743. PMID 19468973.
- ^ Касивада Ю., Аошима А., Икеширо Ю., Чен Ю. П., Фурукава Х., Итоигава М., Фуджиока Т., Михаши К., Косентино Л. М., Моррис-Начке С. Л., Ли К. Х. (январь 2005 г.). «Бензилизохинолиновые алкалоиды и флавоноиды против ВИЧ из листьев Nelumbo nucifera и взаимосвязь структура-активность с родственными алкалоидами». Биоорганическая и медицинская химия. 13 (2): 443–8. Дои:10.1016 / j.bmc.2004.10.020. PMID 15598565.
- ^ Кимура И., Чуй Л.Х., Фудзитани К., Кикучи Т., Кимура М. (май 1989 г.). «Инотропные эффекты (+/-) - хигенамина и его химически родственных компонентов, (+) - R-коклаурина и (+) - S-ретикулина, содержащихся в традиционных китайско-японских лекарствах« буси »и« шин-и » в изолированной сосочковой мышце морской свинки ". Японский журнал фармакологии. 50 (1): 75–8. Дои:10.1254 / jjp.50.75. PMID 2724702.
- ^ Кан YJ, Ли YS, Lee GW, Lee DH, Ryu JC, Yun-Choi HS, Chang KC (октябрь 1999). «Ингибирование активации ядерного фактора каппаВ отвечает за ингибирование индуцибельной экспрессии синтазы оксида азота хигенамином, активным компонентом корня аконита». Журнал фармакологии и экспериментальной терапии. 291 (1): 314–20. PMID 10490919.
- ^ Юн-Чой Х.С., Пё МК, Пак К.М., Чанг К.С., Ли Д.Х. (октябрь 2001 г.). «Антитромботические эффекты хигенамина». Planta Medica. 67 (7): 619–22. Дои:10.1055 / с-2001-17361. PMID 11582538.
- ^ а б Кам С.К., До Дж.М., Чхве Дж.Х., Чон Б.Т., Ро Г.С., Чанг К.С., Хён Дж.С. (2012). «Эффект релаксации и механизм действия хигенамина на кавернозное тело крысы». Международный журнал исследований импотенции. 24 (2): 77–83. Дои:10.1038 / ijir.2011.48. PMID 21956762.
- ^ Бай Г, Ян Й, Ши Цзинь, Лю Цзинь, Чжан Цюй, Чжу Й.Й. (октябрь 2008 г.). «Идентификация хигенамина в Radix Aconiti Lateralis Preparata как агониста бета2-адренергических рецепторов1». Acta Pharmacologica Sinica. 29 (10): 1187–94. Дои:10.1111 / j.1745-7254.2008.00859.x. PMID 18817623.
- ^ а б Pyo MK, Lee DH, Kim DH, Lee JH, Moon JC, Chang KC, Yun-Choi HS (июль 2008 г.). «Энантиоселективный синтез (R) - (+) - и (S) - (-) - хигенамина и их аналогов с эффектами на агрегацию тромбоцитов и экспериментальная модель диссеминированного внутрисосудистого свертывания на животных». Письма по биоорганической и медицинской химии. 18 (14): 4110–4. Дои:10.1016 / j.bmcl.2008.05.094. PMID 18556200.
- ^ Лю В., Сато Й, Хосода Й, Хирасава К., Ханаи Х (ноябрь 2000 г.). «Влияние хигенамина на регуляцию ионного транспорта в дистальном отделе толстой кишки морских свинок». Японский журнал фармакологии. 84 (3): 244–51. Дои:10.1254 / jjp.84.244. PMID 11138724.
- ^ Lo CF, Chen CM (февраль 1997 г.). «Острая токсичность хигенамина у мышей». Planta Medica. 63 (1): 95–6. Дои:10.1055 / с-2006-957619. PMID 9063102.
- ^ Хагель Дж. М., Факкини П. Дж. (Май 2013 г.). «Метаболизм бензилизохинолиновых алкалоидов: век открытий и дивный новый мир». Физиология растений и клеток. 54 (5): 647–72. Дои:10.1093 / pcp / pct020. PMID 23385146.
- ^ Соарес А.Р., Маркиози Р., Сикейра-Соареш Р.К., Барбоса-де-Лима Р., Маркиози Р., Дантас душ Сантуш В., Феррарезе-Филью О. (март 2014 г.). «Роль L-ДОФА в растениях». Сигнализация и поведение растений. 9 (4): e28275. Дои:10.4161 / psb.28275. ЧВК 4091518. PMID 24598311.
- ^ а б Beaudoin GA, Facchini PJ (июль 2014 г.). «Биосинтез бензилизохинолинового алкалоида в опийном маке». Planta. 240 (1): 19–32. Дои:10.1007 / s00425-014-2056-8. PMID 24671624.
- ^ Личман Б.Р., Сула А., Песнот Т., Хейлс ХК, Уорд Дж.М., Keep NH (октябрь 2017 г.). «Структурные данные для допаминового первого механизма норкоклаурин-синтазы». Биохимия. 56 (40): 5274–5277. Дои:10.1021 / acs.biochem.7b00769. ЧВК 5637010. PMID 28915025.