WikiDer > Бензилизохинолин
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 1-бензилизохинолин | |
| Систематическое название ИЮПАК 1- (фенилметил) изохинолин | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| C16ЧАС13N | |
| Молярная масса | 219,28112 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
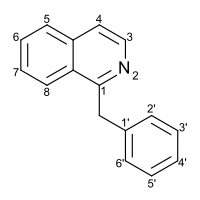
Замена гетероцикл изохинолин в позиции C1 на бензильная группа содержит 1 ‑ бензилизохинолин, наиболее широко исследуемый из множества бензилизохинолин структурный изомеры. 1-бензилизохинолин часть могут быть идентифицированы среди множества соединений, представляющих фармацевтический интерес, таких как моксаверин; но в первую очередь он находится в структурах самых разных растений. натуральные продукты, вместе именуемые бензилизохинолином алкалоиды. Частично этот класс представлен следующими соединениями: папаверин, носкапин, кодеин, морфий, апоморфин, берберин, тубокурарин.
Биосинтез
(S)-Норкоклаурин (хигенамин) был идентифицирован как центральный предшественник 1-бензилтетрагидроизохинолина[1][2] из которых в конечном итоге возникают многочисленные сложные биосинтетические пути. Эти пути в совокупности приводят к структурно разрозненным соединениям, составляющим широкую классификацию растительных натуральных продуктов, называемых бензилизохинолиновыми алкалоидами (BIA), которые были всесторонне обсуждены Хагелем.[3] Биосинтез (S) -норкоклаурин, который катализируется (S) -норкоклауринсинтаза, осуществляется стереоселективной конденсацией дофамин и 4-гидроксифенилацетальдегид (4-HPAA); каждое из этих соединений получают путем множественных ферментативных превращений из L-тирозин.
Интересно отметить, что ранние исследования первоначально выявили норлауданозолин (тетрагидропапаверолин) в качестве предполагаемого центрального предшественника биосинтеза BIAs.[4] Однако более чем через два десятилетия было точно установлено, что (S) -норкоклаурин был центральным предшественником биосинтеза структурно разнообразных BIAs.[1]
Примеры бензилизохинолиновых алкалоидов
Апоморфин (одно дополнительное закрытие кольца)
Морфий (два дополнительных кольца)
Берберин (одно дополнительное замыкание кольца с включенным N-метилом)
Тубокурарин (состоит из двух бензилизохинолиновых единиц)
Смотрите также
Рекомендации
- ^ а б Стадлер, Ричард; Кутчан, Тони М; Зенк, Мейнхарт Х (1989). «(S) -Норкоклаурин является центральным промежуточным продуктом в биосинтезе бензилизохинолиновых алкалоидов». Фитохимия. 28: 1083–1086.
- ^ Hagel, Jillian M; Моррис, Джереми С; Ли, Ын-Чжон; Desgagne-Penix, Isabel; Бросс, Кристалл D; Чанг, Лимей; Чен, Сюэ; Фэрроу, Скотт С; Чжан, Е (2015). «Транскриптомный анализ 20 таксономически родственных растений, продуцирующих бензилизохинолиновые алкалоиды». BMC Plant Biol. 15: 227. Дои:10.1186 / s12870-015-0596-0. ЧВК 4575454. PMID 26384972.
- ^ Hagel, Jillian M; Факкини, Питер Дж (2013). «Метаболизм бензилизохинолиновых алкалоидов: век открытий и дивный новый мир». Физиология растительной клетки. 54: 647–672. Дои:10.1093 / pcp / pct020. PMID 23385146.
- ^ Battersby, A.R .; Бинкс, Р .; Francis, R.J .; McCaldin, D. J .; Рамуз, Х. (1964). «Биосинтез алкалоидов> Часть IV. 1-Бензилизохинолины как предшественники тебаина, кодеина и морфина». J Chem Soc: 3600.





