WikiDer > Шпилька рибозим

В шпилька рибозим это небольшая часть РНК который может действовать как рибозим. Словно рибозим-молот он находится в РНК спутники вирусов растений. Впервые он был идентифицирован в минус-цепи сателлитной РНК вируса кольцевой пятнистости табака (TRSV), где он катализирует саморасщепление и сращивание (перевязка) реакции обрабатывать продукцию катящийся круг вирус репликации на линейные и кольцевые молекулы сателлитной РНК. Рибозим «шпилька» похож на рибозим «головка молотка» в том, что для реакции ему не требуется иона металла.
Биологическая функция
Рибозим шпильки представляет собой мотив РНК, который катализирует реакции процессинга РНК, необходимые для репликации молекул сателлитной РНК, в которые он встроен. Эти реакции являются самопроцессорными, то есть молекула перестраивает свою структуру. Реакции как расщепления, так и присоединения концов опосредуются рибозимным мотивом, что приводит к смеси взаимопревращаемых линейных и кольцевых молекул сателлитной РНК. Эти реакции важны для обработки больших мультимерных молекул РНК, которые генерируются репликация катящегося круга. В конце цикла репликации эти большие промежуточные продукты репликации сателлитной РНК обрабатываются до молекул единичной длины (кольцевой или линейной), прежде чем они могут быть упакованы вирусами и перенесены в другие клетки для дальнейших циклов репликации.[1]

Натуральные и искусственные варианты рибозима шпильки
Рибозим шпильки был идентифицирован только в трех встречающихся в природе последовательностях:
- сателлитная РНК вирус кольцевой пятнистости табака (sTRSV)[3][4]
- сателлитная РНК вируса желтой крапинки цикория (sCYMV)[5]
- сателлитная РНК вирус мозаики арабского происхождения (sARMV)[6]
Меньшие искусственные версии рибозима шпильки были разработаны, чтобы позволить более детальный экспериментальный анализ молекулы.[7] Это обычно используемая стратегия для отделения тех частей молекулы самопроцессорной РНК, которые необходимы для реакций процессинга РНК, от частей, которые выполняют несвязанные функции. Благодаря этому процессу минимальный каталитический домен из 50 нуклеотидов и 14 нуклеотидов субстрат были идентифицированы.[8] Используя эти искусственно полученные последовательности, трансБыл разработан рибозим, который может катализировать расщепление множества молекул субстрата. Эта стратегия была важна тем, что позволяла исследователям (i) применять биохимические методы для ферментативного анализа, (ii) проводить эксперименты для идентификации основных структурных элементов комплекса рибозим-субстрат и (iii) разрабатывать сконструированные рибозимы, которые использовались в биомедицинских целях. приложения, включая предотвращение репликации патогенных вирусов и изучение функции отдельных генов.
Химия реакции
Как и несколько других рибозимов и белковых рибонуклеаз, реакция расщепления шпилечного рибозима генерирует фрагменты РНК с концами, состоящими из 2 ', 3'-циклического фосфата и 5'-гидроксильной группы. Реакция лигирования, по-видимому, представляет собой простое обращение расщепления, то есть ковалентное соединение фрагментов РНК, оканчивающихся 2 ', 3'-циклической фосфатной и 5'-гидроксильной группой с образованием обычной 3'-5 'фосфодиэфирная связь используется как в РНК, так и в ДНК.
Исследования этой реакции в нескольких рибозимах помогли установить, что химия реакции (каталитический механизм) является эндогенным свойством самой молекулы РНК и не опосредуется ионами металлов, как это верно для некоторых белковых ферментов и некоторых других рибозимов.[9] Более того, активность расщепления все еще наблюдается, когда Mg2+ заменяется на [Co (NH3)6]3+.[10] Co3+ связывает NH3 настолько плотно в растворе, что NH3 не диссоциирует в какой-либо заметной степени и, следовательно, не протонируется. Это говорит о том, что катализируемый металлами перенос протона или прямая координация с РНК не происходит, а металлы необходимы только для фолдинга. Кроме того, в кристаллических структурах комплекса рибозим-ингибитор и имитатора переходного состояния было показано, что трехмерная архитектура расщепляет A-1 и G + 1, позиционируя 2'-OH A-1 для in- линия нуклеофильной атаки на ножничную фосфатную связь. Кроме того, G8, A38 и A9, как предполагалось, играют роль в катализе, депротонируя 2'-OH A-1, стабилизируя развивающийся отрицательный заряд пентакоординированных фосфатных атомов кислорода и протонируя уходящую 5'-O группу G + 1.[11][12]
Структура
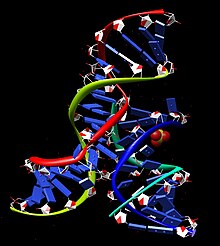
Минимальный комплекс шпильки рибозим-субстрат сворачивается в вторичная структура который включает два домена, каждый из которых состоит из двух коротких базовая пара спирали разделены внутренней петлей. Домен A (спираль 1 - петля A - спираль 2) содержит субстрат и область распознавания первичного субстрата рибозима. Домен B (спираль 3 - петля B - спираль 4) больше по размеру и содержит первичные каталитические детерминанты рибозима. Два домена ковалентно соединены посредством фосфодиэфирной связи, которая соединяет спираль 2 со спиралью 3. Эти домены должны взаимодействовать друг с другом, чтобы произошел катализ.[14]
Когда минимальному комплексу рибозим-субстрат позволяют сворачиваться в условиях низкой ионная сила, два домена стек одна на другой, образуя неактивную протяженную структуру, напоминающую шпильку.[15] Для катализа два домена лежат параллельно друг другу в складке, напоминающей скрепку. В различных публикациях эту РНК называют рибозимом «скрепка» или «шпилька». Несмотря на то, что первое название оказалось более точным, второе стало общепринятой номенклатурой. В лаборатории функциональному взаимодействию между двумя доменами способствует добавление катионы, положительного заряда которого достаточно для преодоления электростатическое отталкивание отрицательно заряженного остова РНК. В природе ассоциации двух доменов способствует комбинация ионов металлов (включая Mg2+) и наличие двух дополнительных спиральных доменов, которые не присутствуют в минимальном комплексе рибозим-субстрат, но служат для обеспечения правильного трехмерного фолдинга. Эти дополнительные домены складываются по спиралям 2 и 3, тем самым способствуя ассоциации двух функциональных доменов посредством так называемого четырехстороннего спирального соединения.[16]
Структура и активность рибозима шпильки были исследованы с использованием широкого спектра дополнительных экспериментальных методов, включая замену нуклеотидов, замену функциональных групп, комбинаторный отбор и др. флуоресцентная спектроскопия, ковалентное сшивание, ЯМР анализ и рентгеновская кристаллография. Этим исследованиям способствовала способность функционального комплекса самостоятельно собираться из сегментов, сделанных твердофазный химический синтез РНК, что позволяет включать большое количество модифицированных нуклеотидов, которые в природе не встречаются в РНК. В совокупности результаты этих экспериментов представляют собой весьма совпадающую картину каталитический циклто есть, как шпилька рибозим связывает свой субстрат, складывается в определенную трехмерную структуру, катализирует реакцию и высвобождает продукт (ы) реакции.[17]
Целевое расщепление РНК и противовирусная активность
Рибозимы-шпильки были модифицированы таким образом, что их можно использовать для нацеливания на расщепление других молекул РНК. Это возможно, потому что в значительной степени субстратная специфичность рибозима шпильки является результатом простого метода Уотсона-Крика. базовая пара внутри спиралей 1 и 2.[18]
Особый интерес представляет разработка рибозимов-шпилек для потенциального терапевтического использования, например, для предотвращения репликации патогенных вирусов. Были созданы и экспрессированы противовирусные рибозимы-шпильки в клетках млекопитающих, и было показано, что клетки, экспрессирующие различные сконструированные рибозимы, устойчивы к инфекции, вызванной ВИЧ-1,[19][20] гепатит Б,[21] и Синдбис вирус.[22]
Рекомендации
- ^ Саймонс, Р.Х. (1997). «Патогенные РНК растений и катализ РНК». Нуклеиновые кислоты Res. 25 (14): 2683–2689. Дои:10.1093 / nar / 25.14.2683. ЧВК 146833. PMID 9207012.
- ^ Alam, S .; Грум-Токарс, В .; Krucinska, J .; Кундрачик, М .; Ведекинд, Дж. (2005). «Конформационная гетерогенность в положении U37 рибозима шпильки, полностью состоящей из РНК, с последствиями для связывания металлов и каталитической структуры S-поворота». Биохимия. 44 (44): 14396–14408. Дои:10.1021 / bi051550i. PMID 16262240.
- ^ Feldstein, PA; Бузаян, JM; Брюнинг, Г. (15 октября 1989 г.). «Две последовательности, участвующие в автолитическом процессинге комплементарной РНК сателлитного вируса кольцевой пятнистости табака». Ген. 82 (1): 53–61. Дои:10.1016/0378-1119(89)90029-2. PMID 2583519.
- ^ Hampel, A; Триц, Р. (13 июня 1989 г.). «Каталитические свойства РНК минимальной (-) последовательности sTRSV». Биохимия. 28 (12): 4929–4933. Дои:10.1021 / bi00438a002. PMID 2765519.
- ^ Рубино, Л; Tousignant, ME; Стегер, G; Капер, JM (сентябрь 1990 г.). «Нуклеотидная последовательность и структурный анализ двух сателлитных РНК, связанных с вирусом желтой пятнистости цикория». Журнал общей вирусологии. 71 (9): 1897–1903. Дои:10.1099/0022-1317-71-9-1897. PMID 1698918.
- ^ Капер, JM; Tousignant, ME; Steger, G (15 июля 1988 г.). «Нуклеотидная последовательность предсказывает округлость и саморасщепление 300-рибонуклеотидного сателлита вируса мозаики арабиса». Сообщения о биохимических и биофизических исследованиях. 154 (1): 318–325. Дои:10.1016 / 0006-291x (88) 90687-0. PMID 3395334.
- ^ Feldstein, PA; Брюнинг, Г. (1993). «Каталитически активная геометрия в обратимой циркуляризации« мини-мономерных »РНК, полученных из комплементарной цепи сателлитной РНК вируса кольцевой пятнистости табака». Исследования нуклеиновых кислот. 21 (8): 1991–1998. Дои:10.1093 / nar / 21.8.1991. ЧВК 309442. PMID 7684131.
- ^ Hampel, A; Триц, Р. (1989). «Каталитические свойства РНК минимальной (-) последовательности sTRSV». Биохимия. 28 (12): 4929–4933. Дои:10.1021 / bi00438a002. PMID 2765519.
- ^ Мюррей, Дж. Б .; Сейхан, А. А .; Уолтер, Н.Г .; Burke, J.M .; Скотт, В. Г. (1998). «Головка молотка, шпилька и рибозимы VS являются каталитически эффективными только в моновалентных катионах» (PDF). Химия и биология. 5 (10): 587–595. Дои:10.1016 / S1074-5521 (98) 90116-8. PMID 9818150.
- ^ Янг, К. Дж .; Gill, F .; Грасби, Дж. А. (1997-10-01). «Ионы металлов играют пассивную роль в реакции, катализируемой рибозимом шпильки». Исследования нуклеиновых кислот. 25 (19): 3760–3766. Дои:10.1093 / nar / 25.19.3760. ISSN 0305-1048. ЧВК 146958. PMID 9380495.
- ^ Rupert, P. B .; Ферре-Д'Амаре, А. Р. (2001-04-12). «Кристаллическая структура комплекса шпильки рибозим-ингибитор с последствиями для катализа». Природа. 410 (6830): 780–786. Bibcode:2001Натура.410..780р. Дои:10.1038/35071009. ISSN 0028-0836. PMID 11298439.
- ^ Руперт, Питер Б.; Massey, Archna P .; Сигурдссон, Снорри Тх; Ферре-Д'Амаре, Адриан Р. (15 ноября 2002 г.). «Стабилизация переходного состояния каталитической РНК». Наука. 298 (5597): 1421–1424. Bibcode:2002Наука ... 298.1421R. Дои:10.1126 / science.1076093. ISSN 1095-9203. PMID 12376595.
- ^ Salter, J .; Krucinska, J .; Alam, S .; Грум-Токарс, В .; Ведекинд, Дж. Э. (2006). «Вода в активном центре шпильчатого рибозима, полностью состоящего из РНК, и влияние вариантов основания Gua8 на геометрию переноса фосфорила». Биохимия. 45 (3): 686–700. Дои:10.1021 / bi051887k. ЧВК 2546605. PMID 16411744.
- ^ Мясник, С. Э .; Хекман, Дж. Э .; Берк, Дж. М. (1995). «Восстановление активности рибозима шпильки после разделения функциональных доменов». Журнал биологической химии. 270 (50): 29648–29651. Дои:10.1074 / jbc.270.50.29648. PMID 8530348.
- ^ Эстебан, Дж. А .; Уолтер, Н.Г .; Kotzorek, G .; Хекман, Дж. Э .; Берк, Дж. М. (1998). «Структурная основа гетерогенной кинетики: реинжиниринг рибозима шпильки» (PDF). Труды Национальной академии наук Соединенных Штатов Америки. 95 (11): 6091–6096. Bibcode:1998PNAS ... 95.6091E. Дои:10.1073 / пнас.95.11.6091. ЧВК 27590. PMID 9600922.
- ^ Nahas, M .; Wilson, T. J .; Шляпа.; Лилли, Д. М. Дж. (2005). «Сворачивание и катализ рибозима шпильки». Сделки Биохимического Общества. 33 (Pt 3): 461–465. Дои:10.1042 / BST0330461. PMID 15916541.
- ^ Cochrane, J. C .; Стробель, С. А. (2008). «Каталитические стратегии саморасщепляющихся рибозимов». Отчеты о химических исследованиях. 41 (8): 1027–1035. Дои:10.1021 / ar800050c. PMID 18652494.
- ^ Chowrira, BM; Берк, JM (1991). «Связывание и расщепление нуклеиновых кислот рибозимом« шпилька ». Биохимия. 30 (35): 8518–8522. Дои:10.1021 / bi00099a003. PMID 1909564.
- ^ Ю, М; Ojwang, J; Ямада, О; Hampel, A; Рапаппорт, Дж; Луни, Д; Вонг-Стаал, Ф (1993). «Рибозим в виде шпильки подавляет экспрессию различных штаммов вируса иммунодефицита человека типа 1». Труды Национальной академии наук Соединенных Штатов Америки. 90 (13): 6340–6344. Bibcode:1993PNAS ... 90.6340Y. Дои:10.1073 / пнас.90.13.6340. ЧВК 46924. PMID 8327516.
- ^ Пуэрта-Фернандес Э, Баррозо-дель Хесус А, Ромеро-Лопес С, Тапиа Н., Мартинес М.А., Берзал-Эрранц А. (10 июня 2005 г.). «Ингибирование репликации ВИЧ-1 с помощью РНК, направленной против области LTR». СПИД. 19 (9): 863–870. Дои:10.1097 / 01.aids.0000171399.77500.e0. PMID 15905666.
- ^ Zu Putlitz, J .; Yu, Q .; Burke, J.M .; Жезлы, Дж. Р. (1999). «Комбинаторный скрининг и внутриклеточная противовирусная активность шпилечных рибозимов, направленных против вируса гепатита B». Журнал вирусологии. 73 (7): 5381–5387. Дои:10.1128 / JVI.73.7.5381-5387.1999. ЧВК 112594. PMID 10364285.
- ^ Zhang, Z .; Берк, Дж. (2005). «Ингибирование репликации вируса рибозимом: мутационный анализ сайта и механизма противовирусной активности». Журнал вирусологии. 79 (6): 3728–3736. Дои:10.1128 / JVI.79.6.3728-3736.2005. ЧВК 1075678. PMID 15731266.
дальнейшее чтение
- Доэрти, EA; Дудна Я.А. (2001). «Структуры и механизмы рибозима». Annu Rev Biophys Biomol Struct. 30: 457–475. Дои:10.1146 / annurev.biophys.30.1.457. PMID 11441810.
- Ферре-Д'Амаре, АР; Руперт ПБ (2002). «Шпилька рибозима: от кристаллической структуры к функции». Biochem Soc Trans. 30 (Pt 6): 1105–1109. Дои:10.1042 / BST0301105. PMID 12440983.