WikiDer > Галоформная реакция - Википедия
| Галоформная реакция | |
|---|---|
| Названный в честь | Адольф Либен |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | галоформ-реакция |
В галоформная реакция химическая реакция, где галоформ (CHX3, где X - галоген) производится исчерпывающим галогенирование из метил кетон (RCOCH3, где R может быть либо атомом водорода, либо алкил или арильная группа), при наличии основание.[1][2][3] Реакция может быть использована для преобразования ацетильные группы в карбоксильные группы или производить хлороформ (CHCl3), бромоформ (CHBr3), или же йодоформ (CHI3).
Механизм
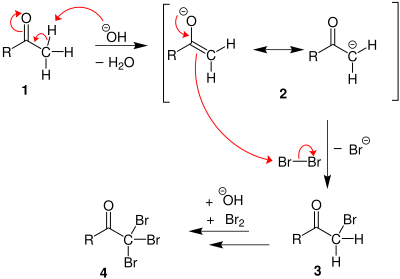
На первом этапе галоген диспропорционирует в присутствии гидроксид чтобы получить галогенид и гипогалит (например, с бромом, но реакция такая же в случае хлора и йода; следует только заменить Br на Cl или I):
Если присутствует вторичный спирт, он окисляется гипогалитом до кетона:
Если присутствует метилкетон, он реагирует с гипогалитом в трехступенчатом процессе:
1. В основных условиях кетон претерпевает кето-енольная таутомеризация. Енолят подвергается электрофильной атаке гипогалита (содержащего галоген с формальным зарядом +1).
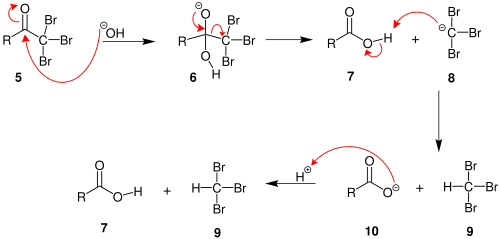
2. Когда положение α (альфа) полностью галогенировано, молекула подвергается нуклеофильное ацильное замещение гидроксидом, с −CX3 будучи уходящая группа стабилизируется тремя электроноакцепторные группы. На третьем этапе −CX3 анион отрывает протон либо от растворителя, либо от карбоновой кислоты, образованной на предыдущем этапе, и образует галоформу. По крайней мере, в некоторых случаях (хлоралгидрат) реакция может остановиться и промежуточный продукт выделен, если условия являются кислыми и используется гипогалит.
Объем
Субстраты широко ограничиваются метилкетонами и вторичными спирты окисляется до метилкетонов, таких как изопропанол. Единственный первичный спирт и альдегид пройти эту реакцию этиловый спирт и ацетальдегид, соответственно. 1,3-дикетоны, такие как ацетилацетон также дают галоформную реакцию. β-кетокислоты, такие как ацетоуксусная кислота также даст тест при нагревании. Ацетилхлорид и ацетамид не подходят для этого теста. Используемый галоген может быть хлор, бром, йод или же гипохлорит натрия.[4] Фтороформ (CHF3) не может быть приготовлен этим методом, так как для этого потребуется наличие очень нестабильного гипофторит ион. Однако кетоны со структурой RCOCF3 расщепляются при обработке основанием с образованием фтороформа; это эквивалентно второму и третьему этапам описанного выше процесса.
Приложения
Лабораторные весы
Эта реакция лежит в основе йодоформного теста, который в истории обычно использовался как химический тест для определения присутствия метилкетона или вторичного спирта, окисляемого до метилкетона. При использовании в качестве реагентов йода и гидроксида натрия положительная реакция дает йодоформ, который является твердым веществом при комнатной температуре и имеет тенденцию выпадать в осадок из раствора, вызывая характерную мутность.
В органическая химия, эта реакция может быть использована для превращения концевого метилкетона в аналогичную карбоновую кислоту.
Промышленно
Раньше он использовался для промышленного производства йодоформа, бромоформа и даже хлороформа.[нужна цитата]
Как побочный продукт хлорирования воды
Хлорирование воды может привести к образованию галоформ, если вода содержит подходящие химически активные примеси (например, гуминовая кислота).[5][6] Есть опасения, что такие реакции могут привести к присутствию канцерогенных соединений в питьевой воде.[7]
История
Галоформная реакция - одна из старейших органические реакции известен.[8] В 1822 г. Жорж-Симон Серуллас добавили металлический калий к раствору йод в этиловый спирт и вода с образованием формиата калия и йодоформа, что на языке того времени называлось гидроиодид углерода.[9] В 1832 г. Юстус фон Либих сообщил о реакции хлорал с гидроксид кальция с образованием хлороформа и формиата кальция.[10] Реакция была открыта заново Адольф Либен в 1870 г.[11] Йодоформный тест еще называют Либен галоформная реакция. Обзор галоформной реакции с историческим разделом был опубликован в 1934 году.[2]
Рекомендации
- ^ Марш, Джерри; Смит, Майкл Б. (2007). Книп, A.C. (ред.). Мартовская продвинутая органическая химия: реакции, механизмы и структура (6-е изд.). Хобокен: Джон Уайли и сыновья. п. 484. ISBN 9780470084946.
- ^ а б Рейнольд К. Фьюсон и Бентон А. Булл (1934). «Галоформная реакция». Химические обзоры. 15 (3): 275–309. Дои:10.1021 / cr60052a001.
- ^ Чакрабартти, в Трахановском, Окисление в органической химии, стр. 343–370, Academic Press, New York, 1978
- ^ Бейн, Райан М .; Пуллиам, Кристофер Дж .; Raab, Shannon A .; Повара, Р. Грэм (2016). «Химический синтез, ускоренный бумажным распылением: галоформная реакция». Журнал химического образования. 93 (2): 340–344. Bibcode:2016JChEd..93..340B. Дои:10.1021 / acs.jchemed.5b00263. ISSN 0021-9584.
- ^ Ладья, Йоханнес Дж. (1977). «Реакции хлорирования фульвокислот в природных водах». Экологические науки и технологии. 11 (5): 478–482. Bibcode:1977EnST ... 11..478R. Дои:10.1021 / es60128a014. ISSN 0013-936X.
- ^ Рекхоу, Дэвид А .; Певец, Филипп С .; Малькольм, Рональд Л. (1990). «Хлорирование гуминовых материалов: образование побочных продуктов и химическая интерпретация». Экологические науки и технологии. 24 (11): 1655–1664. Bibcode:1990EnST ... 24.1655R. Дои:10.1021 / es00081a005. ISSN 0013-936X.
- ^ Бурман, Джорджия (февраль 1999 г.). «Побочные продукты обеззараживания питьевой воды: обзор и подход к оценке токсичности». Перспективы гигиены окружающей среды. 107 Дополнение 1: 207–17. Дои:10.1289 / ehp.99107s1207. ЧВК 1566350. PMID 10229719.
- ^ Ласло Курти и Барбара Чако (2005). Стратегические применения названных реакций в органическом синтезе. Амстердам: Эльзевир. ISBN 0-12-429785-4.
- ^ Суреллас, Жорж-Симон (май 1822 г.). Примечания о гидриодате калия и гидриодистом кислоте. - Hydriodure de carbone; moyen d'obtenir, à l'instant, ce composé triple [Заметки о гидроиодиде калия и иодистоводородной кислоте - гидроиодиде углерода; средства мгновенного получения этого соединения трех элементов] (На французском). Мец, Франция: Антуан. На страницах 17–20 Surellas производил йодоформ, пропуская смесь паров йода и пара над раскаленными углями. Однако позже, на страницах 28–29, он произвел йодоформ, добавив металлический калий к раствору йода в этаноле (который также содержал немного воды).
- ^ Либих, Юстус фон (1832). "Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen" [О соединениях, образующихся при реакции хлора со спиртом [этанолом], эфиром [диэтиловым эфиром], маслообразующим газом [этиленом] и уксусным спиртом [ацетоном]]. Annalen der Physik und Chemie. 2-я серия. 100 (2): 243–295. Bibcode:1832АнП ... 100..243л. Дои:10.1002 / andp.18321000206.
На страницах 259–265 Либих описывает Chlorkohlenstoff («хлористый углерод», хлороформ), но на стр. 264, Либих неправильно утверждает, что эмпирическая формула хлороформа - C2Cl5. С п. 259: "Chlorkohlenstoff. Man erhält diese neue Verbindung, wenn man Chloral mit ätzenden Alkalien, Kalkmilch oder Barytwasser in Ueberschuss vermischt und das Gemenge destillirt". (Хлороформ. Это новое соединение получают, когда смешивают хлорал с избытком едких щелочей, известковое молоко [раствор гидроксида кальция] или баритовую воду [раствор гидроксида бария] и [затем] перегоняют смесь.) - ^ Видеть:
- Либен, Адольф (1870). "Ueber Entstehung von Jodoform und Anwendung dieser Reaction in der chemischen Analyze" [Об образовании йодоформа и применении этой реакции в химическом анализе]. Annalen der Chemie. Дополнение. (на немецком). 7: 218–236.
- Либен, Адольф (1870). "Nachschrift zur Abhandlung über Entstehung von Jodoform und Anwendung dieser Reaction in der chemischen Analyze" [Постскриптум к статье об образовании йодоформа и применении этой реакции в химическом анализе]. Annalen der Chemie. Дополнение. (на немецком). 7: 377–378.