WikiDer > Свинец стифнат
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Свинец (II) 2,4,6-тринитробензол-1,3-бис (олат) | |
| Другие имена 2,4,6-тринитробензол-1,3-диолат свинца Свинец 2,4,6-тринитро-м-фенилен диоксид 1,3-Бензендиол, 2,4,6-тринитро-, свинцовая (2+) соль (1: 1) Свинец трицинатный Свинец тринитрорезорцинат Трицинат[1] | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.035.703 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| Номер ООН | 0130 |
| |
| |
| Характеристики | |
| C6HN3О8Pb | |
| Молярная масса | 450,288 г / моль |
| Плотность | 3,06 - 3,1 г см−3 |
| Взрывоопасные данные | |
| Чувствительность к ударам | Высоко |
| Чувствительность к трению | Высоко |
| Скорость детонации | 5200 м / с |
| Опасности | |
| Паспорт безопасности | Оксфордский паспорт безопасности материалов |
Классификация ЕС (DSD) (устарело) | Вредно (X), Опасно для окружающей среды (N), Взрывоопасно (E) |
| NFPA 704 (огненный алмаз) | |
| 330 ° С (626 ° F, 603 К) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
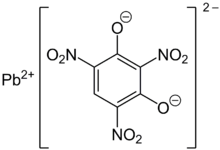
Свинец стифнат (свинец 2,4,6-тринитрорезорцинат, С6HN3О8Pb), название которого происходит от стифиновая кислота, является взрывной используется как компонент в грунтовка и детонатор смеси для менее чувствительных вторичные взрывчатые вещества. Стифнат свинца мало растворяется в воды и метанол.[2] Образцы стифната свинца различаются по цвету от желтого до золотого, оранжевого, красновато-коричневого, до коричневого. Стифнат свинца известен в виде различных полиморфов, гидратов и основных солей. Существуют нормальный моногидрат стифната свинца, одноосновный стифнат свинца, трехосновный дигидрат стифната свинца и пятиосновный дегидрат стифната свинца, а также α, β полиморфы стифната свинца.
Стифнат свинца образует шестигранные кристаллы моногидрат и маленькие прямоугольные кристаллы. Стифнат свинца особенно чувствителен к огню и выделению статичное электричество. Особенно чувствительны длинные тонкие кристаллы. Стифнат свинца не вступает в реакцию с другими металлами и менее чувствителен к ударам и трению, чем гремучая ртуть или азид свинца. Он стабилен при хранении даже при повышенных температурах. Как и другие вести-содержащие соединения, стифнат свинца токсичен из-за тяжелый металл отравление.
Подготовка
Хотя это никогда не подтверждалось, стифнат свинца мог быть обнаружен Питер Грисс (из Тест Грисса известность) в 1874 г. В 1919 г. Эдмунд Герц впервые установил получение безводного нормального стифната свинца реакцией стифната магния с ацетатом свинца в присутствии азотной кислоты.[3][4]
- {C6N3О8} MgH2O + Pb (CH3CO2)2 → {C6N3О8} PbH2O + Mg (CH3CO2)2
Структура
Нормальный стифнат свинца существует в виде α- и β-полиморфов, причем оба являются моноклинными кристаллами. Центры свинца семикоординатны и соединены кислородными мостиками. Молекула воды скоординирована с металлом, а также связана водородными связями с анионом. Многие из расстояний Pb-O короткие, что указывает на некоторую степень ковалентности. Ионы стифната лежат примерно в параллельных плоскостях, связанных атомами Pb.[5][6]
Характеристики
Теплота образования стифната свинца -835 кДж моль.−1. Потеря воды приводит к образованию чувствительного безводного материала плотностью 2,9 г / см3.−3. Разница в цветах остается невыясненной.[7] Стифнат свинца имеет скорость детонации 5,2 км / с и температуру взрыва 265–280 ° C через пять секунд.[8]
Приложения
Стифнат свинца в основном используется в стрелковом оружии. боеприпасы для военного и коммерческого применения. Он служит первичное взрывчатое вещество с порохом огнестрельного оружия, который не загорится при простом ударе.[9] Стифнат свинца также используется в качестве грунтовки в микродвигателях для небольших спутниковых станций.[10]
Рекомендации
- ^ ECHA, Европейское химическое агентство «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2014-10-22. Получено 2014-10-17.CS1 maint: заархивированная копия как заголовок (ссылка на сайт)
- ^ Жак Буало, Клод Фокиньон, Бернар Хюбер и Ханс Х. Мейер (2009). «Взрывчатка». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a10_143.pub2.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Дж. Р. Пейн (1994). «Термохимия стифната свинца». Термохимика Акта. 242: 13–21. Дои:10.1016/0040-6031(94)85003-8.
- ^ Жак Буало; Клод Фокиньон; Бернар Хюбер; Ханс Х. Мейер (2009). Взрывчатые вещества. Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a10_143.pub2. ISBN 978-3527306732.
- ^ Пирс-Батлер, MA (1984). «Структура свинцовой соли моногидрата 2,4,6-тринитро-1,3-бензолдиола (альфа-полиморф)». Acta Crystallogr. 40: 63–65. Дои:10.1107 / S0108270184003036.
- ^ Пирс-Батлер, MA (1982). «Структуры бариевой соли моногидрата 2,4,6-тринитро-1,3-бензолдиола и изоморфной соли свинца (бета-полиморф)». Acta Crystallogr. 38 (12): 3100–3104. Дои:10.1107 / S0567740882010966.
- ^ Роберт Матяш; Джи Пачман (2013). Первичные взрывчатые вещества. Springer Science & Business Media. Дои:10.1007/978-3-642-28436-6. ISBN 978-3-642-28435-9. S2CID 199492549.
- ^ Хайман Хенкин; Рассел МакГилл (1952). «Скорость взрывного разложения взрывчатых веществ. Экспериментальные и теоретические кинетические исследования в зависимости от температуры». Ind. Eng. Chem. 44 (6): 1391–1395. Дои:10.1021 / ie50510a054.
- ^ Грей, Теодор (2009). "Flash Bang". Популярная наука.
- ^ Дэниел В. Янгнер; и другие. (2000). "Мегапиксельные массивы микродвигателей MEMS для малых спутниковых станций". 14-я ежегодная конференция Honeywell Technology / УрГУ по малым спутникам.
