WikiDer > Связка металл-металл
В неорганическая химия, металл-металл связи описывают притягивающие взаимодействия между металлическими центрами. Самые простые примеры встречаются в биметаллических комплексах. Связи металл-металл могут быть «поддержанными», т.е. сопровождаться одним или несколькими мостиковые лиганды, или "неподдерживаемый". Они также могут варьироваться в зависимости от порядка облигаций. Тема соединения металл-металл обычно обсуждается в рамках координационная химия,[1] но тема связана с расширенным металлическое соединение, который описывает взаимодействия между металлами в протяженных твердых телах, таких как массивные металлы и субгалогениды металлов.[2]
Связи металл-металл без подложки
Главный пример комплекса с неподдерживаемой связью металл-металл: декарбонил диманганца, Mn2(CO)10. Многие металлические кластеры содержат несколько неподдерживаемых связей M-M. Некоторые примеры: M3(CO)12 (M = Ru, Os) и Ir4(CO)12.
Подкласс безопорных решеток металл-металл: соединения с линейной цепью. В таких случаях связь М-М является слабой, о чем свидетельствуют более длинные связи М-М и склонность таких соединений к диссоциации в растворе.
Связи металл-металл на носителе
Ранним примером связи металл-металл на опоре является димер дикарбонила циклопентадиенила железа, [(C5ЧАС5) Fe (CO)2]2. В преобладающих изомерах этого комплекса два центра Fe соединены не только связью Fe-Fe, но и связью. мостиковые лиганды CO. Связанные циклопентадиенилрутений дикарбонил димер имеет облигацию Ru-Ru без поддержки. Многие металлические кластеры содержат несколько поддерживаемых связей M-M. Некоторые примеры Fe3(CO)12 и Co4(CO)12.
Множественные связи металл-металл
Гекса (трет-бутокси) дитольфрам (III), с тройной связью металл-металл.
Хром (II) ацетатс четверной связью металл-металл.
Помимо одинарных связей M-M, пары металлов могут быть связаны двойными, тройными, четырехместный, а в некоторых случаях пятикратные облигации.[3] Выделяемые комплексы с кратными связями наиболее распространены среди переходные металлы в середине d-блок, Такие как рений, вольфрам, технеций, молибден и хром. Типичная компаниялиганды являются π-донорами, а не π-акцепторами.[4] Хорошо изученными примерами являются тетраацетаты, Такие как тетраацетат димолибдена (четырехкратная связь) и тетраацетат диродия (одинарная облигация). Тетраацетаты друтения смешанной валентности имеют дробные порядки связей M-M, т.е. 2,5 для [Ru2(OAc)4(ЧАС2O)2]+.[5]
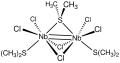
Комплексы Nb2Икс6(SR2)3 принимают биоктаэдрические структуры с разделением граней (X = Cl, Br; SR2 = тиоэфир). Как димеры Nb (III), они имеют двойные связи металл-металл, максимально возможные для пары металлов с d2 конфигурация.[6] Гекса (трет-бутокси) дитольфрам (III) является хорошо изученным примером комплекса с тройной связью металл-металл.[7]
Рекомендации
- ^ Берри, Джон Ф .; Лу, Конни С. (2017). «Металл – Металлические облигации: от основ к применению». Неорганическая химия. 56 (14): 7577–7581. Дои:10.1021 / acs.inorgchem.7b01330. PMID 28715854.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Радиус, U .; Брехер, Ф. (2006). "'Смело передавать четверную связь металл – металл ». Энгью. Chem. Int. Эд. 45 (19): 3006–3010. Дои:10.1002 / anie.200504322. PMID 16642513.
- ^ Cotton, F. A .; Уолтон, Р. А. (1993). Множественные связи между атомами металла. Оксфорд: Oxford University Press. ISBN 0-19-855649-7.
- ^ Акино, Мануэль А.С. (1998). «Тетракарбоксилаты дирутения и диосмия: синтез, физические свойства и применение». Обзоры координационной химии. 170: 141–202. Дои:10.1016 / S0010-8545 (97) 00079-9.
- ^ Какея, Масаки; Фуджихара, Такаши; Нагасава, Акира (2006). «Ди-μ-хлор-μ- (диметилсульфид) -бис [дихлор (диметилсульфид) ниобий (III)]». Acta Crystallographica Section e Отчеты о структуре онлайн. 62 (3): m553 – m554. Дои:10.1107 / S1600536806005149.
- ^ Бродерик, Эрин М .; Браун, Сэмюэл С .; Джонсон, Марк Дж. А. (2014). «Гекса (алкоксиды) димолибдена и вольфрама». Неорганические синтезы. 36: 95–102. Дои:10.1002 / 9781118744994.ch18.