WikiDer > Циклопентадиенил-дикарбонилдимер железа
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Ди-μ-карбонилдикарбонилбис (η5-циклопента-2,4-диен-1-ил) диирон | |
| Другие имена Бис (циклопентадиенил) тетракарбонилдиирон, Ди (циклопентадиенил) тетракарбонилдиирон, Бис (дикарбонилциклопентадиенилирон) | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.032.057 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C14ЧАС10Fe2О4 | |
| Молярная масса | 353,925 г / моль |
| Внешность | Темно-фиолетовые кристаллы |
| Плотность | 1,77 г / см3, твердый |
| Температура плавления | 194 ° С (381 ° F, 467 К) |
| Точка кипения | разложение |
| нерастворимый | |
| Растворимость в других растворителях | бензол, ТГФ, хлороуглероды |
| Структура | |
| искаженный восьмигранный | |
| 3.1 D (бензольный раствор) | |
| Опасности | |
| Главный опасности | Источник CO |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| H228, H302, H331, H330 | |
| Родственные соединения | |
Родственные соединения | Fe (C5ЧАС5)2 Fe (CO)5 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
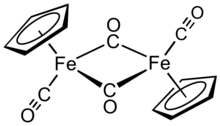
Циклопентадиенил-дикарбонилдимер железа является металлоорганическое соединение с формулой [(η5-C5ЧАС5) Fe (CO)2]2, часто сокращенно Cp2Fe2(CO)4, [CpFe (CO)2]2 или даже Fp2, с разговорным названием «фип димер». Это темно-красновато-пурпурное кристаллическое твердое вещество, которое легко растворяется в умеренно полярных органических растворителях, таких как хлороформ и пиридин, но менее растворим в четыреххлористый углерод и сероуглерод. Cp2Fe2(CO)4 нерастворим в воде, но устойчив к ней. Cp2Fe2(CO)4 достаточно устойчив к хранению на воздухе и служит удобным исходным материалом для доступа к другим Fp (CpFe (CO)2) производные (описаны ниже).[1]
Структура
В растворе Cp2Fe2(CO)4 можно считать димерным полусэндвич сложный. Он существует в трех изомерных формах: СНГ, транс, и безмостовая, открытая форма. Эти изомерные формы различаются положением лигандов. В СНГ и транс изомеры различаются взаимным расположением C5ЧАС5 (Cp) лиганды. В СНГ и транс изомеры имеют формулировку [(η5-C5ЧАС5) Fe (CO) (μ-CO)]2, то есть два лиганда CO являются концевыми, тогда как два других лиганда CO являются мостами между атомами железа. В СНГ и транс изомеры взаимно превращаются через открытый изомер, который не имеет мостиковых лигандов между атомами железа. Вместо этого он сформулирован как (η5-C5ЧАС5) (OC)2Fe-Fe (CO)2(η5-C5ЧАС5) - металлы удерживаются вместе железо-железной связью. В состоянии равновесия СНГ и транс изомеры преобладают.
Кроме того, известно, что концевые и мостиковые карбонилы претерпевают обмен: транс изомер может подвергаться мостик-терминальному обмену лигандом CO через открытый изомер или через скручивающее движение, не проходя через открытую форму. Напротив, мостиковые и концевые лиганды CO СНГ изомер может обмениваться только через открытый изомер.[2]
В растворе СНГ, транс, и открытые изомеры быстро взаимопревращаются при комнатной температуре, в результате чего молекулярная структура текучий. Процесс потока для димера дикарбонила циклопентадиенил-железа происходит быстрее, чем по шкале времени ЯМР, так что только усредненный одиночный сигнал Cp наблюдается в 1H ЯМР спектр при 25 ° С. Точно так же 13C ЯМР В спектре наблюдается один резкий сигнал CO при температуре выше -10 ° C, в то время как сигнал Cp становится более резким до одного пика при температуре выше 60 ° C. Исследования ЯМР показывают, что СНГ изомер немного больше, чем транс изомер при комнатной температуре, при этом количество открытой формы невелико.[2] Процесс потока недостаточно быстр, чтобы производить усреднение в ИК-спектр. Таким образом, для каждого изомера наблюдается три поглощения. Мостиковые лиганды CO появляются на высоте около 1780 см.−1 тогда как концевые лиганды CO наблюдаются на уровне около 1980 см−1.[3]
Твердотельная молекулярная структура обоих СНГ и транс изомеры были проанализированы рентгеновский снимок и нейтронография. Расстояние Fe – Fe и длины связей Fe – C одинаковы в Fe2C2 ромбовидные, точно плоские Fe2C2 четырехчленное кольцо в транс изомер против свернутого ромбовидного СНГ под углом 164 °, и значительные искажения в кольце Cp транс изомер, отражающий различные популяции Cp-орбиталей.[4] Хотя в более старых учебниках показано, что два атома железа связаны друг с другом, теоретический анализ указывает на отсутствие прямой связи Fe – Fe.[5] Однако из-за двусмысленности в том, что представляет собой залог, было высказано особое мнение.[6]
Усредненная структура этих изомеров Cp2Fe2(CO)4 приводит к дипольный момент из 3,1D в бензол.[7]
Синтез
Cp2Fe2(CO)4 был впервые подготовлен в 1955 году в Гарварде Джеффри Уилкинсон используя тот же метод, который используется сегодня: реакция пентакарбонил железа и дициклопентадиен.[6][8]
- 2 Fe (CO)5 + C10ЧАС12 → (η5-C5ЧАС5)2Fe2(CO)4 + 6 СО + Н2
В этом препарате дициклопентадиен трещины дать циклопентадиен, который реагирует с Fe (CO)5 с потерей CO. После этого пути фотохимического и теплового путей тонко различаются, но оба влекут за собой формирование гидрид средний.[4] Метод используется в учебной лаборатории.[3]
Реакции
Хотя не представляет большой коммерческой ценности, Fp2 это рабочая лошадка в металлоорганическая химия потому что он недорогой, а производные FpX надежны (X = галогенид, органил).
"Fp−"(FpNa и FpK)
Восстановительное расщепление [CpFe (CO)2]2 (формально комплекс железа (I)) дает производные щелочного металла, формально производные циклопентадиенильного дикарбонильного аниона железа, [CpFe (CO)2]− или называется Fp− (формально железо (0)), которые, как предполагается, существуют как плотная ионная пара. Типичным восстановителем является металлический натрий или амальгама натрия;[9] NaK сплав графит калия (KC8) и триалкилборгидриды щелочных металлов. [CpFe (CO)2] Na - широко изученный реагент, поскольку он легко алкилируется, ацилируется или металлируется при обработке подходящим электрофил.[10] Это отличный SN2 нуклеофил, на один-два порядка более нуклеофильный, чем тиофенолят, PhS– при взаимодействии с первичными и вторичными алкилбромидами.[11]
- [CpFe (CO)2]2 + 2 Na → 2 CpFe (CO)2Na
- [CpFe (CO)2]2 + 2 KBH (C2ЧАС5)3 → 2 CpFe (CO)2K + H2 + 2 Б (С2ЧАС5)3
Обработка NaFp алкилом галогенид (RX, X = Br, I) производит FeR (η5-C5ЧАС5) (CO)2
- CpFe (CO)2K + CH3I → CpFe (CO)2CH3 + KI
Fp2 также может расщепляться щелочными металлами[12] и по электрохимическое восстановление.[13][14]
FpX (X = Cl, Br, I)
Галогены окислительно расщепляют [CpFe (CO)2]2 для получения группы Fe (II) FpX (X = Cl, Br, I):
- [CpFe (CO)2]2 + X2 → 2 CpFe (CO)2Икс
Одним из примеров является циклопентадиенилдикарбонилийодид железа.
Fp (η2-алкен)+, Fp (η2-алкин)+ и другие "Fp+"
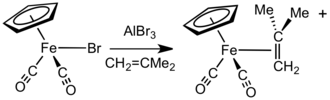
В присутствии акцепторов галогенид-анионов, таких как AlBr3 или AgBF4, Соединения FpX (X = галогенид) реагируют с алкены, алкины, или нейтральные лабильные лиганды (такие как эфиры и нитрилы) позволить себе Fp+ комплексы.[15] В другом подходе соли [Fp (изобутен)]+ легко получаются реакцией NaFp с металлилхлорид с последующим протонолизом. Этот комплекс является удобным и общим предшественником других катионных комплексов Fp – алкен и Fp – алкин.[16] Процесс обмена облегчается за счет потери газообразных и объемных изобутен.[17] Как правило, менее замещенные алкены связываются сильнее и могут замещать более затрудненные алкеновые лиганды. Алкеновые и алкиновые комплексы также могут быть получены нагреванием катионного эфира или водного комплекса, например [Fp (thf)]+
BF−
4, с алкеном или алкином.[18] [FpL]+
BF−
4 комплексы также могут быть получены обработкой FpMe HBF4·Et2О в CH2Cl2 при -78 ° C с последующим добавлением L.[19]
АлкенКомплексы –Fp также могут быть получены из аниона Fp косвенно. Таким образом, отрыв гидрида от Fp – алкильных соединений с использованием трифенилметилгексафторфосфат дает [Fp (α-алкен)]+ комплексы.
- FpNa + RCH2CH2I → FpCH2CH2R + NaI
- FpCH2CH2R + Ph3CPF6 → [Fp (CH
2= CHR)+
]ПФ−
6 + Ph3CH
Реакция NaFp с эпоксид с последующей дегидратацией под действием кислоты также образуются алкеновые комплексы. Fp (алкен)+ устойчивы относительно бромирование, гидрирование, и ацетоксимеркурация, но алкен легко выделяется с йодид натрия в ацетон или согреванием ацетонитрил.[20]
Алкеновый лиганд в этих катионах активируется к атаке посредством нуклеофилы, открывая путь к ряду углерод-углеродная связь-образующие реакции. Нуклеофильные добавки обычно встречаются у более замещенного углерода. Этот региохимия относится к большему положительному плотность заряда на этой позиции. В региональный контроль часто бывает скромным. Добавление нуклеофила полностью стереоселективный, происходящие анти в группу Fp. Аналог Fp (алкин)+ Также сообщается, что комплексы претерпевают реакции нуклеофильного присоединения с помощью различных нуклеофилов углерода, азота и кислорода.[21]
Fp (алкен)+ и Fp (алкин)+ π-комплексы также довольно кислые в аллильном и пропаргильном положениях, соответственно, и могут быть количественно депротонированы аминовыми основаниями, такими как Et3N с образованием нейтральных σ-комплексов Fp – аллил и Fp – алленил:[16]
- Fp (H
2C = CHCH
2CH
3)+
BF−
4 + Et3N → FpCH2CH = CHCH3 + Et
3NH+
BF−
4 - FpCH2CH = CHCH3 + E+
BF−
4 → Fp (H
2C = CHCH (E) CH
3)+
BF−
4
Fp – аллил и Fp – алленил реагируют с катионными электрофилами. E (Такие как Мне3О+, карбокатионы, ионы оксокарбения) для получения продуктов функционализации аллила и пропаргила соответственно.[16] Родственный комплекс [Cp * Fe (CO)2(thf)]+[BF4]− было показано, что он катализирует функционализацию пропаргильных и аллильных C-H за счет использования процессов депротонирования и электрофильной функционализации, описанных выше.[22]
Реагенты циклопропанирования на основе фп
Реагенты на основе ФП разработаны для циклопропанации.[23] Ключевой реагент готовится из FpNa с тиоэфир и метилиодид, и имеет хороший срок хранения, в отличие от обычных Промежуточные звенья Симмонса-Смита и диазоалканы.
- FpNa + ClCH2SCH3 → FpCH2SCH3 + NaCl
- FpCH2SCH3 + CH3I + NaBF4 → FpCH2S (CH3)2] BF4 + NaI
Использование [FpCH2S (CH3)2] BF4 не требует специальных условий.
- Fp (CH
2S+
(CH
3)
2) BF−
4 + (Ph)2C = CH2 → 1,1-дифенилциклопропан +…
Хлорид железа (III) добавляется для уничтожения любых побочных продуктов.
Предшественники Fp = CH+
2, как FpCH2OMe, который превращается в железо карбен при протонировании также использовались в качестве реагентов циклопропанирования.[24]
Фотохимическая реакция
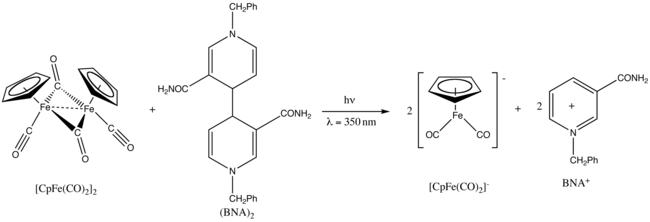
Fp2 экспонаты фотохимия.[25] На УФ облучение на длине волны 350 нм, уменьшается на Димер 1-бензил-1,4-дигидроникотинамида, (BNA)2.[26]
Рекомендации
- ^ Келли, Уильям Дж. (2001). «Бис (дикарбонилциклопентадиенилирон)». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rb139. ISBN 0471936235.
- ^ а б Харрис, Дэниел С .; Розенберг, Эдвард; Робертс, Джон Д. (1974). «Спектры ядерного магнитного резонанса углерода-13 и механизм мостик-терминального карбонильного обмена в ди-µ-карбонил-бис [карбонил (η-циклопентадиенил) железо] (Fe – Fe) [{(η-C5ЧАС5) Fe (CO)2}2]; CD-ди-µ-карбонил-ж-карбонил-ае-ди (η-циклопентадиенил) -б- (триэтилфосфит) ди-железо (Fe – Fe) [(η-C5ЧАС5)2Fe2(CO)3Поэт)3] и некоторые родственные комплексы ». Журнал химического общества: транзакции Далтона (22): 2398–2403. Дои:10.1039 / DT9740002398. ISSN 0300-9246.
- ^ а б Girolami, G .; Rauchfuss, T .; Анджеличи, Р. (1999). Синтез и техника в неорганической химии (3-е изд.). Саусалито, Калифорния: Университетские научные книги. С. 171–180. ISBN 978-0-935702-48-4.
- ^ а б Уилкинсон, Г., изд. (1982). Комплексная металлоорганическая химия. 4. Нью-Йорк: Pergamon Press. С. 513–613. ISBN 978-0-08-025269-8.
- ^ Грин, Дженнифер С .; Green, Malcolm L.H .; Паркин, Жерар (2012). «Возникновение и представление трехцентровых двухэлектронных связей в ковалентных неорганических соединениях». Химические коммуникации. 2012 (94): 11481–11503. Дои:10.1039 / c2cc35304k. PMID 23047247.
- ^ а б Лабинджер, Джей А. (2015). «Имеет ли димер циклопентадиенилдикарбонила железа связь металл-металл? Кто спрашивает?». Неорганика Chimica Acta. Связанные соединения металл – металл и металлические кластеры. 424: 14–19. Дои:10.1016 / j.ica.2014.04.022. ISSN 0020-1693.
- ^ Коттон, Ф. Альберт; Ягупский, Г. (1967). «Таутомерные изменения в карбонилах металлов. I. Дикарбонильный димер π-циклопентадиенил-железа и дикарбонильный димер π-циклопентадиенил-рутена». Неорганическая химия. 6 (1): 15–20. Дои:10.1021 / ic50047a005. ISSN 0020-1669.
- ^ Piper, T. S .; Cotton, F. A .; Уилкинсон, Г. (1955). «Циклопентадиенил – окись углерода и родственные соединения некоторых переходных металлов». Журнал неорганической и ядерной химии. 1 (3): 165–174. Дои:10.1016 / 0022-1902 (55) 80053-X.
- ^ Chang, T. C. T .; Розенблюм, М .; Симмс, Н. (1988). «Винилирование енолатов эквивалентом винилового катиона: транс-3-метил-2-винилциклогексанон ". Органический синтез. 66: 95.; Коллективный объем, 8, п. 479
- ^ Кинг, Б. (1970). «Применение карбонильных анионов металлов в синтезе необычных металлоорганических соединений». Отчеты о химических исследованиях. 3 (12): 417–427. Дои:10.1021 / ar50036a004.
- ^ Десси, Раймонд Э .; Pohl, Rudolph L .; Кинг, Р. Брюс (1966-11-01). «Металлоорганическая электрохимия. VII.1. Нуклеофильность металлических и металлоидных анионов, полученных из металлов групп IV, V, VI, VII и VIII». Журнал Американского химического общества. 88 (22): 5121–5124. Дои:10.1021 / ja00974a015. ISSN 0002-7863.
- ^ Ellis, J. E .; Флом, Э.А. (1975). «Химия карбонильных анионов металлов: III. Натрий-калиевый сплав: эффективный реагент для производства карбонильных анионов металлов». Журнал металлоорганической химии. 99 (2): 263–268. Дои:10.1016 / S0022-328X (00) 88455-7.
- ^ Десси, Р. Э .; King, R. B .; Уолдроп, М. (1966). «Металлоорганическая электрохимия. V. Переходный ряд». Журнал Американского химического общества. 88 (22): 5112–5117. Дои:10.1021 / ja00974a013.
- ^ Десси, Р. Э .; Weissman, P.M .; Поль, Р. Л. (1966). «Металлоорганическая электрохимия. VI. Электрохимический разрыв связей металл – металл». Журнал Американского химического общества. 88 (22): 5117–5121. Дои:10.1021 / ja00974a014.
- ^ Сильвер, Дж. (1993). Химия железа. Дордрехт: Springer, Нидерланды. ISBN 9789401121408. OCLC 840309324.
- ^ а б c Катлер, А .; Ehnholt, D .; Lennon, P .; Николай, К .; Marten, Дэвид Ф .; Мадхаварао, М .; Raghu, S .; Rosan, A .; Розенблюм, М. (1975). «Химия дикарбонильных & beta; 5-циклопентадиенильных комплексов железа. Общие синтезы монозамещенных η2-олефиновых комплексов и 1-замещенных η1-аллильные комплексы. Конформационные эффекты на протекание депротонирования (η2-олефин) катионы ». Журнал Американского химического общества. 97 (11): 3149–3157. Дои:10.1021 / ja00844a038. ISSN 0002-7863.
- ^ Тернбулл, Марк М. (2001). «Дикарбонил (циклопентадиенил) (изобутен) тетрафторборат железа». Энциклопедия реагентов для органического синтеза. eEROS. Дои:10.1002 / 047084289X.rd080. ISBN 0471936235.
- ^ Schriver, D. F .; Брюс, M. I .; Уилкинсон, Г. (1995). Железо, рутений и осмий. Кидлингтон: Elsevier Science. ISBN 978-0-08-096396-9. OCLC 953660855.
- ^ Редлих, Марк Д .; Майер, Майкл Ф .; Хоссейн, М. Махмун (2003). "Железная кислота Льюиса [(η5-C5ЧАС5) Fe (CO)2(THF)]+ Катализированные органические реакции ». Aldrichimica Acta. 36: 3–13.
- ^ Пирсон, А. Дж. (1994). Соединения железа в органическом синтезе. Сан-Диего, Калифорния: Academic Press. С. 22–35. ISBN 978-0-12-548270-7.
- ^ Акита, Мунетака; Какута, Сатоши; Сугимото, Сюичиро; Терада, Масако; Танака, Масако; Моро-ока, Ёсихико (2001). «Нуклеофильное дополнение к η2-Алкин-лиганд в [CpFe (CO)2(η2-R − C ⋮ C − R)]+. Зависимость стереохимии алкенильного продукта от основности нуклеофила ». Металлоорганические соединения. 20 (13): 2736–2750. Дои:10.1021 / om010095t. ISSN 0276-7333.
- ^ Ван, Идун; Чжу, Цзинь; Дарем, Остин С.; Линдберг, Хейли; Ван, И-Мин (2019). «α-C – H функционализация π-связей с использованием комплексов железа: каталитическое гидроксиалкилирование алкинов и алкенов». Журнал Американского химического общества. 141 (50): 19594–19599. Дои:10.1021 / jacs.9b11716. ISSN 0002-7863. PMID 31791121.
- ^ Mattson, M. N .; О'Коннор, Э. Дж .; Хелквист, П. (1992). «Циклопропанирование с использованием железосодержащего реагента переноса метилена: 1,1-дифенилциклопропана». Органический синтез. 70: 177.; Коллективный объем, 9, п. 372
- ^ Джонсон, М. Д. (1982), «Одноядерные соединения железа с η1-Углеводородные лиганды », Комплексная металлоорганическая химия, Elsevier, стр. 331–376, Дои:10.1016 / b978-008046518-0.00049-0, ISBN 978-0-08-046518-0, получено 2019-12-11
- ^ Райтон, М. (1974). «Фотохимия карбонилов металлов». Химические обзоры. 74 (4): 401–430. Дои:10.1021 / cr60290a001.
- ^ Fukuzumi, S .; Окубо, К .; Fujitsuka, M .; Я тоже.; Teichmann, M.C .; Maisonhaute, E .; Аматоре, К. (2001). "Фотохимическое образование дикарбонил-аниона циклопентадиенил-железа аналогом димера димера никотинамида аденина динуклеотида". Неорганическая химия. 40 (6): 1213–1219. Дои:10.1021 / ic0009627. PMID 11300821.


![Добавление карбаниона к [Fp (алкен)] +.](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/FpMalonateRxn.png/330px-FpMalonateRxn.png)