WikiDer > Динатрия тетракарбонилферрат
 | |
| Имена | |
|---|---|
| Название ИЮПАК динатрия тетракарбонилферрат | |
| Систематическое название ИЮПАК динатрия тетракарбонилферрат | |
| Другие имена динатрий, тетракарбонил железа, реагент Коллмана | |
| Идентификаторы | |
3D модель (JSmol) | |
| ECHA InfoCard | 100.035.395 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C4FeNa2О4 | |
| Молярная масса | 213.87 |
| Внешность | Бесцветное твердое вещество |
| Плотность | 2,16 г / см3, твердый |
| Разлагается | |
| Растворимость | тетрагидрофуран, диметилформамид, диоксан |
| Структура | |
| Искаженный тетраэдр | |
| Тетраэдр | |
| Опасности | |
| Главный опасности | Пирофорный |
| Родственные соединения | |
Родственные соединения | Пентакарбонил железа |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
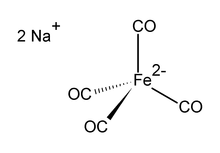
Динатрия тетракарбонилферрат это железоорганическое соединение с формулой Na2[Fe (CO)4]. Он всегда используется в качестве сольвата, например, с тетрагидрофуран или же диметоксиэтан,. которые связываются с катионом натрия.[1] An кислород-чувствительное бесцветное твердое вещество, является реагентом в металлоорганических и органических химических исследованиях. Сольватированная диоксаном натриевая соль известна как Реагент Коллмана, в знак признания Джеймс П. Коллман один из первых популяризаторов его использования.[2]
Структура
Дианион [Fe (CO)4]2− изоэлектронен с Ni (CO)4.[3][4] Железный центр четырехгранный, с Na+--- OCFe взаимодействия. Обычно используется с диоксан в комплексе с катионом натрия.
Синтез
В реагент изначально был создан на месте за счет уменьшения пентакарбонил железа с амальгамой натрия.[5] Использование современного синтеза нафтенид натрия или кетилы бензофенона натрия в качестве восстановителей:[1][6]
- Fe (CO)5 + 2 Na → Na2[Fe (CO)4] + CO
Когда используется дефицит натрия, восстановление дает темно-желтый октакарбонил. диферрат:[1]
- 2 Fe (CO)5 + 2 Na → Na2[Fe2(CO)8] + 2 CO
Некоторые специализированные методы не начинаются с карбонила железа.[7]
Реакции
Он используется для синтеза альдегиды из алкилгалогенидов.[8]Реагент был первоначально описан для превращения первичных алкилбромидов в соответствующие альдегиды в двухстадийной реакции «в одном реакторе»:[5]
- Na2[Fe (CO)4] + RBr → Na [RFe (CO)4] + NaBr
Затем это решение последовательно обрабатывается PPh3 а потом уксусная кислота дать альдегид RCHO.
Тетракарбонилферрат динатрия можно использовать для преобразования хлорангидриды до альдегидов. Эта реакция протекает через железо. ацил сложный.
- Na2[Fe (CO)4] + RCOCl → Na [RC (O) Fe (CO)4] + NaCl
- Na [RC (O) Fe (CO)4] + HCl → RCHO + "Fe (CO)4"+ NaCl
Тетракарбонилферрат динатрия реагирует с алкилгалогениды (RX) для получения алкильных комплексов:
- Na2[Fe (CO)4] + RX → Na [RFe (CO)4] + NaX
Такие алкилы железа можно превратить в соответствующие карбоновая кислота и галогенангидриды:
- Na [RFe (CO)4] + О2, H+ → Нажмите RCO2H + Fe ...
- Na [RFe (CO)4] + 2 X2 → RC (O) X + FeX2 + 3 СО + NaX
Рекомендации
- ^ а б c Strong, H .; Krusic, P.J .; Сан-Филиппо, Дж. (1990). «Карбонилферраты натрия, Na2[Fe (CO)4], Na2[Fe2(CO)8] и Na2[Fe3(CO)11]. Бис [μ-нитридо-бис (трифенилфосфор)1+] Ундека-карбонилтриферрат2−, [(Ph3П)2N]2[Fe3(CO)11]". Неорганические синтезы. 28: 203–207. Дои:10.1002 / 9780470132593.ch52. ISBN 0-471-52619-3.
- ^ Miessler, G.L .; Тарр, Д. А. (2004). Неорганическая химия. Река Аппер Сэдл, Нью-Джерси: Пирсон.
- ^ Chin, H. B .; Бау, Р. (1976). «Кристаллическая структура тетракарбонилферрата динатрия. Искажение тетракарбонилферрата.2− Анион в твердом состоянии ». Журнал Американского химического общества. 98 (9): 2434–2439. Дои:10.1021 / ja00425a009.
- ^ Teller, R.G .; Finke, R.G .; Collman, J. P .; Chin, H. B .; Бау, Р. (1977). «Зависимость геометрии тетракарбонилферрата (2-) от противоиона: кристаллические структуры тетракарбонилферрата дикалия и бис (крипта натрия) тетракарбонилферрата [крипта = N (CH2CH2ОСН2CH2ОСН2CH2)3N] ". Журнал Американского химического общества. 99: 1104–1111. Дои:10.1021 / ja00446a022.CS1 maint: использует параметр авторов (связь)
- ^ а б Кук, М. П. (1970). «Легкое превращение алкилбромидов в альдегиды с использованием тетракарбонилферрата натрия (-II)». Журнал Американского химического общества. 92 (20): 6080–6082. Дои:10.1021 / ja00723a056.
- ^ Ричард Г. Финке, Томас Н. Соррелл (1979). «Нуклеофильное ацилирование динатриевой тетракарбонилферратом: метил-7-оксогептаноат и метил-7-оксооктаноат». Органический синтез. 59: 102. Дои:10.15227 / orgsyn.059.0102.
- ^ Шолссер, М. (2013). Металлоорганические соединения в синтезе, Третье руководство. Честер, Англия: Wiley.
- ^ Пайк, Р. Д. (2001). «Тетракарбонилферрат динатрия (-II)». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rd465.
дальнейшее чтение
- Коллман, Дж. П. (1975). «Тетракарбонилферрат динатрия, переходный металл, аналог реактива Гриньяра». Отчеты о химических исследованиях. 8 (10): 342–347. Дои:10.1021 / ar50094a004.
- Ungurenasu, C .; Cotzur, C. (1982). «Тетракарбонилферрат динатрия: реагент для кислотной функционализации галогенированных полимеров». Полимерный бюллетень. 6 (5–6): 299–303. Дои:10.1007 / BF00255401.
- Hieber, V. W .; Браун, Г. (1959). "Notizen:" Rheniumcarbonylwasserstoff "и Methylpentacarbonylrhenium". Zeitschrift für Naturforschung B. 14 (2): 132–133. Дои:10.1515 / znb-1959-0214.