WikiDer > Окисление, катализируемое оксоаммонием
Эта статья слишком полагается на Рекомендации к основные источники. (Апрель 2019) (Узнайте, как и когда удалить этот шаблон сообщения) |
Реакции окисления, катализируемые оксоаммонием вовлекать преобразование из органические субстраты к более высокому окисленный материалы через действие Виды N-оксоаммония. Нитроксиды также можно использовать в каталитических количествах в присутствии стехиометрического количества концевого окислителя.[1] Используемые нитроксильные радикалы представляют собой либо 2,2,6,6-тетраметилпиперидин-1-оксил (ТЕМПО), либо его производные.
(1)

Механизм и стереохимия
Одноэлектронное окисление нитроксила дает высокоэлектрофильный оксоаммоний, который служит активным окислителем.[2] Нитроксид можно использовать в качестве катализатора в сочетании с более дешевыми стехиометрическими окислителями, такими как гипохлорит натрия[3] или бис (ацетокси) иодбензол (BAIB).[4]
В нейтральных или слабокислых условиях (например, в присутствии силикагеля) окисление происходит за счет начальной водородной связи между гидроксильной группой и оксоаммонийным азотом с последующим согласованным переносом протона и отрывом гидрида.[5] Необходимость водородной связи подтверждается низкой реакционной способностью β-алкокси и β-аминоспиртов, которые обладают конкурентоспособной внутримолекулярный водородная связь. Механизм окисления в слабоосновных (пиридиновых) условиях аналогичен, за исключением того, что пиридин нейтрализует разновидности гидроксиаммония, и этот промежуточный продукт «компропорционирует» с оксоаммониевой солью с образованием нитроксильных радикалов и солей пиридиния (см. Уравнение (3) ниже). Поскольку в этой реакции расходуются основание и активный окислитель, необходимы два эквивалента основания и окислителя в слабоосновных условиях. В недавней статье представлен единый механизм при нейтральных и базовых условиях.[6] Авторы представляют комплексный анализ ряда окислений, опосредованных оксоаммониевой солью.
(2)

В сильно основных условиях депротонированный субстрат реагирует с частицами N-оксиаммония. Может произойти атака алкоксида субстрата на азот или кислород, хотя считается, что первый действует на основании наблюдений за окислением N-алкоксиаминов (которые, предположительно, протекают через промежуточные соединения). 1).[7] Компропорционирование восстановленного продукта (гидроксиламина) с ионом оксоаммония конкурирует с окислением; таким образом, часто требуется избыток окислителя.
(3)

Окисление, катализируемое нитроксидом, включает промежуточные соединения N-оксоаммония в качестве активного окислителя. Механизм окисления нитроксильного радикала зависит от используемого концевого окислителя. Двухэлектронные окислители, такие как NaOCl, могут напрямую превращать нитроксиды в оксоаммоний.
(4)

Одноэлектронные окислители, такие как медь (II), действуют по более сложному механизму с участием дикислорода в качестве конечного окислителя.[8] Медь (II) окисляет четыре эквивалента нитроксида до оксоаммония, два эквивалента которого (синий) реагируют со спиртами с образованием карбонильных соединений. Два других эквивалента оксоаммония (красный) подвергаются компропорционированию с преобразованием нитроксильных радикалов (розовый). Наконец, дикислород повторно окисляет четыре эквивалента меди (I) до меди (II). В целом, одна молекула дикислорода опосредует окисление двух эквивалентов спирта с образованием двух эквивалентов воды.
(5)

Стереоселективные варианты
Энантиоселективное окисление обычно представляет собой либо кинетическое разделение хиральных спиртов, либо реакции десимметризации. Эти окисления могут быть облегчены за счет использования хиральных нитроксильных радикалов в каталитическом режиме. Хороший пример - кинетическое разрешение рацемического 1-фенилэтанола.[9] С другой стороны, процессы окислительной десимметризации с использованием оксоаммониевых окислителей относительно редки.[10]
(6)

Объем
Окисление с использованием солей оксоаммония можно проводить либо в стехиометрическом, либо в каталитическом режиме в кислых или основных условиях. В этом разделе описаны наиболее часто используемые условия стехиометрического и каталитического окисления спиртов до карбонильных соединений солями оксоаммония. Хотя с помощью ТЕМПО можно окислить широкий спектр спиртов, иногда имеет место конкурентное окисление более богатых электронами функциональных групп. Кроме того, селективность окисления полиолов может различаться в зависимости от используемых условий.
Стехиометрические окисления
В умеренно кислых или нейтральных условиях соли оксоаммония, такие как Соль Боббита окисляют аллильный, бензиловый,[11] пропаргиловый,[12] или алифатические спирты к соответствующим альдегидам или кетонам. Вторичные спирты реагируют быстрее, чем первичные, хотя селективность невысока. Удобный экспериментальный протокол позволяет повторно использовать соль оксоаммония.[12]
(7)

Амины, простые бензиловые эфиры и алкены окисляются быстрее, чем неактивированные спирты; таким образом, селективное стехиометрическое окисление неактивированных спиртов в присутствии этих функциональных групп невозможно.[13] Спирты с заместителями β-азота или β-кислорода медленно реагируют в кислых условиях.[12] Аллиловые и бензильные спирты могут избирательно окисляться в этих условиях.[13]
(8)

В основных условиях необходимы два эквивалента окислителя из-за конкурентного соотношения между восстановленным нитроксидом и непрореагировавшим оксоаммонием (см. Уравнение (3) выше). Пиридин обычно используется в качестве основания. Это наиболее распространенные условия окисления нитроксида в стехиометрическом режиме.
(9)

Каталитическое окисление
Каталитическое окисление оксоаммония можно облегчить, используя гипохлорит натрия в качестве конечного окислителя. Для протекания реакции необходимо поддерживать pH ниже 10 с использованием буфера. Активным окислителем нитроксида является анион гипобромита; следовательно, бромид калия используется в качестве добавки.[3] Эпимеризация α-стереогенных центров в карбонилсодержащих продуктах не происходит.
(10)

Использование хлоритов в качестве конечных окислителей в сочетании с гипохлоритами и ТЕМПО дает карбоновые кислоты без побочных продуктов хлорирования.[14] Реакцию обычно проводят в две стадии в одной и той же емкости: частичное окисление осуществляется с помощью ТЕМПО и гипохлорита, затем добавляют хлорит для завершения окисления. Наблюдается окисление только первичного спирта. В сочетании с дигидроксилированием по Шарплесу этот метод можно использовать для получения энантиочистых α-гидроксикислот.[15]
(11)

Существенным ограничением обоих вышеперечисленных методов является несовместимость со свободными аминовыми или алкеновыми функциональными группами, которые подвергаются конкурентному окислению. Использование бис (ацетокси) иодбензола (BAIB) в качестве конечного окислителя позволяет избежать этой проблемы. BAIB не может напрямую окислять нитроксильный радикал, и считается, что первоначальное образование оксоаммония происходит из-за катализируемого кислотой диспропорционирования. BAIB может затем окислить полученный гидроксиламин до оксоаммониевой соли. Хотя реакция проводится в кислых условиях (уксусная кислота является побочным продуктом и часто добавляется для облегчения диспропорционирования), селективность окисления первичного спирта является значительной.[4] В этих условиях допустимы функциональные группы, чувствительные к основанию, такие как эпоксиды.[16]
(12)
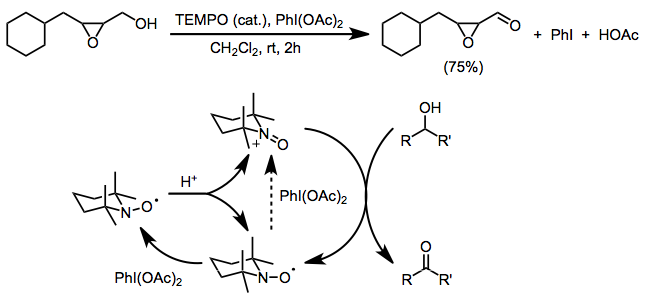
Другие двухэлектронные концевые окислители, используемые с TEMPO, включают mCPBA (вторичное окисление благоприятно, хотя могут происходить побочные реакции),[17] N-хлорсукцинимид,[18] и Oxone.[19]
Медь (II), как свободная хлоридная соль, так и в виде комплекса с бидентатными лигандами, окисляет ТЕМПО до его оксоаммониевой соли. В этих реакциях конечным окислителем выступает воздух.[20] Неясно, окисляет ли воздух медь (I) до меди (II), или окисление спирта частично опосредуется медью, а воздух окисляет образующийся гидроксиламин обратно до оксоаммониевой соли. Первое происходит во время Wacker процесс, но последнее объясняет, почему комплексы меди и некоторые другие комплексы металлов способны окислять спирты вместе с ТЕМПО.
(13)

Активирован диоксид марганца, который окисляет аллиловые и бензильные спирты, дешевле, чем ТЕМПО, и прост в эксплуатации.[21] Реагенты на основе хрома, такие как хлорхромат пиридиния также можно использовать для превращения спиртов в карбонильные соединения; хотя стехиометрическое образование хромовых отходов является недостатком.[22] Окисления с использованием диметилсульфоксид, такой как Swern и Моффатт реакции, не содержат тяжелых металлов и окисляют самые разные субстраты.[23] Окисление оксоаммония предпочтительнее, чем методы ДМСО для реакций диолов и ацетиленовых спиртов. Десс-Мартин периодинан является очень селективным мягким окислителем спиртов, основными недостатками которого являются трудности с приготовлением и безопасность.[24]
Рекомендации
- ^ Боббит, Дж. М.; Bruckner, C .; Мербух, Н. Орг. Реагировать. 2009, 74, 103. Дои:10.1002 / 0471264180.or074.02
- ^ Merbouh, N .; Bobbitt, J.M .; Брюкнер, К. J. Org. Chem. 2004, 69, 5116.
- ^ а б Шелдон, Р.А.; Arends, I. W. C. E .; тен Бринк, Г. Дж .; Дийксман, А. Соотв. Chem. Res. 2002, 35, 774. Дои:10.1021 / ar010075n
- ^ а б Де Мико, А .; Маргарита, Р .; Parlanti, L .; Вескови, А .; Пьянкателли, Г. J. Org. Chem. 1997, 62, 6974.
- ^ Bailey, W. F .; Bobbitt, J.M .; Виберг, К. J. Org. Chem. 2007, 72, 4504.
- ^ Hamlin, T. A .; Kelly, C.B .; Ovian, J.M .; Wiles, R.J .; Тилли, Л. Дж .; Ледбитер, Н. J. Org. Chem. 2015, 80, 8150.
- ^ Semmelhack, M. F .; Schmid, C.R .; Кортес, Д.А. Tetrahedron Lett. 1986, 27, 1119.
- ^ Semmelhack, M. F .; Schmid, C.R .; Кортес, Д. А .; Чжоу, С.С. Варенье. Chem. Soc. 1984, 106, 3374.
- ^ Рычновский, С.Д .; McLernon, T. L .; Раджапаксе, Х. J. Org. Chem. 1996, 61, 1194.
- ^ Tanaka, H .; Kawakami, Y .; Goto, K .; Куробоши, М. Tetrahedron Lett. 2001, 42, 445.
- ^ Миядзава, Т .; Endo, T .; Shiihashi, S .; Окавара, М. J. Org. Chem. 1985, 50, 1332.
- ^ а б c Боббит, Дж. М. J. Org. Chem. 1998, 63, 9367.
- ^ а б Bobbitt, J.M .; Мербух, Н. Орг. Synth. 2005, 82, 80.>
- ^ Песня, Z. J .; Чжао, М .; Desmond, R .; Devine, P .; Tschaen, D. M .; Tillyer, R .; Frey, L .; Heid, R .; Сюй, Ф .; Фостер, Б .; Li, J .; Reamer, R .; Volante, R .; Grabowski, E. J. J .; Dolling, U.H .; Reider, P.J .; Окада, S .; Kato, Y .; Мано, Э. J. Org. Chem. 1999, 64, 9658.
- ^ Шарплесс, К. Б .; Amberg, W .; Bennani, Y.L .; Криспино, Г. А .; Hartung, J .; Jeong, K. S .; Kwong, H.L .; Morikawa, K .; Wang, Z. M .; Xu, D .; Чжан, Х.Л. J. Org. Chem. 1992, 57, 2768.
- ^ Де Мико, А .; Маргарита, Р .; Parlanti, L .; Вескови, А .; Пьянкателли, Г. J. Org. Chem. 1997, 62, 6974.
- ^ Ганем, Б. J. Org. Chem. 1975, 40, 1998.
- ^ Einhorn, J .; Einhorn, C .; Ratajczak, F .; Пьер, Ж.-Л. J. Org. Chem. 1996, 61, 7452.
- ^ Bolm, C .; Magnus, A. S .; Хильдебранд, Дж. П. Орг. Lett. 2000, 2, 1173.
- ^ Шелдон, Р.А.; Арендс, И. В. К. Э. Adv. Synth. Катал. 2004, 346, 1051.
- ^ Тейлор, Р. Дж. К .; Reid, M .; Foot, J .; Сырье, С.А. Соотв. Chem. Res. 2005, 38, 851.
- ^ Луццио, Ф.А. Орг. Реагировать. 1998, 53, 1.
- ^ Тидуэлл, Т. Орг. Реагировать. 1990, 39, 297.
- ^ Dess, D. B .; Мартин, Дж. К. Варенье. Chem. Soc. 1991, 113, 7277.