WikiDer > Монотиофосфат натрия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Монотиофосфат натрия | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ECHA InfoCard | 100.030.224 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
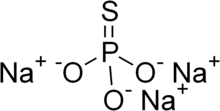
| Na3PO3S | |
| Молярная масса | 180,030 г / моль |
| Внешность | Белое твердое вещество |
| Плотность | 1,58 г / см3 (додекагидрат), 2,40 г / см3 для безводных |
| Температура плавления | От 120 до 125 ° C (от 248 до 257 ° F, от 393 до 398 K) (разложение) |
| растворимый | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Монотиофосфат натрия, или же фосфоротиоат натрия, является неорганическое соединение с молекулярной формулой Na3PO3S (H2O)Икс. Все белые твердые частицы. Безводный материал (x = 0) разлагается без плавления при 120-125 ° C. Чаще встречается додекагидрат. Также известен нонагидрат.
Родственные соли - это дитиофосфат Na3PS2О2.11H2О, тритиофосфат Na3PS3О.11H2O и тетратиофосфат Na3PS4.8H2О.[1]
Подготовка
Монотиофосфат натрия получают основным гидролизом тиофосфорилхлорид используя водный едкий натр:[2][3]
- PSCl3 + 6 NaOH + 9 H2O → Na3PO3S.(ЧАС2O)12 + 3 NaCl
Эта реакция дает додекагидрат, который легко обезвоживается.
Частичное обезвоживание более 6,5 M H2ТАК4 дает нонагидрат. В потоке N2 образуется безводная соль.[4]
Фосфоротиолат натрия разлагается при нейтральной pH. Силиконовая смазка катализирует гидролиз иона фосфоротиоата, поэтому его не рекомендуется использовать в стыках стекла.[5]
В безводном материале связь P-S составляет 211 пм, а три эквивалентных связи P-O короткие при 151 пм. Эти несопоставимые значения предполагают, что связь P-S одинарная.[6]
Рекомендации
- ^ Элиас, Д. П. (1957). «Кристаллографические данные некоторых фосфоротиоатов натрия». Acta Crystallographica. 10 (9): 600. Дои:10.1107 / S0365110X57002108.
- ^ Стэнли К. Ясуда, Джек Л. Ламберт (1957). «Монотиофосфат натрия». Неорганические синтезы. Неорганические синтезы. 5. С. 102–104. Дои:10.1002 / 9780470132364.ch28. ISBN 9780470132364.CS1 maint: использует параметр авторов (связь)
- ^ Л. К. Уошберн, Р. Л. Хейс (1977). «Важность избытка основания в синтезе монотиофосфата натрия: (фосфоротиоат натрия)». Неорганические синтезы. Неорганические синтезы. 17. С. 193–4. Дои:10.1002 / 9780470132487.ch53. ISBN 9780470132487.CS1 maint: использует параметр авторов (связь)
- ^ Палацци, Марсель (1973). «Тринатриймонотиофосфат. Радиокристаллографические исследования». Bulletin de la Société Chimique de France. 12: 3246–8.
- ^ Лучиан С. Поп и М. Сайто (2015). «Случайные реакции с участием силиконовой смазки». Обзоры координационной химии. 314: 64–70. Дои:10.1016 / j.ccr.2015.07.005.
- ^ Помпецки, М .; Янсен, М. (2002). "Natriummonothiophosphat (V): Kristallstruktur und Natriumionenleitfähigkeit" [Монотиофосфат натрия (V). Кристаллическая структура и натриевая ионная проводимость. Zeitschrift fuer Anorganische und Allgemeine Chemie. 628 (3): 641–646. Дои:10.1002 / 1521-3749 (200203) 628: 3 <641 :: AID-ZAAC641> 3.0.CO; 2-8.CS1 maint: использует параметр авторов (связь)
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |