WikiDer > Сверхкритическая флюидная экстракция
Сверхкритическая флюидная экстракция (SFE) - это процесс отделения одного компонента (экстрагента) от другого (матрицы) с использованием сверхкритические жидкости как извлекающий растворитель. Извлечение обычно из твердый матрица, но также может быть из жидкости. SFE можно использовать как Базовые приготовления шаг для аналитический в целях удаления нежелательного материала с продукта (например, декафеинация) или соберите желаемый продукт (например, эфирные масла). Эти эфирные масла могут включать лимонен и другие прямые растворители. Углекислый газ (CO2) является наиболее часто используемой сверхкритической жидкостью, иногда модифицируемой сорастворителями, такими как этиловый спирт или же метанол. Условия добычи для сверхкритический диоксид углерода выше критическая температура 31 ° C и критическое давление из 74 бар. Добавление модификаторов может немного изменить это. Обсуждение ниже будет в основном относиться к экстракции с CO.2, если не указано иное.
Преимущества
Селективность
Свойства сверхкритического флюида можно изменять, изменяя давление и температуру, что позволяет осуществлять избирательную экстракцию. Например, эфирные масла могут быть извлеченный из установки с низким давлением (100 бар), тогда как жидкостная экстракция также удаляет липиды. Липиды можно удалить с помощью чистого CO.2 при более высоких давлениях, а затем фосфолипиды можно удалить, добавив к растворителю этанол.[1] Тот же принцип можно использовать для извлечения полифенолов и ненасыщенных жирных кислот отдельно из винных отходов.[2]
Скорость
Добыча - это распространение- процесс, в котором растворитель должен диффундировать в матрицу, а экстрагированный материал диффундировать из матрицы в растворитель. Диффузия в сверхкритических флюидах намного выше, чем в жидкостях, поэтому экстракция может происходить быстрее. Кроме того, из-за отсутствия поверхностное натяжение и незначительный вязкости по сравнению с жидкостями растворитель может больше проникать в матрицу, недоступную для жидкостей. Экстракция с использованием органической жидкости может занять несколько часов, тогда как экстракция сверхкритической жидкостью может быть завершена за 10–60 минут.[3]
Ограничения
Требование высокого давления увеличивает стоимость по сравнению с традиционной жидкостной экстракцией, поэтому SFE будет использоваться только там, где есть значительные преимущества. Сам по себе диоксид углерода неполярен и имеет несколько ограниченную растворяющую способность, поэтому его нельзя всегда использовать в качестве растворителя, особенно для полярных растворенных веществ. Использование модификаторов увеличивает диапазон материалов, которые можно добыть. Часто можно использовать модификаторы пищевого качества, такие как этанол, которые также могут помочь в сборе экстрагированного материала, но уменьшают некоторые преимущества использования растворителя, который является газообразным при комнатной температуре.
Процедура
В системе должен быть насос для СО2, ячейка давления для хранения пробы, средства поддержания давления в системе и сборный сосуд. Жидкость перекачивается в зону нагрева, где нагревается до сверхкритических условий. Затем он попадает в экстракционный сосуд, где быстро диффундирует в твердую матрицу и растворяет экстрагируемый материал. Растворенный материал уносится из экстракционной ячейки в сепаратор при более низком давлении, и экстрагированный материал осаждается. Сотрудничество2 затем можно охлаждать, повторно сжимать и использовать повторно или выпускать в атмосферу.
Насосы
Углекислый газ (CO
2) обычно перекачивается в виде жидкости, обычно при температуре ниже 5 ° C (41 ° F) и давлении около 50 бар. Растворитель перекачивается в виде жидкости, так как в этом случае он почти несжимаем; если бы он закачивался как сверхкритическая жидкость, большая часть хода насоса была бы «использована» на сжатие жидкости, а не на ее перекачивание. Для мелкомасштабных экстракций (до нескольких граммов в минуту) возвратно-поступательное CO
2 насосы или шприцевые насосы часто используются. Для крупномасштабных экстракций диафрагменные насосы наиболее распространены. Головки насоса обычно требуют охлаждения, а CO2 также будет охлаждаться перед входом в насос.
Сосуды под давлением
Сосуды под давлением может варьироваться от простых трубок до более сложных специализированных судов с быстроразъемными фитингами. Требуемое давление составляет не менее 74 бар, и большинство экстракций проводится при давлении ниже 350 бар. Однако иногда может потребоваться более высокое давление, например, при экстракции растительных масел, где иногда требуется давление 800 бар для полного смешивания двух компонентов. фазы.[4]
Судно должно быть оборудовано средствами обогрева. Его можно поместить в печь для небольших сосудов или в рубашку с масляным или электрическим нагревом для сосудов большего размера. Следует соблюдать осторожность, если на емкости используются резиновые уплотнения, поскольку сверхкритический диоксид углерода может растворяться в резине, вызывая набухание, и резина разорвется при сбросе давления.[нужна цитата]
Поддержание давления
Давление в системе должно поддерживаться насосом прямо через сосуд высокого давления. В небольших системах (примерно до 10 мл / мин) можно использовать простой ограничитель. Это может быть капиллярная трубка, отрезанная по длине, или игольчатый клапан, который можно отрегулировать для поддержания давления при различных скоростях потока. В более крупных системах регулятор противодавления будет использоваться, который поддерживает давление перед регулятором с помощью пружины, сжатого воздуха или клапана с электронным управлением. Вне зависимости от того, какой вариант используется, отопление должно подаваться, так как адиабатический расширение СО2 приводит к значительному охлаждению. Это проблематично, если в пробе присутствует вода или другой экстрагированный материал, поскольку они могут замерзнуть в ограничителе или клапане и вызвать закупорку.
Коллекция
Сверхкритический растворитель подают в сосуд при более низком давлении, чем в экстракционном сосуде. Плотность и, следовательно, растворяющая способность сверхкритических жидкостей резко меняется с давлением, и, следовательно, растворимость в CO с более низкой плотностью2 намного ниже, а материал осаждает для коллекции. Растворенный материал можно фракционировать, используя серию сосудов при пониженном давлении. Сотрудничество2 могут быть переработаны или сброшены до атмосферного давления и сброшены. Для аналитической SFE давление обычно снижается до атмосферного, и теперь газообразный диоксид углерода барботируется через растворитель для улавливания осажденных компонентов.
Отопление и охлаждение
Это важный аспект. Жидкость охлаждается перед перекачкой для поддержания жидких условий, а затем нагревается после повышения давления. Поскольку жидкость расширяется в сепаратор, высокая температура должны быть предусмотрены для предотвращения чрезмерного охлаждения. Для мелкомасштабных экстракций, например, для аналитических целей, обычно достаточно предварительно нагреть жидкость на отрезке трубки внутри печи, содержащей экстракционную ячейку. Ограничитель можно подогревать электрическим током или даже феном. Для более крупных систем энергия, необходимая на каждой стадии процесса, может быть рассчитана с помощью термодинамический свойства сверхкритической жидкости.[5]
Простая модель лесхозов
Есть два основных этапа SFE: перенос (диффузией или иным способом) твердых частиц на поверхность и растворение в сверхкритической жидкости. Другие факторы, такие как диффузия в частицу SF и обратимый высвобождение, такое как десорбция с активного сайта, иногда бывает значительным, но здесь не рассматривается подробно. На рис. 2 показаны этапы экстракции из сферической частицы, где в начале экстракции уровень экстрагента одинаков по всей сфере (рис. 2а). Когда начинается экстракция, материал сначала извлекается с края сферы, и концентрация в центре не изменяется (рис. 2b). По мере продвижения экстракции концентрация в центре сферы падает по мере того, как экстрагент диффундирует к краю сферы (рис. 2c).[6]
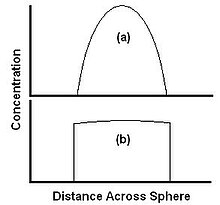
Относительные скорости диффузии и растворения проиллюстрированы двумя крайними случаями на рисунке 3. Рисунок 3a показывает случай, когда растворение происходит быстро по сравнению с диффузией. Материал уносится от края быстрее, чем может диффундировать из центра, поэтому концентрация на краю падает до нуля. Материал уносится так же быстро, как и достигает поверхности, а извлечение полностью ограничено диффузией. Здесь скорость экстракции может быть увеличена за счет увеличения скорости диффузии, например повышения температуры, но не за счет увеличения скорости потока растворителя. На рис. 3b показан случай, когда растворимость мала по сравнению с диффузией. Экстрагент может диффундировать к краю быстрее, чем его уносит растворитель, и профиль концентрации плоский. В этом случае скорость экстракции может быть увеличена за счет увеличения скорости растворения, например, за счет увеличения скорости потока растворителя.
Кривая извлечения% извлечения в зависимости от времени может использоваться для выяснения типа происходящего извлечения. На рисунке 4 (а) показана типичная кривая с контролируемой диффузией. Изначально экстракция идет быстро, пока концентрация на поверхности не упадет до нуля, а затем скорость становится намного медленнее. В конечном итоге извлеченный процент приближается к 100%. На рисунке 4 (b) показана кривая экстракции с ограниченной растворимостью. Скорость экстракции почти постоянна и стабилизируется только к концу экстракции. На рис. 4 (c) показана кривая, на которой наблюдаются значительные матричные эффекты, где есть своего рода обратимое взаимодействие с матрицей, такое как десорбция с активного центра. Извлечение стабилизируется, и если значение 100% неизвестно, то трудно сказать, что извлечение не завершено.
Оптимизация
Оптимум будет зависеть от цели экстракции. Для аналитической экстракции для определения, скажем, содержания антиоксидантов в полимер, то существенным фактором является полное извлечение в кратчайшие сроки. Однако для производства экстракта эфирного масла из растений количество CO2 использование будет связано со значительными затратами, и «полная» добыча не потребуется, выход 70-80%, возможно, будет достаточным для обеспечения экономической отдачи. В другом случае избирательность может быть более важной, и пониженная скорость экстракции будет предпочтительнее, если она обеспечивает большую дискриминацию. Поэтому можно сделать несколько универсально применимых комментариев. Однако некоторые общие принципы изложены ниже.
Максимальное распространение
Это может быть достигнуто за счет повышения температуры, набухания матрицы или уменьшения размера частиц. Набухание матрицы иногда можно увеличить, увеличив давление растворителя и добавив к нему модификаторы. Некоторые полимеры и эластомеры в частности резко набухают CO2, при этом диффузия увеличивается на несколько порядки величины в некоторых случаях.[7]
Повышение растворимости
Обычно более высокое давление увеличивает растворимость. Влияние температуры менее определенно, поскольку повышение температуры ближе к критической точке вызывает уменьшение плотности и, следовательно, растворяющей способности. При давлении значительно выше критическое давление, растворимость может увеличиваться с температурой.[8] Добавление небольших количеств модификаторов (иногда называемых азотными агентами), таких как метанол и этанол, также может значительно повысить растворимость, особенно более полярных соединений.
Оптимизация расхода
Скорость потока сверхкритического диоксида углерода следует измерять в единицах массового расхода, а не объема, поскольку плотность CO
2 изменяется в зависимости от температуры как перед входом в головки насоса, так и во время сжатия. Для подтверждения такого потока лучше всего использовать расходомеры Кориолиса. Чтобы максимизировать скорость экстракции, скорость потока должна быть достаточно высокой, чтобы экстракция была полностью ограничена диффузией (но это будет очень расточительно для растворителя). Однако для минимизации количества используемого растворителя экстракция должна быть полностью ограничена растворимостью (что займет очень много времени). Следовательно, скорость потока должна определяться в зависимости от конкурирующих факторов времени и затрат на растворитель, а также капитальных затрат на насосы, нагреватели и теплообменники. Оптимальная скорость потока, вероятно, будет где-то в той области, где растворимость и диффузия являются важными факторами.
Смотрите также
Рекомендации
- ^ Tanaka, Y .; Такеши, О (2004). «Экстракция фосфолипидов из икры лосося сверхкритическим диоксидом углерода и азотом». Журнал Oleo Science. 53 (9): 417–424. Дои:10.5650 / jos.53.417. Получено 2007-12-05.
- ^ Айзпуруа-Олайзола, Ойер; Ормазабал, Маркел; Вальехо, Азиер; Оливарес, Майтан; Наварро, Патрисия; Etxebarria, Нестор; Усобиага, Арезац (01.01.2015). «Оптимизация последовательного извлечения жирных кислот и полифенолов из отходов винограда Vitis Vinifera в сверхкритических жидкостях». Журнал пищевой науки. 80 (1): E101 – E107. Дои:10.1111/1750-3841.12715. ISSN 1750-3841. PMID 25471637.
- ^ Скуг (2007) [1998]. «29». Принципы инструментального анализа. Дэвид Харрис. п. 863. ISBN 978-0-495-01201-6.
- ^ Кинг, Джерри В. (2002). «34, Технология сверхкритических жидкостей для экстракции, фракционирования и проведения реакций липидов» (PDF). В Цун Мин Куо и Гарольд Гарднер (ред.). Липидная биотехнология. Нью-Йорк: Marcel Dekker Inc., стр. 663–687.
- ^ «Расчет плотности, энтальпии и энтропии для сверхкритического диоксида углерода с примерами». Архивировано из оригинал на 2008-05-05. Получено 2007-12-17.
- ^ Клиффорд, Тони (1999). Основы сверхкритических жидкостей. Оксфорд: Оксфордские научные публикации. ISBN 978-0-19-850137-4.
- ^ Vandenburg, H.J .; Клиффорд, Энтони А .; и другие. (1997). «Аналитическое извлечение добавок из полимеров». Аналитик. 122 (9): 101Р – 115Р. Дои:10.1039 / a704052k.
- ^ «Экстракция сверхкритических жидкостей, соображения плотности». Получено 2008-01-04.
дальнейшее чтение
- МакХью, Марк А .; Круконис, Вал Дж. (1994). Экстракция сверхкритических жидкостей - принципы и практика. Серия Баттерворта Хайнеманна в области химического машиностроения (2-е изд.). Баттерворт Хайнеманн. ISBN 978-0-7506-9244-1.
- Тейлор, Ларри Т (1996). Извлечение сверхкритических жидкостей. Методы аналитической химии. John Wiley and Sons, Inc. ISBN 978-0-471-11990-6.