WikiDer > Вицинальная дифункциональность
Вицинальная дифункциональность относится к химическая реакция с участием превращений в двух соседних центрах (чаще всего углеродных). Это превращение может осуществляться в α, β-ненасыщенных карбонильных соединениях через сопряженное сложение из нуклеофил в β-положение с последующим захватом полученного енолята электрофил в α-положении. Когда нуклеофил энолировать а электрофил а протон, реакция называется Майкл дополнение.[1]
Вступление
Реакции вицинальной дифункциональности, как правило, приводят к новым связям у двух соседних атомов углерода. Часто это происходит стереоконтролируемым образом, особенно если обе связи образуются одновременно, как в Реакция Дильса-Альдера. Активированные двойные связи представляют собой полезный инструмент для вицинальной дифункциональности, поскольку они могут действовать как обе нуклеофилы и электрофилы- один углерод обязательно беден электронами, а другой богат электронами. Таким образом, в присутствии нуклеофила и электрофила два атома углерода двойной связи могут действовать как «реле», опосредуя поток электронов от нуклеофила к электрофилу с образованием два, а не обычная химическая связь.
(1)
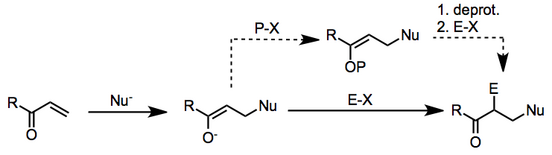
Чаще всего нуклеофил в данном контексте используется металлоорганическое соединение, а электрофилом является алкилгалогенид.
Механизм и стереохимия
Преобладающий механизм
Механизм работает в два этапа: β-нуклеофильное присоединение к ненасыщенному карбонильному соединению с последующим электрофильным замещением у α-углерода полученного энолировать.
Когда нуклеофил представляет собой металлоорганический реагент, механизмы первой стадии могут варьироваться. В некоторых случаях неясно, протекают ли реакции по ионному или радикальному механизму.[2] Исследования показали, что второй этап может даже происходить посредством одноэлектронных передач, когда восстановительный потенциал электрофила низок.[3] Общая схема, включающая ионные промежуточные соединения, показана ниже.
(2)
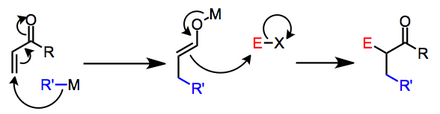
Литиевые органокупраты подвергаются окислительному присоединению к енонам с образованием β-замещенных енолятов лития после восстановительного отщепления медьорганических (III) разновидностей.[4]
В любом случае вторая стадия во всех случаях хорошо описывается как реакция енолата с электрофилом. Эти две стадии можно проводить как отдельные экспериментальные операции, если первоначально образованный енолят защищен после β-добавления. Однако, если эти две стадии не различимы, противоион енолята определяется противоионом нуклеофильного исходного материала и может сильно влиять на реакционную способность енолята.
Стереохимия
Контроль стерического доступа часто встречается в реакциях сопряженного присоединения. Таким образом, в циклических подложках a транс отношения между заместителями на α- и β-атомах углерода обычны. Конфигурация в α-положении менее предсказуема, особенно в случаях, когда может происходить эпимеризация. На основе стерического подхода к контролю новый α-заместитель будет транс к новому β-заместителю, и это наблюдается в ряде случаев.[5]
(3)
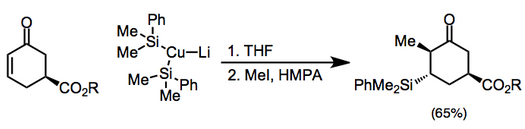
Объем и ограничения
Нуклеофилы и электрофилы
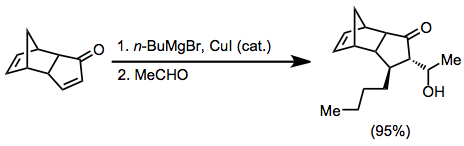
Органокоппер реагенты являются наиболее распространенными нуклеофилами для стадии β-присоединения. Эти реагенты могут быть получены каталитически в присутствии реагентов Гриньяра с использованием солей меди (I) или меди (II).[6]
(4)
Медные реагенты также могут использоваться стехиометрически, и среди них органокупраты являются наиболее распространенными (они более реакционноспособны, чем соответствующие нейтральные медноорганические (I) соединения). Противоион купрата может тонко влиять на реакцию присоединения и последующую реакцию енолята.[7] Добавки, включающие купраты высшего порядка, необходимо гасить силилгалогенидом перед алкилированием.[8](5)
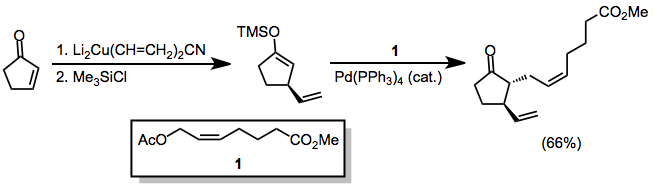
При использовании несимметричных купратов группа, углерод-медная связь которой содержит меньше s-символа, почти всегда переносится в β-положение. Однако есть несколько исключений.[9] В приведенном ниже примере проведение реакции в ТГФ привело к переносу винильной части, тогда как другие растворители способствовали переносу метила.
(6)
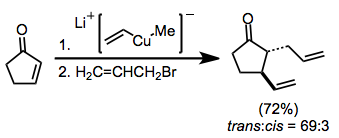
Енолаты также могут быть использованы в качестве нуклеофилов для реакций вицинальной дифункциональности. Чтобы предотвратить простое добавление по Майклу (которое завершается протонированием енолятного промежуточного соединения), захват электрофилом должен быть внутримолекулярным.[10]
(7)
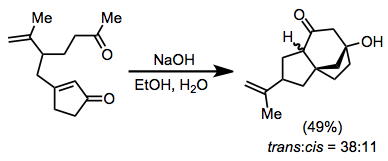
При рассмотрении электрофила следует учитывать природу енолята конъюгата, образующегося после первого шага. Следует использовать относительно реакционноспособные алкилирующие агенты, особенно в случаях, связанных с добавлением купратов (еноляты, образующиеся при добавлении купратов, часто нереактивны). Следует избегать оксофильных электрофилов, если желательно C-алкилирование. Электрофилы также не должны иметь достаточно кислых водородов, чтобы их можно было депротонировать енолятом.
α, β-ненасыщенные карбонильные соединения
Циклические α, β-ненасыщенные кетоны являются наиболее часто используемыми субстратами для вицинальной дифункциональности. Они, как правило, более реакционноспособны, чем ациклические аналоги, и подвергаются меньшему прямому присоединению, чем альдегиды. Амиды и сложные эфиры могут использоваться для стимулирования добавления конъюгата в случаях, когда прямое добавление может быть конкурентным (например, при добавлении литийорганических соединений).[11]
(8)
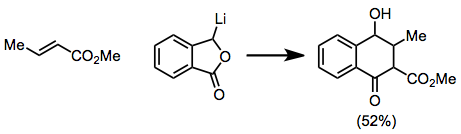
Поскольку стадия добавления очень чувствительна к стерическим эффектам, β-заместители, вероятно, замедлят реакцию. Ацетиленовые и алленовые субстраты реагируют с образованием продуктов с некоторой остаточной ненасыщенностью.[12][13]
(9)
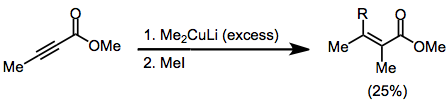
Синтетические приложения
В литературе существует большое количество примеров вицинальной дифункциональности ненасыщенных карбонильных соединений. В одном примере дифункциональность ненасыщенного лактона 1 был нанят на пути к изостегану. Это преобразование было выполнено в одном горшке.[14]
(10)
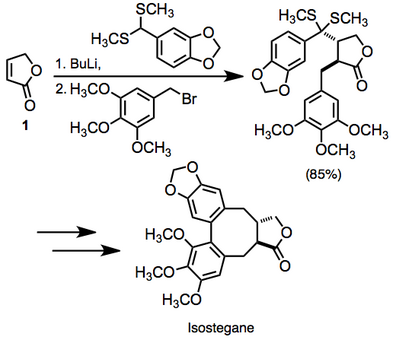
Поскольку реакция создает две новые связи с умеренно высокой степенью стереоконтроля, она представляет собой метод синтеза с высокой степенью конвергенции.
Условия и порядок экспериментов
Типичные условия
Металлоорганические нуклеофилы, используемые для добавления конъюгатов, чаще всего получают на месте. Необходимо использование безводного оборудования и инертной атмосферы. Поскольку эти факторы иногда трудно контролировать, а сила свежеприготовленных реагентов может существенно различаться, титрование методы необходимы для проверки чистоты реагентов. Существует ряд эффективных методологий титрования.[15]
Обычно вицинальную дифункциональность проводят в одном сосуде без промежуточного использования нейтрального защищенного енолята. Однако в определенных случаях может быть необходимо защитить промежуточное соединение β-присоединения. Однако до достижения этой точки можно выполнить фильтрацию растворителей и нуклеофилов, корректировки порядка добавления и корректировки противоионов для оптимизации однореакторного процесса для конкретной комбинации карбонильного соединения, нуклеофила и алкилирующего (или ацилирующего) агента. Регулировка растворителя между двумя этапами обычна; если используется один растворитель, тетрагидрофуран является предпочтительным растворителем. На этапе добавления конъюгата следует избегать полярных апротонных растворителей. Что касается температуры, то добавление конъюгатов обычно проводят при низких температурах (-78 ° C), в то время как алкилирование проводят при немного более высоких температурах (от 0 до -30 ° C). Для менее реакционноспособных алкилирующих агентов может потребоваться комнатная температура.
Пример процедуры[16]
(11)
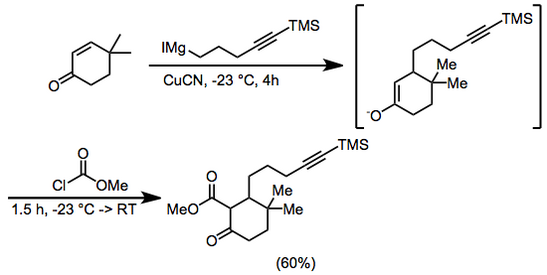
К 6,25 г (50 ммоль) 4,4-диметил-2-циклогексен-1-она и 0,5 г (5,6 ммоль) цианида меди в 400 мл диэтилового эфира при –23 ° ниже аргон добавляли 100 мл (~ 0,75 М в диэтиловом эфире) 5-триметилсилил-4-пентинилмагниййодида в течение 4 часов. Метилхлорформиат (8 мл, 100 ммоль) добавляли и перемешивание продолжали в течение 1 часа при –23 ° и 0,5 часа при комнатной температуре. Соляная кислота (100 мл, 2,0 М), затем добавляли органическую фазу и сушили сульфат магния. Растворитель удаляли и остаток хроматографировали на силикагеле с использованием 5% диэтиловый эфир–петролейный эфир с получением 9,66 г (60%) метил-3,3-диметил-6-оксо-2- [5- (триметилсилил) -4-пентинил] циклогексанкарбоксилата. ИК 2000, 2140, 1755, 1715, 1660, 1615, 1440, 1280, 1250, 1225, 1205 и 845 см – 1; 1H ЯМР (CDCl3) δ 0,13 (с, 9H), 0,93 (с, 3H), 1,02 (с, 3H), 1,2–2,3 (м, 11H), 3,74 (с, 3H). Анальный. Расчет. для C18ЧАС30О3Si: C 67,05; H 9,4. Найдено: C 67,1; H 9,65.
Рекомендации
- ^ Chapdelaine, M. J .; Халс, М. Орг. Реагировать. 1990, 38, 227-294. Дои:10.1002 / 0471264180.or038.02
- ^ Кори, Дж .; Боаз, В. Tetrahedron Lett., 1985, 6015; 6019.
- ^ Ashby, C .; Аргиропулос, Н. Tetrahedron Lett., 1984, 7.
- ^ Hannah, J .; Смит, Дж. Tetrahedron Lett., 1975, 187.
- ^ Ито, Й .; Nakatsuka, M .; Саегуса, Т. Варенье. Chem. Soc. 1982, 104, 7609.
- ^ Ж.-Б. Виль, Ф. Руэссак, Бык. Soc. Чим. Пт. II 1979, 273.
- ^ Четыре, П .; Riviere, H .; Тан, В. Tetrahedron Lett. 1977, 3879.
- ^ Ф.-Т. Луо, Э. Негиши, J. Org. Chem. 1985, 50, 4762.
- ^ Познер, H .; Whitten, E .; Sterling, J .; Брюнель, Дж. Tetrahedron Lett., 1974, 2591.
- ^ Алексакис, А .; Chapdelaine, J .; Познер, Х. Tetrahedron Lett., 1978, 4209.
- ^ Franck, W .; Bhat, V .; Субраманян, С. Варенье. Chem. Soc. 1986, 108, 2455.
- ^ Карлсон, М .; Oyler, R .; Петерсон, Р. J. Org. Chem. 1975, 40, 1610.
- ^ Бертран, М .; Gil, G .; Виала, Дж. Tetrahedron Lett., 1977, 1785.
- ^ Damon, R.E .; Schlessinger, R.H .; Блаунт, Дж. J. Org. Chem. 1976, 41, 3772.
- ^ Lipton, F .; Соренсен, М .; Sadler, C .; Шапиро, Х. J. Organomet. Chem. 1980, 186, 155.
- ^ Jackson, P .; Лей, В. J. Chem. Soc., Perkin Trans. 1, 1981, 1516.