WikiDer > Реакция конверсии водяного газа
В реакция конверсии водяного газа (WGSR) описывает реакцию монооксид углерода и водяной пар формировать углекислый газ и водород:
- CO + H2O ⇌ CO2 + H2
Реакция конверсии водяного газа была открыта итальянским физиком. Феличе Фонтана в 1780 году. Промышленное значение этой реакции было осознано намного позже. До начала 20 века водород получали путем реакции пара под высоким давлением с железом с образованием железа, оксида железа и водорода. С развитием промышленных процессов, требующих водорода, таких как Габер – Бош Для синтеза аммиака требовался менее затратный и более эффективный способ производства водорода. Чтобы решить эту проблему, WGSR был объединен с газификация угля для производства чистого водорода. Как идея водородная экономика набирает популярность, все больше внимания уделяется водороду в качестве источника топлива, заменяющего углеводороды.
Приложения
WGSR - важная промышленная реакция, которая используется при производстве аммиак, углеводороды, метанол, и водород. Он также часто используется вместе с паровой риформинг метана и других углеводородов. в Процесс Фишера-Тропша, WGSR - одна из наиболее важных реакций, используемых для уравновешивания H2/ CO соотношение. Он обеспечивает источник водорода за счет окиси углерода, что важно для производства водорода высокой чистоты для использования в синтезе аммиака.
Реакция конверсии водяного газа может быть нежелательной побочной реакцией в процессах с участием воды и монооксида углерода, например на основе родия Монсанто процесс. На основе иридия Cativa процесс использует меньше воды, что подавляет эту реакцию.
Топливные элементы
WGSR может помочь в эффективности топливные элементы за счет увеличения производства водорода. WGSR считается критическим компонентом снижения концентрации окиси углерода в клетках, которые подвержены отравлению угарным газом, например, в клетках. топливный элемент с протонообменной мембраной (PEM).[1] Преимущества этого применения двоякие: реакция конверсии водяного газа не только эффективно снизит концентрацию монооксида углерода, но также повысит эффективность топливных элементов за счет увеличения производства водорода.[1] К сожалению, современные коммерческие катализаторы, которые используются в промышленных процессах конверсии водяного газа, несовместимы с применением топливных элементов.[2] Учитывая высокий спрос на чистое топливо и критическую роль реакции конверсии водяного газа в водородных топливных элементах, разработка катализаторов конверсии водяного газа для применения в технологии топливных элементов является областью актуального исследовательского интереса.
Катализаторы для топливных элементов должны работать при низких температурах. Поскольку WGSR работает медленно при более низких температурах, когда равновесие благоприятствует производству водорода, реакторы WGS требуют большого количества катализаторов, что увеличивает их стоимость и размер за пределами практического применения.[1] Коммерческий катализатор LTS, используемый на крупных промышленных предприятиях, также является пирофорным в неактивном состоянии и поэтому представляет проблемы безопасности для потребительских приложений.[2] Разработка катализатора, который может преодолеть эти ограничения, актуальна для реализации водородной экономики.
Условия реакции
Равновесие этой реакции показывает значительную температурную зависимость, а константа равновесия уменьшается с повышением температуры, то есть более высокое образование водорода наблюдается при более низких температурах.
Температурная зависимость
Реакция конверсии водяного газа умеренно экзотермический обратимая реакция. Следовательно, с повышением температуры скорость реакции увеличивается, но образование диоксида углерода становится менее благоприятным.[3] Из-за экзотермической природы высокий процент оксида углерода термодинамически благоприятен при низких температурах. Несмотря на термодинамическую благоприятность при низких температурах, реакция протекает Быстрее при высоких температурах. Реакция конверсии водяного газа чувствителен к температуре, с тенденцией переходить в сторону окиси углерода при повышении температуры из-за Принцип Ле Шателье. В интервале температур 600–2000 K константа равновесия WGSR имеет следующую зависимость:[2]
Практические проблемы
Чтобы воспользоваться как преимуществами термодинамика и кинетика реакции, реакция конверсии водяного газа в промышленном масштабе проводится в несколько адиабатические стадии состоящий из высокотемпературного сдвига (HTS), за которым следует низкотемпературный сдвиг (LTS) с межсистемным охлаждением.[4] Первоначальный HTS использует преимущества высоких скоростей реакции, но термодинамически ограничен, что приводит к неполному превращению монооксида углерода и составу на выходе 2-4% моноксида углерода. Чтобы сместить равновесие в сторону производства водорода, используют последующий низкотемпературный реактор сдвига для получения состава на выходе моноксида углерода менее 1%. Переход от реакторов HTS к реакторам LTS требует межсистемного охлаждения. Из-за различных условий реакции на каждой стадии необходимо использовать разные катализаторы для обеспечения оптимальной активности. Коммерческий катализатор HTS представляет собой катализатор оксид железа-оксид хрома, а катализатор LTS представляет собой катализатор на основе меди. Порядок переходит от высокой к низкой температуре из-за подверженности медного катализатора отравлению серой, которая может оставаться после процесса парового преобразования.[2] Это требует удаления соединений серы перед реактором LTS с помощью защитного слоя, чтобы защитить медный катализатор. И наоборот, железо, используемое в реакции HTS, обычно более стойкое и устойчивое к отравлению соединениями серы. Хотя катализаторы HTS и LTS коммерчески доступны, их конкретный состав варьируется в зависимости от производителя. Важным ограничением для HTS является H2Отношение O / CO, при котором низкие отношения могут привести к побочным реакциям, таким как образование металлического железа, метанирование, отложение углерода и реакция Фишера-Тропша.
Низкотемпературный сдвиг
Сообщается, что типичный состав коммерческого катализатора LTS составляет 32-33% CuO, 34-53% ZnO, 15-33% Al.2О3.[2] Активный каталитический компонент - CuO. Функция ZnO заключается в обеспечении структурной поддержки, а также в предотвращении отравления меди серой. Аль2О3 предотвращает диспергирование и усадку гранул. Реактор смены LTS работает при температуре 200–250 ° C. Верхний предел температуры обусловлен склонностью меди к термическому спеканию. Эти более низкие температуры также уменьшают возникновение побочных реакций, которые наблюдаются в случае HTS. Благородные металлы, такие как платина, нанесенная на оксид церия, также использовались для LTS.[5]
Катализаторы высокотемпературного сдвига
Сообщается, что типичный состав коммерческого катализатора HTS составляет 74,2% Fe.2О3, 10,0% Cr2О30,2% MgO (остающийся процент приходится на летучие компоненты).[6] Хром стабилизирует оксид железа и предотвращает спекание. Катализаторы HTS работают в диапазоне температур от 310 ° C до 450 ° C. Температура увеличивается по длине реактора из-за экзотермический характер реакции. Таким образом, температура на входе поддерживается на уровне 350 ° C, чтобы температура на выходе не превышала 550 ° C. Промышленные реакторы работают в диапазоне от атмосферного давления до 8375 кПа (82,7 атм).[6] Поиск высокоэффективных катализаторов HT WGS остается интенсивной темой исследований в области химии и материаловедения. Энергия активации является ключевым критерием для оценки каталитических характеристик в реакциях WGS. На сегодняшний день одни из самых низких значений энергии активации были обнаружены для катализаторов, состоящих из наночастиц меди на церия вспомогательные материалы,[7] с такими низкими значениями, как Ea = 34 кДж / моль, относительно образования водорода.
Механизм
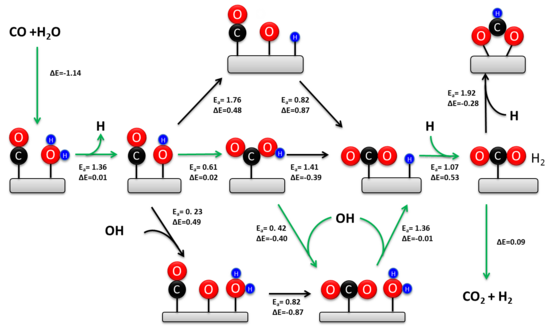
WGSR широко изучается уже более ста лет. Кинетически значимый механизм зависит от состава катализатора и температуры.[4][11] Было предложено два механизма: ассоциативный механизм Ленгмюра – Хиншелвуда и окислительно-восстановительный механизм. Окислительно-восстановительный механизм обычно считается кинетически значимым во время высокотемпературного WGSR (> 350 ° C) над промышленным железо-хромистым катализатором.[3] Исторически сложилось так, что вокруг механизма при низких температурах было гораздо больше споров. Недавние экспериментальные исследования подтверждают, что ассоциативный карбоксильный механизм является преобладающим низкотемпературным механизмом для катализаторов переходных металлов, нанесенных на оксид металла.[12][10]
Ассоциативный механизм
В 1920 году Армстронг и Хилдич впервые предложили ассоциативный механизм. В этом механизме CO и H2O адсорбируются на поверхности катализатора с последующим образованием промежуточного продукта и десорбцией H2 и CO2. В общем, H2О диссоциирует на катализаторе с образованием адсорбированных ОН и Н. Диссоциированная вода реагирует с СО с образованием промежуточного соединения карбоксила или формиата. Промежуточное соединение впоследствии дегидрируется с образованием CO2 и адсорбированный H. Два адсорбированных атома H рекомбинируют с образованием H2.
Существуют значительные разногласия по поводу кинетически релевантного промежуточного продукта во время ассоциативного механизма. Экспериментальные исследования показывают, что оба промежуточных продукта вносят вклад в скорость реакции над катализаторами переходных металлов, нанесенными на оксид металла.[12][10] Однако карбоксильный путь составляет около 90% от общей скорости из-за термодинамической стабильности адсорбированного формиата на оксидном носителе. Активный центр образования карбоксила состоит из атома металла, соседнего с адсорбированным гидроксилом. Этот ансамбль легко формируется на границе раздела металл-оксид и объясняет гораздо более высокую активность переходных металлов на оксидной основе по сравнению с протяженными металлическими поверхностями.[10] Частота перехода для WGSR пропорциональна константе равновесия образования гидроксила, что объясняет, почему восстанавливаемые оксидные носители (например, CeO2) более активны, чем невосстанавливаемые носители (например, SiO2) и протяженные металлические поверхности (например, Pt). В отличие от активного центра образования карбоксила, образование формиата происходит на протяженных металлических поверхностях. Промежуточный формиат может быть удален во время WGSR с использованием нанесенных на оксид атомно-диспергированных катализаторов переходных металлов, что дополнительно подтверждает кинетическое доминирование карбоксильного пути.[13]
Редокс механизм
Редокс-механизм включает изменение степени окисления каталитического материала. В этом механизме CO окисляется атомом O, внутренне принадлежащим каталитическому материалу, с образованием CO2. Молекула воды подвергается диссоциативной адсорбции на вновь образованной O-вакансии с образованием двух гидроксилов. Гидроксилы диспропорционируют с образованием H2 и вернуть каталитическую поверхность обратно в состояние до реакции.
Однородные модели
Механизм включает нуклеофильную атаку воды или гидроксида на центр M-CO, генерируя металакарбоновая кислота.[1][14]
Термодинамика
WGSR - это экзергонический, со следующими термодинамические параметры при комнатной температуре (298 К):
Свободная энергия ΔG⊖ = –6,82 ккал Энтальпия ΔH⊖ = –9,84 ккал Энтропия ΔS⊖ = –10,1 кал / град.
В водном растворе реакция менее экергоническая.[15]
Обратный сдвиг водяного газа
Поскольку реакция конверсии водяного газа является равновесной, «обратной» реакции конверсии водяного газа не существует. Водяной газ определяется как топливный газ, состоящий в основном из оксида углерода (CO) и водорода (H2). Термин «сдвиг» в сдвиге вода-газ означает изменение состава водяного газа (CO: H2) соотношение. Соотношение можно увеличить, добавив CO.2 или снижается за счет добавления пара в реактор.
Смотрите также
Рекомендации
- ^ а б c d Вильстих, Вольф; Ламм, Арнольд; Гастайгер, Хуберт А., ред. (2003). Справочник по топливным элементам: основы, технологии, применение. Нью-Йорк: Вили. ISBN 978-0-471-49926-8.
- ^ а б c d е ж Каллаган, Кейтлин (2006). Кинетика и катализ реакции конверсии водяного газа: микрокинетический и теоретико-графический подход (PDF) (Кандидат наук). Вустерский политехнический институт.
- ^ а б Ратнасами, Чандра; Вагнер, Джон П. (сентябрь 2009 г.). «Катализ конверсии водяного газа». Обзоры катализа. 51 (3): 325–440. Дои:10.1080/01614940903048661. S2CID 98530242.
- ^ а б Смит Р. Дж., Байрон; Муруганандам Логантан; Мурти Шекхар Шанта (2010). «Обзор реакции конверсии водяного газа». Международный журнал химической реакторной техники. 8: 1–32. Дои:10.2202/1542-6580.2238. S2CID 96769998.
- ^ Джайн, Ришаб; Марич, Раденка (апрель 2014 г.). «Синтез нано-Pt на носителе из оксида церия в качестве катализатора реакции конверсии воды и газа с помощью технологии реактивного распыления». Прикладной катализ A: Общие. 475: 461–468. Дои:10.1016 / j.apcata.2014.01.053.
- ^ а б Ньюсом, Дэвид С. (1980). «Реакция конверсии вода-газ». Обзоры катализа: наука и техника. 21 (2): 275–318. Дои:10.1080/03602458008067535.
- ^ Rodriguez, J.A .; Liu, P .; Ван, X .; Wen, W .; Hanson, J .; Hrbek, J .; Pérez, M .; Эванс, Дж. (15 мая 2009 г.). «Водно-газовая активность поверхности Cu и наночастиц Cu, нанесенных на оксиды металлов». Катализ сегодня. 143 (1–2): 45–50. Дои:10.1016 / j.cattod.2008.08.022.
- ^ Gokhale, Amit A .; Dumesic, Джеймс А .; Маврикакис, Манос (01.01.2008). «О механизме реакции низкотемпературного водяного газового перехода на меди». Журнал Американского химического общества. 130 (4): 1402–1414. Дои:10.1021 / ja0768237. ISSN 0002-7863. PMID 18181624.
- ^ Grabow, Lars C .; Gokhale, Amit A .; Эванс, Стивен Т .; Dumesic, Джеймс А .; Маврикакис, Манос (01.03.2008). «Механизм реакции водно-газового сдвига на платине: первые принципы, эксперименты и микрокинетическое моделирование». Журнал физической химии C. 112 (12): 4608–4617. Дои:10.1021 / jp7099702. ISSN 1932-7447.
- ^ а б c d Нельсон, Николас С .; Саньи, Янош (15 мая 2020 г.). «Гетеролитическая водородная активация: понимание поддерживающих эффектов при водно-газовой конверсии, гидродезоксигенации и окислительном катализе CO». Катализ ACS. 10 (10): 5663–5671. Дои:10.1021 / acscatal.0c01059.
- ^ Яо, Сию; Чжан, Сяо; Чжоу, Ву; Гао, Руи; Сюй, Вэньцянь; Е, Ифань; Линь, Лили; Вэнь Сяодун; Лю, Пин; Чен, Бинбин; Крамлин, Итан (22.06.2017). «Атомно-слоистые кластеры Au на α-MoC как катализаторы низкотемпературной реакции конверсии водяного газа». Наука. 357 (6349): 389–393. Дои:10.1126 / science.aah4321. ISSN 0036-8075. PMID 28642235. S2CID 206651887.
- ^ а б Нельсон, Николас С .; Нгуен, Мань-Тхыонг; Глезаков Василики-Александра; Руссо, Роджер; Саньи, Янош (октябрь 2019 г.). «Образование интермедиата карбоксила через метастабильный активный центр, генерируемый in situ во время катализа замещения воды и газа». Природный катализ. 2 (10): 916–924. Дои:10.1038 / s41929-019-0343-2. ISSN 2520-1158. S2CID 202729116.
- ^ Нельсон, Николас С .; Чен Линьсяо; Мейра, Дебора; Коварик, Libor; Саньи, Янош (2020). «Дисперсия палладия на TiO2 в процессе обратной реакции водно-газового сдвига: образование атомно-диспергированного палладия». Angewandte Chemie International Edition. н / д (н / д). Дои:10.1002 / anie.202007576. ISSN 1521-3773. PMID 32589820.
- ^ Баракат, Тарек; Рук, Джоанна К .; Дженти, Эрик; Кузен, Рено; Зифферт, Стефан; Су, Бао-Лянь (1 января 2013 г.). «Золотые катализаторы в технологиях восстановления окружающей среды и конверсии водяного газа». Энергетика и экология. 6 (2): 371. Дои:10.1039 / c2ee22859a.
- ^ King, A.D .; King, R. B .; Ян, Д. Б., «Гомогенный катализ реакции конверсии водяного газа с использованием пентакарбонила железа», J. Am. Chem. Soc. 1980, т. 102, стр. 1028-1032. Дои:10.1021 / ja00523a020