WikiDer > Аммиак
 | |||
| Имена | |||
|---|---|---|---|
| Имена ИЮПАК | |||
| Другие имена Азан (предназначен только для использования в названии производных аммиака) Нитрид водорода R-717 (хладагент) | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| 3DMet | |||
| 3587154 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.760 | ||
| Номер ЕС |
| ||
| 79 | |||
| КЕГГ | |||
| MeSH | Аммиак | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1005 | ||
| |||
| Характеристики | |||
| NH3 | |||
| Молярная масса | 17,031 г / моль | ||
| Внешность | Бесцветный газ | ||
| Запах | сильный резкий запах | ||
| Плотность | 0,86 кг / м3 (1,013 бар при температуре кипения) 0,769 кг / м3 (STP)[2] | ||
| Температура плавления | -77,73 ° С (-107,91 ° F, 195,42 К) (Тройная точка при 6,060 кПа, 195,4 К) | ||
| Точка кипения | -33,34 ° С (-28,01 ° F, 239,81 К) | ||
| Критическая точка (Т, п) | 132,4 ° C (405,5 K), 111,3 атм (11280 кПа) | ||
| 47% по массе (0 ° C) 31% по массе (25 ° C) 18% по массе (50 ° C)[5] | |||
| Растворимость | растворим в хлороформ, эфир, этиловый спирт, метанол | ||
| Давление газа | 857,3 кПа | ||
| Кислотность (пKа) | 32,5 (-33 ° С),[6] 10,5 (ДМСО) | ||
| Основность (пKб) | 4.75 | ||
| Конъюгированная кислота | Аммоний | ||
| Основание конъюгата | Амид | ||
| −18.0·10−6 см3/ моль | |||
| 1.3327 | |||
| Вязкость |
| ||
| Структура | |||
| C3в | |||
| Тригональная пирамида | |||
| 1.42 D | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 193 Дж · моль−1· K−1[8] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −46 кДж · моль−1[8] | ||
| Опасности | |||
| Паспорт безопасности | Видеть: страница данных ICSC 0414 (безводный) | ||
| Пиктограммы GHS |    [9] [9] | ||
| Сигнальное слово GHS | Опасность | ||
| H290, H301, H311, H314, H330, H334, H336, H360, H362, H373, H400 | |||
| P202, P221, P233, P261, P263, P271, P273, P280, P305 + 351 + 338, P310[9] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 132 | ||
| 651 ° С (1204 ° F, 924 К) | |||
| Пределы взрываемости | 15–28% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза) | 0,015 мл / кг (человек, перорально) | ||
LC50 (средняя концентрация) | 40 300 частей на миллион (крыса, 10 мин) 28 595 частей на миллион (крыса, 20 мин) 20 300 частей на миллион (крыса, 40 мин) 11590 частей на миллион (крыса, 1 час) 7338 частей на миллион (крыса, 1 час) 4837 частей на миллион (мышь, 1 час) 9859 частей на миллион (кролик, 1 час) 9859 частей на миллион (кошка, 1 час) 2000 частей на миллион (крыса, 4 часа) 4230 частей на миллион (мышь, 1 час)[10] | ||
LCLo (самый низкий опубликованный) | 5000 частей на миллион (млекопитающее, 5 мин) 5000 частей на миллион (человек, 5 мин)[10] | ||
| NIOSH (Пределы воздействия на здоровье в США):[11] | |||
PEL (Допустимо) | 50 частей на миллион (25 частей на миллион ACGIH- TLV; 35 частей на миллион СТЭЛ) | ||
REL (Рекомендуемые) | TWA 25 частей на миллион (18 мг / м3) ST 35 частей на миллион (27 мг / м3) | ||
IDLH (Непосредственная опасность) | 300 частей на миллион | ||
| Родственные соединения | |||
Другой катионы | Фосфин Арсин Стибин Висмутин | ||
Родственные гидриды азота | Гидразин Гидразойная кислота | ||
Родственные соединения | Гидроксид аммония | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Аммиак это сложный из азот и водород с формула NH3. А стабильный бинарный гидрид, и простейший гидрид пниктогена, аммиак - бесцветный газ с характерным резким запахом. Это обычное азотные отходы, особенно среди водных организмов, и вносит значительный вклад в питательный потребности земных организмов, служа предшественником еда и удобрения. Аммиак, прямо или косвенно, также является строительным блоком для синтеза многих фармацевтические продукты и используется во многих коммерческих чистящих средствах. Он в основном собирается путем вытеснения воздуха и воды вниз.
Хотя обычное явление в природе - как на земле, так и в внешние планеты из Солнечная система- и широко используется аммиак одновременно едкий и опасный в концентрированном виде. Классифицируется как чрезвычайно опасное вещество в Соединенных Штатах и подчиняется строгим требованиям отчетности предприятий, которые производят, хранят или используют его в значительных количествах.[12]
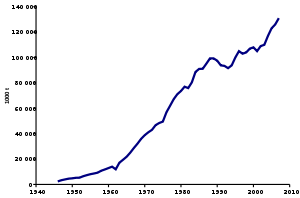
Мировое промышленное производство аммиака в 2018 году составило 175 млн тонн,[13] без существенных изменений по сравнению с мировым объемом промышленного производства в 175 млн тонн в 2013 году.[14] Технический аммиак продается как аммиачный раствор (обычно 28% аммиака в воде) или в виде сжатого или охлажденного безводного жидкого аммиака, перевозимого в цистернах или баллонах.[15]
NH3 кипит при -33,34 ° C (-28,012 ° F) при давлении один атмосфера, поэтому жидкость необходимо хранить под давлением или при низкой температуре. Бытовой аммиак или гидроксид аммония является решением NH3 в воде. Концентрация таких растворов измеряется в единицах измерения Шкала Боме (плотность), с 26 градусами Боме (около 30% (по массе) аммиака при 15,5 ° C или 59,9 ° F), что является типичным коммерческим продуктом с высокой концентрацией.[16]
Этимология
Плиний в книге XXXI его Естественная история, относится к соли, производимой в римской провинции Киренаика названный Hammoniacum, названный так из-за близости к близлежащему Храму Юпитер Амун (Греческий Ἄμμων Аммон).[17] Однако описание этой соли Плинием не соответствует свойствам хлорида аммония. В соответствии с Герберта Гувера комментарий в его английском переводе Георгиуса Агриколы De re Metallica, скорее всего, это была обычная морская соль.[18] В любом случае, эта соль в конечном итоге дала аммиак и аммоний составляет их имя.
Естественное явление
Аммиак - это химическое вещество, которое в следовых количествах встречается в природе и производится из азотистых веществ животного и растительного происхождения. Аммиак и соли аммония также содержатся в небольших количествах в дождевой воде, тогда как хлорид аммония (нашатырь), и сульфат аммония находятся в вулканических районах; кристаллы бикарбонат аммония были найдены в Патагония гуано.[19] В почки выделяют аммиак, чтобы нейтрализовать избыток кислоты.[20] Соли аммония распространяются через плодородную почву и в морскую воду.
Аммиак также встречается во всем Солнечная система на Марс, Юпитер, Сатурн, Уран, Нептун, и Плутон, среди прочего: на меньших, ледяных тела например, Плутон, аммиак может действовать как геологически важный антифриз, так как смесь воды и аммиака может иметь температуру плавления 173 К (-100 ° C; -148 ° F), если концентрация аммиака достаточно высока и, следовательно, позволяют таким телам сохранять внутренние океаны и активную геологию при гораздо более низкой температуре, чем это было бы возможно с одной только водой.[21][22] Вещества, содержащие аммиак или аналогичные ему, называются аммиачный.
Характеристики
Аммиак - бесцветный газ с характерным резким запахом. это легче воздуха, его плотность в 0,589 раза больше, чем у воздуха. Легко разжижается благодаря сильному водородная связь между молекулами; то жидкость кипит при -33,3 ° C (-27,94 ° F) и замерзает до белых кристаллов[19] при -77,7 ° C (-107,86 ° F).
Аммиак можно легко дезодорировать, реагируя с бикарбонат натрия или же уксусная кислота. Обе эти реакции образуют соль аммония без запаха.
- Твердый
- Симметрия кристалла кубическая, Символ Пирсона cP16, космическая группа P213 №198, постоянная решетки 0,5125нм.[23]
- Жидкость
- Жидкость аммиак обладает сильным ионизирующий силы, отражающие его высокие ε из 22. Жидкий аммиак имеет очень высокую стандартное изменение энтальпии испарения (23.35 кДж/ моль, ср. воды 40,65 кДж / моль, метан 8,19 кДж / моль, фосфин 14,6 кДж / моль) и поэтому может использоваться в лабораториях в неизолированных сосудах без дополнительного охлаждения. Видеть жидкий аммиак в качестве растворителя.
- Свойства растворителя
- Аммиак легко растворяется в воде. В водном растворе его можно выгнать кипячением. В водный раствор аммиака базовый. Максимальная концентрация аммиака в воде (a насыщенный раствор) имеет плотность 0,880 г / см3 и часто известен как «аммиак 0,880».
- Горение
- Аммиак не горит быстро и не выдерживает горение, кроме узких топливовоздушных смесей с содержанием воздуха 15–25%. При смешивании с кислород, горит бледным желтовато-зеленым пламенем. Возгорание происходит при хлор переходит в аммиак, образуя азот и хлористый водород; если хлор присутствует в избытке, то взрывоопасный трихлорид азота (NCl3) тоже образуется.
- Разложение
- При высокой температуре и в присутствии подходящего катализатора аммиак разлагается на составляющие элементы. Разложение аммиака - это слегка эндотермический процесс, требующий 5,5 ккал / моль аммиака, с образованием газообразного водорода и азота. Аммиак также может использоваться в качестве источника водорода для кислотных топливных элементов, если непрореагировавший аммиак может быть удален. Катализаторы из рутения и платины оказались наиболее активными, тогда как катализаторы из никеля на носителе были менее активными.
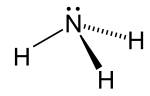
Структура
Молекула аммиака имеет тригонально-пирамидальный форма, как предсказано валентная оболочка теория отталкивания электронных пар (Теория VSEPR) с экспериментально определенным валентным углом 106,7 °.[24] Центральный атом азота имеет пять внешних электронов с дополнительным электроном от каждого атома водорода. Это дает в общей сложности восемь электронов или четыре пары электронов, расположенных тетраэдрически. Три из этих электронных пар используются в качестве пар связей, что оставляет одну одинокая пара электронов. Неподеленная пара отталкивается сильнее, чем пары связей, поэтому валентный угол составляет не 109,5 °, как ожидалось для правильного тетраэдрического расположения, а 106,7 °.[24] Эта форма дает молекуле диполь момент и делает это полярный. Полярность молекулы и особенно ее способность образовывать водородные связи, делает аммиак легко смешиваемым с водой. Одинокая пара превращает аммиак в основание, акцептор протона. Аммиак умеренно щелочной; 1,0 М водный раствор имеет pH 11,6, и если к такому раствору добавить сильную кислоту до тех пор, пока раствор не станет нейтральным (pH = 7), 99,4% молекул аммиака будут протонированный. Температура и соленость также влияют на долю NH4+. Последний имеет форму регулярного тетраэдр и является изоэлектронный с метан.
Молекула аммиака легко подвергается азотная инверсия при комнатной температуре; полезная аналогия - это зонтик вывернувшись наизнанку на сильном ветру. Энергетический барьер этой инверсии составляет 24,7 кДж / моль, а резонансная частота составляет 23,79 ГГц, соответствующий микроволновая печь излучение длина волны 1,260 см. Поглощение на этой частоте было первым микроволновый спектр быть замеченным.[25]
Амфотеричность
Одним из наиболее характерных свойств аммиака является его основность. Аммиак считается слабым основанием. Он сочетается с кислоты формировать соли; таким образом с соляная кислота это формирует хлорид аммония (нашатырь); с азотная кислота, нитрат аммонияи т. д. Идеально сухой аммиак не сочетается с совершенно сухим хлористый водород; влажность необходима, чтобы вызвать реакцию.[26][27] В качестве демонстрационного эксперимента открытые бутылки с концентрированным аммиаком и соляной кислотой производят облака хлорида аммония, которые, кажется, появляются «из ничего», когда соль образуется там, где встречаются два диффузных облака молекул, где-то между двумя бутылками.
Соли, образующиеся при действии аммиака на кислоты, известны как соли аммония и все содержат ион аммония (NH4+).[26]
Хотя аммиак хорошо известен как слабое основание, он также может действовать как чрезвычайно слабая кислота. Это протонное вещество, способное образовывать амиды (содержащие NH2− ион). Например, литий растворяется в жидком аммиаке с образованием раствора амид лития:
Самодиссоциация
Как и вода, жидкий аммиак подвергается молекулярная автоионизация сформировать свой кислотные и основные конъюгаты:
Аммиак часто действует как слабая база, так что в нем есть буферизация способность. Сдвиги pH вызовут больше или меньше аммоний катионы (NH+
4) и амидные анионы (NH−
2) присутствовать в решение. При стандартном давлении и температуре K = [NH+
4][NH−
2] = 10−30
Горение
Сжигание аммиака до азота и воды происходит. экзотермический:
В стандартное изменение энтальпии сгорания, ΔЧАС°c, выраженное в крот аммиака и с конденсацией образовавшейся воды составляет -382,81 кДж / моль. Динитроген - это термодинамический продукт сгорания: все оксиды азота неустойчивы относительно N2 и O2, что является принципом каталитический нейтрализатор. Оксиды азота могут образовываться в виде кинетических продуктов в присутствии подходящих катализаторов, и эта реакция имеет большое промышленное значение при производстве азотная кислота:
Последующая реакция приводит к NO2:
Сжигание аммиака на воздухе очень трудно без катализатора (например, платина марлевые или теплые оксид хрома (III)) из-за относительно низкой теплоты сгорания, более низкой скорости ламинарного горения, высокой температуры самовоспламенения, высокой теплоты испарения и узкого диапазона воспламеняемости. Однако недавние исследования показали, что эффективное и стабильное сжигание аммиака может быть достигнуто с использованием вихревых камер сгорания, тем самым возрождая исследовательский интерес к аммиаку как топливу для производства тепловой энергии.[28] Диапазон воспламенения аммиака в сухом воздухе составляет 15,15–27,35%, а при 100% относительной влажности воздуха - 15,95–26,55%.[29] Для изучения кинетики горения аммиака требуется подробный надежный механизм реакции, однако знание химической кинетики аммиака во время процесса горения является сложной задачей.[30]
Образование других соединений
В органическая химия, аммиак может действовать как нуклеофил в замена реакции. Амины может образоваться при реакции аммиака с алкилгалогениды, хотя полученный -NH2 группа также является нуклеофильной, и вторичные и третичные амины часто образуются как побочные продукты. Избыток аммиака помогает свести к минимуму множественное замещение и нейтрализует галогенид водорода сформирован. Метиламин получают в промышленных масштабах реакцией аммиака с хлорметан, а реакция аммиака с 2-бромпропановой кислотой была использована для получения рацемический аланин с доходностью 70%. Этаноламин готовится по реакции раскрытия кольца с окись этилена: иногда реакция может пойти дальше, чтобы произвести диэтаноламин и триэтаноламин.
Амиды может быть получен реакцией аммиака с карбоновая кислота производные. Ацилхлориды являются наиболее реактивными, но аммиак должен присутствовать как минимум в двукратном избытке, чтобы нейтрализовать хлористый водород сформирован. Сложные эфиры и ангидриды также реагируют с аммиаком с образованием амидов. Аммониевые соли карбоновых кислот могут быть обезвоженный до амидов, если отсутствуют термочувствительные группы: требуется температура 150–200 ° C.
Водород в аммиаке подвержен замене множеством заместителей. При нагревании с натрий превращается в содамид, NaNH2.[26] С хлором, монохлорамин сформирован.
Пятивалентный аммиак известен как λ5-амин или, чаще, гидрид аммония. Это кристаллическое твердое вещество стабильно только при высоком давлении и при нормальных условиях снова разлагается на трехвалентный аммиак и газообразный водород. Это вещество когда-то исследовалось как возможное твердое ракетное топливо в 1966 году.[31]
Аммиак как лиганд

Аммиак может действовать как лиганд в переходный металл комплексы. Это чистый σ-донор, расположенный в середине спектрохимический ряд, и показывает промежуточные жесткий-мягкий поведение (см. также Модель ECW). Его относительную донорскую силу по отношению к ряду кислот по сравнению с другими основаниями Льюиса можно проиллюстрировать с помощью Графики C-B.[32][33] По историческим причинам аммиак получил название аммин в номенклатуре координационные соединения. Некоторые известные амминные комплексы включают тетраамминдиаквакоппер (II) ([Cu (NH3)4(ЧАС2O)2]2+), темно-синий комплекс, образованный добавлением аммиака к раствору солей меди (II). Гидроксид тетраамминдиаквакоппера (II) известен как Реагент Швейцера, и обладает замечательной способностью растворять целлюлоза. Диамминсеребро (I) ([Ag (NH3)2]+) является активным видом в Реагент Толленса. Образование этого комплекса также может помочь различить осадки различных галогенидов серебра: хлорид серебра (AgCl) растворим в разбавленном (2M) растворе аммиака, бромид серебра (AgBr) растворим только в концентрированном растворе аммиака, тогда как йодид серебра (AgI) не растворяется в водном аммиаке.
Амминовые комплексы хром(III) были известны в конце 19 века и легли в основу Альфред ВернерРеволюционная теория строения координационных соединений. Вернер отметил только два изомера (фак- и мер-) комплекса [CrCl3(NH3)3], и пришел к выводу, что лиганды должны быть расположены вокруг иона металла на вершины из октаэдр. Это предложение было подтверждено Рентгеновская кристаллография.
Амминовый лиганд, связанный с ионом металла, значительно более кислый, чем свободная молекула аммиака, хотя депротонирование в водном растворе все еще происходит редко. Одним из примеров является Каломель реакция, где образующееся соединение амидомертути (II) очень нерастворимо.
Аммиак образует аддукты 1: 1 с различными кислотами Льюиса, такими как I2, фенол и Al (CH3)3. Аммиак - это твердая база и это Параметры E & C EB = 2.31 и C B = 2,04. Его относительную донорную силу по отношению к ряду кислот по сравнению с другими основаниями Льюиса можно проиллюстрировать с помощью Графики C-B.
Обнаружение и определение
Аммиак в растворе
Аммиак и соли аммония могут быть легко обнаружены в очень мельчайших следах путем добавления Решение Несслера, который дает отчетливую желтую окраску в присутствии малейших следов аммиака или солей аммония. Количество аммиака в солях аммония можно оценить количественно путем отгонки солей с натрий или же гидроксид калия, образовавшийся аммиак абсорбируется известным объемом стандартного серная кислота а затем определяли избыток кислоты объемно; или аммиак может абсорбироваться соляная кислота и образовавшийся таким образом хлорид аммония осаждается в виде гексахлороплатинат аммония, (NH4)2PtCl6.[34]
Газообразный аммиак
Серные палочки сжигаются для обнаружения небольших утечек в промышленных системах охлаждения аммиака. Более высокие количества могут быть обнаружены путем нагревания солей едкой щелочью или негашеная известь, когда сразу почувствуется характерный запах аммиака.[34] Аммиак является раздражителем, и раздражение усиливается с концентрацией; то допустимый предел воздействия составляет 25 частей на миллион, а летальность выше 500 частей на миллион.[35] Обычные детекторы с трудом обнаруживают более высокие концентрации, тип детектора выбирается в соответствии с требуемой чувствительностью (например, полупроводниковый, каталитический, электрохимический). Предложены голографические датчики для определения концентраций до 12,5% по объему.[36]
Аммиачный азот (NH3-N)
Аммиачный азот (NH3-N) - это мера, обычно используемая для проверки количества аммоний ионы, полученные естественным путем из аммиака и возвращенные в аммиак в результате органических процессов в воде или сточных жидкостях. Это мера, используемая в основном для количественной оценки значений в системах очистки сточных вод и водоочистки, а также для оценки состояния природных и искусственных запасов воды. Он измеряется в единицах мг / л (миллиграмм на литр).
История

Древнегреческий историк Геродот упомянул, что были обнажения соли в районе Ливии, населенном народом, называемым «аммонийцы» (сейчас: Оазис Сива на северо-западе Египта, где до сих пор существуют соленые озера).[37][38] Греческий географ Страбон также упомянул соль из этого региона. Однако древние авторы Диоскорид, Апиций, Арриан, Синезий, и Аэций из Амиды описал эту соль как образующую прозрачные кристаллы, которые можно использовать для приготовления пищи и которые, по сути, каменная соль.[39] Hammoniacus sal появляется в трудах Плиний,[40] хотя не известно, совпадает ли этот термин с более современным солевым аммиаком (хлорид аммония).[19][41][42]
Ферментация мочи бактериями вызывает раствор аммиака; следовательно, ферментированная моча использовалась в Классическая античность стирать ткань и одежду, удалять волосы со шкуры при подготовке к дублению, служить в качестве едкий в крашеной ткани и для удаления ржавчины с железа.[43]
В виде нашатырного спирта (نشادر, нушадир)аммиак был важен для Мусульманские алхимики еще в 8 веке, впервые упоминается персидско-арабским химиком Джабир ибн Хайян,[44] и европейским алхимики с 13 века, упоминается Альбертус Магнус.[19] Он также использовался красильщики в Средний возраст в виде ферментированных моча для изменения цвета растительных красителей. В 15 веке Василий Валентин показали, что аммиак можно получить действием щелочей на нашатырный спирт.[45] В более поздний период, когда аммиак был получен путем перегонки копыт и рогов быков и нейтрализации полученного карбоната с помощью соляная кислота, название «дух хартшорна» применялось к аммиаку.[19][46]
Газообразный аммиак был впервые выделен Джозеф Блэк в 1756 г. нашатырь (Хлорид аммония) с кальцинированная магнезия (Оксид магния).[47][48] Он был снова изолирован Питер Вулф в 1767 г.,[49][50] к Карл Вильгельм Шееле в 1770 г.[51] и по Джозеф Пристли в 1773 г. и был назван им «щелочным воздухом».[19][52] Одиннадцать лет спустя, в 1785 году, Клод Луи Бертолле выяснил его состав.[53][19]
В Процесс Габера – Боша для производства аммиака из азота в воздухе был разработан Фриц Габер и Карл Бош в 1909 году и запатентован в 1910 году. Впервые он был использован в промышленных масштабах в Германии во время Первая Мировая Война,[54] после союзной блокады, которая перекрыла подачу нитратов из Чили. Аммиак использовался для производства взрывчатки для поддержания военных действий.[55]
До появления природного газа водород как прекурсор производство аммиака был произведен через электролиз воды или используя хлорно-щелочной процесс.
С появлением сталелитейной промышленности в 20 веке аммиак стал побочным продуктом производства коксующегося угля.
Использует
Удобрения
В США по состоянию на 2019 год примерно 88% аммиака использовалось в качестве удобрений в виде солей, растворов или безводно.[13] При внесении в почву он помогает повысить урожайность таких культур, как кукуруза и пшеница.[56] 30% сельскохозяйственного азота, применяемого в США, находится в форме безводного аммиака, а во всем мире ежегодно применяется 110 миллионов тонн.[57]
Предшественник азотистых соединений
Аммиак прямо или косвенно является предшественником большинства азотсодержащих соединений. Практически все синтетические соединения азота получают из аммиака. Важной производной является азотная кислота. Этот ключевой материал создается с помощью Оствальдский процесс к окисление аммиака с воздухом над платина катализатор при 700–850 ° C (1292–1 562 ° F), ≈9 атм. Оксид азота является промежуточным звеном в этом преобразовании:[58]
Азотная кислота используется для производства удобрения, взрывчаткаи многие азоторганические соединения.
Аммиак также используется для изготовления следующих соединений:
- Гидразин, в Процесс Олина Рашига и перекисный процесс
- Цианистый водород, в BMA процесс и Андрусовский процесс
- Гидроксиламин и карбонат аммония, в Процесс Рашига
- Фенол, в Процесс Рашига – Хукера
- Мочевина, в Процесс карбамида Bosch – Meiser И в Синтез Велера
- Аминокислоты, с помощью Синтез аминокислот Strecker
- Акрилонитрил, в Сохио процесс
Аммиак также можно использовать для получения соединений в реакциях, которые конкретно не названы. Примеры таких соединений включают: перхлорат аммония, нитрат аммония, формамид, тетроксид диазота, алпразолам, этаноламин, этилкарбамат, гексаметилентетрамин, и бикарбонат аммония.
Как уборщик
Бытовой аммиак - раствор NH3 в воде и используется как универсальный очиститель для многих поверхностей. Поскольку аммиак дает блеск без полос, одним из наиболее распространенных способов его использования является очистка стекла, фарфора и нержавеющей стали. Его также часто используют для чистки духовок и замачивания предметов, чтобы удалить прикипевшую грязь. Концентрация бытового аммиака колеблется от 5 до 10% по массе.[59] Производители чистящих средств в США обязаны предоставлять паспорт безопасности материала где перечислены использованные концентрации.[60]
Ферментация
Растворы аммиака от 16% до 25% используются в ферментация промышленность в качестве источника азота для микроорганизмов и для регулирования pH во время ферментации.
Противомикробное средство для пищевых продуктов
Еще в 1895 году было известно, что аммиак «сильно антисептик ... требуется 1,4 грамма на литр для сохранения говяжий чай."[61] В одном исследовании безводный аммиак уничтожил 99,999% зоонозные бактерии в 3-х видах корма для животных, но нет силос.[62][63] Безводный аммиак в настоящее время используется в коммерческих целях для уменьшения или устранения микробный заражение говядина.[64][65]Постная говядина с мелкой текстурой (широко известная как "розовая слизь") в мясной промышленности производится из жирных говяжий тримминг (около 50–70% жира) путем удаления жира с помощью тепла и центрифугирование, затем обработав его аммиаком, чтобы убить Кишечная палочка. Процесс был признан эффективным и безопасным. Министерство сельского хозяйства США на основе исследования, которое показало, что лечение снижает Кишечная палочка до необнаружимого уровня.[66] Существовали опасения по поводу безопасности процесса, а также жалобы потребителей на вкус и запах говядины, обработанной оптимальным уровнем аммиака.[67] Уровень аммиака в любом конечном продукте не приближается к уровню токсичности для человека.
Незначительные и новые применения
Холодильное оборудование - R717
Из-за свойств испарения аммиака это полезный хладагент.[54] Он широко использовался до популяризации хлорфторуглероды (Фреоны). Безводный аммиак широко используется в промышленных холодильных установках и на хоккейных площадках из-за его высокого содержания. энергоэффективность и невысокая стоимость. Он страдает недостатком токсичности и требует компонентов, устойчивых к коррозии, что ограничивает его бытовое и мелкомасштабное использование. Наряду с его использованием в современных парокомпрессионное охлаждение он используется в смеси вместе с водородом и водой в абсорбционные холодильники. В Калина цикл, значение которого для геотермальных электростанций возрастает, зависит от широкого диапазона кипения водно-аммиачной смеси. Аммиачный хладагент также используется в радиаторе S1 на борту Международная космическая станция в двух контурах, которые используются для регулирования внутренней температуры и позволяют проводить эксперименты в зависимости от температуры.[68][69]
Потенциальная важность аммиака как хладагента возросла с открытием того, что вентилируемые CFC и HFC являются чрезвычайно мощными и стабильными парниковыми газами.[70] Вклад в парниковый эффект ХФУ и ГФУ, используемых в настоящее время, если бы они были выпущены, соответствовали бы всем СО2 в атмосфере.[нужна цитата]
Для устранения газовых выбросов
Аммиак используется для очистки SO2 от сжигания ископаемого топлива, и полученный продукт превращается в сульфат аммония для использования в качестве удобрения. Аммиак нейтрализует оксид азота (NOИкс) загрязняющие вещества, выбрасываемые дизельными двигателями. Эта технология, получившая название SCR (селективное каталитическое восстановление) опирается на Ванадиякатализатор на основе.[71]
Аммиак можно использовать для уменьшения разливов газообразных фосген.[72]
Как топливо
Сырье плотность энергии жидкого аммиака 11,5 МДж / л,[73] что примерно в три раза меньше дизель. Есть возможность преобразовать аммиак обратно в водород, где его можно использовать для питания водородных топливных элементов или непосредственно в высокотемпературных топливных элементах.[74] Превращение аммиака в водород через амид натрия процесс,[75] либо для сжигания, либо в качестве топлива для топливный элемент с протонообменной мембраной,[73] возможно. Преобразование в водород позволит хранить водород почти при 18 вес% по сравнению с ≈5% для газообразного водорода под давлением.
Аммиачные двигатели или аммиачные двигатели, использующие аммиак в качестве рабочая жидкость, были предложены и время от времени использовались.[76] Принцип аналогичен тому, который используется в пожарный локомотив, но с аммиаком в качестве рабочего тела вместо пара или сжатого воздуха. Аммиачные двигатели были экспериментально использованы в 19 веке. Голдсуорси Герни в Великобритании и Трамвай Сент-Чарльз-авеню линия в Новом Орлеане в 1870-х и 1880-х годах,[77] и во время Вторая Мировая Война аммиак использовался для питания автобусов в Бельгии.[78]
Аммиак иногда предлагается в качестве практической альтернативы ископаемое топливо за двигатель внутреннего сгорания.[78][79][80] Его высокий октановое число из 120[81] и низкая температура пламени[82] позволяет использовать высокие степени сжатия без потери высокого образования NOx. Поскольку аммиак не содержит углерода, его сгорание не дает углекислый газ, монооксид углерода, углеводороды, или же сажа.
Хотя производство аммиака в настоящее время создает 1,8% мировых выбросов CO2, согласно докладу Королевского общества за 2020 год.[83] утверждает, что «зеленый» аммиак можно получить, используя низкоуглеродистый водород (синий водород и зеленый водород). К 2050 году возможна полная декарбонизация производства аммиака и достижение нулевых показателей.
Однако аммиак нелегко использовать в существующих Цикл Отто двигатели из-за очень узкой диапазон воспламеняемости, а также существуют другие препятствия для широкого использования автомобилей. Что касается поставок сырого аммиака, необходимо будет построить заводы для увеличения объемов производства, что потребует значительных капиталовложений и источников энергии. Хотя это второй по величине производимый химикат (после серной кислоты), масштабы производства аммиака составляют лишь небольшую часть мирового потребления нефти. Его можно производить из возобновляемых источников энергии, а также из угля или ядерной энергии. 60 МВт Рьюканская плотина в ТелемаркНорвегия много лет производила аммиак с 1913 года, обеспечивая удобрение для большей части Европы.
Несмотря на это, было проведено несколько тестов. В 1981 году канадская компания переоборудовала Chevrolet Impala 1981 года для работы на аммиаке в качестве топлива.[84][85] В 2007 году пикап Мичиганского университета, работающий на аммиаке, поехал из Детройта в Сан-Франциско в рамках демонстрации, потребовав только одной заправки в Вайоминге.[86]
В сравнении с водород как топливоаммиак гораздо более энергоэффективен, и его можно производить, хранить и доставлять с гораздо меньшими затратами, чем водород, который должен храниться в сжатом состоянии или в виде криогенной жидкости.[73][87]
Ракетные двигатели также работают на аммиаке. В Моторы реакции XLR99 ракетный двигатель, который приводил в действие Х-15 гиперзвуковой исследовательский самолет использовал жидкий аммиак. Хотя он и не такой мощный, как другие виды топлива, он не оставляет сажи в многоразовом ракетном двигателе, а его плотность примерно соответствует плотности окислителя, жидкого кислорода, что упрощает конструкцию самолета.
В начале августа 2018 года ученые из Австралияс Организация Содружества научных и промышленных исследований (CSIRO) объявила об успехе разработки процесса выделения водорода из аммиака и получения его сверхвысокой чистоты в качестве топлива для автомобилей. Для этого используется специальная мембрана. Две демонстрации автомобили на топливных элементах есть технологии, Hyundai Nexo и Toyota Mirai.[88]
В 2020 г. Саудовская Аравия отправлено сорок метрических тонн жидкого «голубого аммиака» в Японию для использования в качестве топлива.[89] Он был произведен как побочный продукт нефтехимической промышленности, и его можно сжигать без выделения парниковые газы. Его объемная плотность энергии почти вдвое больше, чем у жидкого водорода. Если процесс его создания может быть расширен за счет чисто возобновляемых ресурсов, производящих зеленый аммиак, это может иметь большое значение в предотвращении изменение климата.[90] Компания ACWA Мощность и город Неом объявили о строительстве завода по производству экологически чистого водорода и аммиака в 2020 году.[91]
Зеленый аммиак считается потенциальным топливом для будущих контейнеровозов. В 2020 году компании DSME и Решения MAN Energy объявила о строительстве аммиачного корабля, DSME планирует коммерциализировать его к 2025 году.[92]
Как стимулятор

Аммиак, как пар, выделяемый нюхательная соль, нашел широкое применение в качестве стимулятора дыхания. Аммиак обычно используется при незаконном производстве метамфетамин через Сокращение березы.[94] Метод Берча для получения метамфетамина опасен, потому что щелочной металл и жидкий аммиак чрезвычайно реактивны, а температура жидкого аммиака делает его восприимчивым к взрывному кипению при добавлении реагентов.[95]
Текстиль
Аммиак жидкий используется для обработки хлопковых материалов, придавая им такие свойства, как мерсеризация, используя щелочи. В частности, его используют для предварительной стирки шерсти.[96]
Подъемный газ
При стандартной температуре и давлении аммиак менее плотен, чем атмосфера, и имеет примерно 45-48% подъемной силы водорода или водорода. гелий. Аммиак иногда использовался для наполнения метеозондов в качестве подъемный газ. Из-за относительно высокой точки кипения (по сравнению с гелием и водородом) аммиак потенциально может быть охлажден и сжижен на борту судна. дирижабль для уменьшения подъемной силы и добавления балласта (и вернулся на газ для увеличения подъемной силы и уменьшения балласта).
Деревообработка
Аммиак использовался для затемнения четвертичного белого дуба в декоративно-прикладном искусстве и мебели в стиле миссии. Пары аммиака вступают в реакцию с естественными дубильными веществами в древесине и вызывают ее изменение цвета.[97]
Меры предосторожности

Соединенные штаты. Управление по охране труда и здоровья (OSHA) установил 15-минутный предел воздействия для газообразного аммиака в размере 35 промилле по объему в окружающем воздухе и 8-часовой предел воздействия 25 промилле по объему.[99] В Национальный институт охраны труда и здоровья (NIOSH) недавно снизил IDLH (уровень, непосредственно опасный для жизни и здоровья, уровень, при котором здоровый рабочий может находиться в течение 30 минут без необратимых последствий для здоровья) с 500 до 300, основываясь на недавних более консервативных интерпретациях оригинального исследования 1943 года. Другие организации имеют разные уровни воздействия. Стандарты ВМС США [США Bureau of Ships 1962] максимально допустимые концентрации (ПДК): непрерывное воздействие (60 дней): 25 частей на миллион / 1 час: 400 частей на миллион.[100] Пары аммиака имеют резкий, раздражающий резкий запах, предупреждающий о потенциально опасном воздействии. Средний порог запаха составляет 5 частей на миллион, что намного ниже любой опасности или повреждения. Воздействие очень высоких концентраций газообразного аммиака может привести к повреждению легких и смерти.[99] Аммиак регулируется в Соединенных Штатах как негорючий газ, но он соответствует определению материала, который является токсичным при вдыхании и требует разрешения на опасную безопасность при транспортировке в количествах, превышающих 13 248 л (3500 галлонов).[101]
Жидкий аммиак опасен, потому что он гигроскопичный и потому что это может вызвать едкие ожоги. Видеть Газовоз § Воздействие на здоровье конкретных грузов, перевозимых на газовозах для дополнительной информации.
Токсичность
Токсичность растворов аммиака обычно не вызывает проблем для людей и других млекопитающих, поскольку существует специальный механизм, предотвращающий его накопление в кровотоке. Аммиак превращается в карбамоилфосфат ферментом карбамоилфосфатсинтетаза, а затем входит в цикл мочевины быть включенным в аминокислоты или выводится с мочой.[102] Рыбы и амфибии у них отсутствует этот механизм, так как они обычно могут выводить аммиак из своего организма путем прямого выведения. Аммиак даже в разбавленных концентрациях очень токсичен для водных животных, и по этой причине он классифицированный в качестве опасно для окружающей среды.
Аммиак входит в состав табачный дым.[103]
Сточные воды коксования
Аммиак присутствует в потоках сточных вод коксования в качестве жидкого побочного продукта производства кокс из каменный уголь.[104] В некоторых случаях аммиак сбрасывается в морская среда где он действует как загрязнитель. В Металлургический завод Уайалла в Южная Австралия является одним из примеров установки по производству кокса, которая сбрасывает аммиак в морские воды.[105]
Аквакультура
Считается, что токсичность аммиака является причиной необъяснимых иным образом потерь в рыбоводных заводах. Избыток аммиака может накапливаться и вызывать изменение метаболизма или повышение pH тела подвергшегося воздействию организма. Переносимость зависит от вида рыб.[106] При более низких концентрациях, около 0,05 мг / л, неионизированный аммиак вреден для видов рыб и может привести к снижению темпов роста и конверсии корма, снижению плодовитости и плодовитости, а также к увеличению стресса и восприимчивости к бактериальным инфекциям и заболеваниям.[107] Под воздействием избытка аммиака у рыб может наблюдаться потеря равновесия, повышенная возбудимость, повышенная дыхательная активность и потребление кислорода, а также учащенное сердцебиение.[106] В концентрациях, превышающих 2,0 мг / л, аммиак вызывает повреждение жабр и тканей, крайнюю летаргию, судороги, кому и смерть.[106][108] Эксперименты показали, что смертельная концентрация для множества видов рыб составляет от 0,2 до 2,0 мг / л.[108]
Зимой, когда аквакультуре кормят меньше кормов, уровень аммиака может быть выше. Более низкие температуры окружающей среды снижают скорость фотосинтеза водорослей, поэтому любые присутствующие водоросли удаляют меньше аммиака. В условиях аквакультуры, особенно в крупных масштабах, не существует быстрого средства от повышенного уровня аммиака. Для уменьшения вреда для выращиваемой рыбы рекомендуется профилактика, а не коррекция.[108] а в открытых водных системах - в окружающей среде.
Информация о хранении
Похожий на пропан, безводный аммиак при атмосферном давлении кипит ниже комнатной температуры. Емкость для хранения 250psi (1.7 МПа) подходит для содержания жидкости.[109] Аммиак используется во множестве различных промышленных применений, требующих резервуаров для хранения из углеродистой или нержавеющей стали. Аммиак с содержанием воды не менее 0,2% по массе не вызывает коррозии углеродистой стали. Резервуары для хранения из углеродистой стали с NH3 с содержанием воды 0,2 процента или более могут прослужить более 50 лет.[110] Соединения аммония никогда не должны вступать в контакт с базы (за исключением запланированной и сдерживаемой реакции), так как может выделяться опасное количество газообразного аммиака.
Бытовое использование
Растворы аммиака (5–10% по весу) используются в качестве бытовых чистящих средств, особенно для стекла. Эти растворы раздражают глаза и слизистые оболочки (дыхательные и пищеварительные тракты) и, в меньшей степени, кожа. Следует проявлять осторожность, чтобы химическое вещество никогда не смешивалось с какой-либо жидкостью, содержащей отбеливатель, так как это может привести к образованию токсичного газа. Смешивание с хлор-содержащие продукты или сильные окислители, например бытовые отбеливать, может генерировать хлорамины.[111]
Лабораторное использование растворов аммиака
Опасность растворов аммиака зависит от концентрации: «разбавленные» растворы аммиака обычно составляют 5–10% по весу (<5,62 моль / л); «концентрированные» растворы обычно готовят с содержанием> 25% по весу. 25% -ный (по весу) раствор имеет плотность 0,907 г / см.3, а раствор с меньшей плотностью будет более концентрированным. В Классификация Европейского Союза аммиачных растворов приведено в таблице.
| Концентрация по весу (вес / вес) | Молярность | Концентрация масса / объем (вес / объем) | Классификация | R-фразы |
|---|---|---|---|---|
| 5–10% | 2,87–5,62 моль / л | 48,9–95,7 г / л | Раздражающий (Си) | R36 / 37/38 |
| 10–25% | 5,62–13,29 моль / л | 95,7–226,3 г / л | Едкий (C) | R34 |
| >25% | > 13,29 моль / л | > 226,3 г / л |
| R34, R50 |
Пары аммиака из концентрированных растворов аммиака сильно раздражают глаза и дыхательные пути, и с этими растворами следует обращаться только в вытяжном шкафу. Насыщенный («0,880» - см. #Характеристики) растворы могут создавать значительное давление внутри закрытой бутылки в теплую погоду, поэтому бутылку следует открывать осторожно; обычно это не проблема для 25% («0,900») решений.
Растворы аммиака нельзя смешивать с галогены, поскольку образуются токсичные и / или взрывоопасные продукты. Продолжительный контакт растворов аммиака с серебро, Меркурий или же йодид соли также могут приводить к образованию взрывоопасных продуктов: такие смеси часто образуются в качественный неорганический анализ, и его следует слегка подкисить, но не концентрировать (<6% мас. / об.) перед утилизацией после завершения испытания.
Лабораторное использование безводного аммиака (газообразного или жидкого)
Безводный аммиак классифицируется как токсичный (Т) и опасные для окружающей среды (N). Газ легковоспламеняющийся (температура самовоспламенения: 651 ° C) и может образовывать взрывоопасные смеси с воздухом (16–25%). В допустимый предел воздействия (PEL) в США - 50промилле (35 мг / м3), в то время как IDLH концентрация оценивается в 300 ppm. Повторное воздействие аммиака снижает чувствительность к запаху газа: обычно запах обнаруживается при концентрациях менее 50 ppm, но люди с пониженной чувствительностью могут не обнаружить его даже при концентрациях 100 ppm. Безводный аммиак разъедает медь- и цинк-содержащий сплавы, и так латунь арматуру нельзя использовать для работы с газом. Жидкий аммиак также может атаковать резинка и некоторые пластмассы.
Аммиак бурно реагирует с галогенами. Трииодид азота, а начальный фугас, образуется при контакте аммиака с йод. Аммиак вызывает взрывчатку полимеризация из окись этилена. Также образует взрывоопасные гремящий соединения с соединениями золото, серебро, Меркурий, германий или же теллур, и с Стибин. Сообщалось также о насильственных реакциях с ацетальдегид, гипохлорит решения, феррицианид калия и перекиси.
Синтез и производство
Аммиак является одним из наиболее производимых неорганических химикатов, мировое производство которого в 2018 году составило 175 миллионов тонн.[13] На Китай приходится 28,5% от этого объема, за ним следуют Россия с 10,3%, США с 9,1% и Индия с 6,7%.[13]
Перед началом Первая Мировая Война, большая часть аммиака была получена сухая перегонка[112] азотистых отходов растительного и животного происхождения, в том числе верблюд навоз, где это было дистиллированный за счет сокращения азотистая кислота и нитриты с водородом; кроме того, он был получен путем перегонки каменный уголь, а также разложением солей аммония под действием щелочной гидроксиды[113] Такие как негашеная известь:[114]
Для мелкомасштабного лабораторного синтеза можно нагреть мочевина и гидроксид кальция:
Процесс Габера-Боша
В массовом производстве аммиака в основном используется Процесс Габера – Боша, а газовая фаза реакция между водородом (H2) и азот (N2) при умеренно повышенной температуре (450 ° C) и высоком давлении (100 стандартных атмосфер (10 МПа)):[115]
Эта реакция является экзотермической и приводит к снижению энтропии, а это означает, что реакция благоприятствует при более низких температурах[116] и более высокое давление.[117] Это затрудняет и увеличивает затраты, поскольку более низкие температуры приводят к более медленному кинетика реакции (следовательно, более медленный скорость реакции)[118] и высокое давление требует высокопрочных сосудов под давлением[119] которые не ослаблены хрупкость водорода. Кроме того, двухатомный азот связан исключительно прочным тройная связь, что делает его довольно инертным.[120] Как выход, так и эффективность процесса Габера-Боша низкие, а это означает, что произведенный аммиак должен непрерывно отделяться и извлекаться, чтобы реакция протекала с заметной скоростью.[121] В сочетании с энергией, необходимой для производить водород[примечание 1] и очищенного атмосферного азота, производство аммиака - очень энергоемкий процесс, на который потребляется от 1 до 2% мировой энергии, 3% глобальных выбросов углерода,[123] и от 3 до 5% потребления природного газа.[124]
Аммиак жидкий как растворитель
Жидкий аммиак - самый известный и наиболее широко изученный неводный ионизирующий растворитель. Его наиболее заметным свойством является его способность растворять щелочные металлы с образованием сильно окрашенных, электропроводящих растворов, содержащих сольватированные электроны. Помимо этих замечательных решений, большую часть химического состава жидкого аммиака можно классифицировать по аналогии с соответствующими реакциями в водных растворах. Сравнение физических свойств NH3 с водными шоу NH3 имеет более низкую температуру плавления, температуру кипения, плотность, вязкость, диэлектрическая постоянная и электрическая проводимость; это связано, по крайней мере частично, с более слабой водородной связью в NH3 и поскольку такое связывание не может образовывать сшитые сети, поскольку каждый NH3 молекула имеет только одну неподеленную пару электронов по сравнению с двумя для каждого H2Молекула O. Ионная самооценкаконстанта диссоциации жидкого NH3 при -50 ° C составляет около 10−33.
Растворимость солей
| Растворимость (г соли на 100 г жидкости NH3) | |
|---|---|
| Ацетат аммония | 253.2 |
| Нитрат аммония | 389.6 |
| Нитрат лития | 243.7 |
| Нитрат натрия | 97.6 |
| Азотнокислый калий | 10.4 |
| Фторид натрия | 0.35 |
| Натрия хлорид | 157.0 |
| Бромид натрия | 138.0 |
| Йодид натрия | 161.9 |
| Тиоцианат натрия | 205.5 |
Жидкий аммиак является ионизирующим растворителем, хотя и в меньшей степени, чем вода, и растворяет ряд ионных соединений, включая многие нитраты, нитриты, цианиды, тиоцианаты, циклопентадиенильные комплексы металлов и бис (триметилсилил) амиды металлов.[125] Большинство солей аммония растворимы и действуют как кислоты в жидких растворах аммиака. Растворимость галогенид соли увеличивается от фторид к йодид. Насыщенный раствор нитрат аммония (Водолазное решение, названный в честь Эдвард Дайверс) содержит 0,83 моль растворенного вещества на моль аммиака и имеет давление газа менее 1 бара даже при 25 ° C (77 ° F).
Растворы металлов
Жидкий аммиак растворяет все щелочных металлов и другие электроположительный металлы, такие как Ca,[126] Sr, Ба, Европа, и Yb (также Mg с использованием электролитического процесса[127]). При низких концентрациях (<0,06 моль / л) образуются темно-синие растворы: они содержат катионы металлов и сольватированные электроны, свободные электроны, окруженные клеткой из молекул аммиака.
Эти растворы очень полезны в качестве сильных восстановителей. При более высоких концентрациях растворы имеют металлический вид и электрическую проводимость. При низких температурах два типа растворов могут сосуществовать как несмешиваемый фазы.
Редокс-свойства жидкого аммиака
| E° (V, аммиак) | E° (V, вода) | |
|---|---|---|
| Ли+ + е− ⇌ Ли | −2.24 | −3.04 |
| K+ + е− ⇌ K | −1.98 | −2.93 |
| Na+ + е− ⇌ Na | −1.85 | −2.71 |
| Zn2+ + 2e− ⇌ Zn | −0.53 | −0.76 |
| NH4+ + е− ⇌ ½ H2 + NH3 | 0.00 | — |
| Cu2+ + 2e− ⇌ Cu | +0.43 | +0.34 |
| Ag+ + е− ⇌ Ag | +0.83 | +0.80 |
Диапазон термодинамической стабильности жидких растворов аммиака очень узок, так как потенциал окисления до диазота, E° (N2 + 6NH4+ + 6e− ⇌ 8NH3) составляет всего +0,04 В. На практике как окисление до диазота, так и восстановление до дигидорода протекают медленно. Это особенно верно для восстановительных растворов: указанные выше растворы щелочных металлов стабильны в течение нескольких дней, медленно разлагаясь до амид металла и дигидроген. Большинство исследований с использованием жидких растворов аммиака проводится в восстановительных условиях; хотя окисление жидкого аммиака обычно происходит медленно, все же существует риск взрыва, особенно если ионы переходных металлов присутствуют в качестве возможных катализаторов.
Роль аммиака в биологических системах и болезнях человека

Аммиак - это одновременно метаболические отходы и метаболический вклад на протяжении всего биосфера. Это важный источник азота для живых систем. Хотя атмосферный азот изобилует (более 75%), немногие живые существа способны использовать этот атмосферный азот в его двухатомной форме, N2 газ. Следовательно, азотфиксация необходим для синтеза аминокислот, которые являются строительными блоками белок. Некоторые растения зависят от аммиака и других азотистых отходов, попадающих в почву в результате разложения. Другие, например азотфиксирующие бобовые, выгода от симбиотический отношения с ризобия которые создают аммиак из атмосферного азота.[129]
Биосинтез
У некоторых организмов аммиак производится из атмосферного азота путем ферменты называется нитрогеназы. Общий процесс называется азотфиксация. Интенсивные усилия были направлены на понимание механизма биологической фиксации азота; научный интерес к этой проблеме мотивирован необычной структурой активного центра фермента, который состоит из Fe7MoS9 ансамбль.[130]
Аммиак также является продуктом метаболизма аминокислота дезаминирование катализируется ферментами, такими как глутаматдегидрогеназа 1. Выделение аммиака часто встречается у водных животных. У человека быстро превращается в мочевина, который гораздо менее токсичен, особенно менее базовый. Эта мочевина является основным компонентом сухой массы моча. Большинство рептилий, птиц, насекомых и улиток выделяют мочевая кислота исключительно как азотные отходы.
В физиологии
Аммиак также играет роль как у нормальных, так и у ненормальных животных. физиология. Он биосинтезируется посредством нормального метаболизма аминокислот и токсичен в высоких концентрациях. В печень превращает аммиак в мочевину посредством ряда реакций, известных как цикл мочевины. Дисфункция печени, такая как цирроз, может привести к повышенному содержанию аммиака в крови (гипераммониемия). Аналогичным образом, дефекты ферментов, ответственных за цикл мочевины, такие как орнитин-транскарбамилаза, приводят к гипераммониемии. Гипераммонемия способствует спутанности сознания и кома из печеночная энцефалопатия, а также неврологическое заболевание, распространенное у людей с дефектами цикла мочевины и органические ацидурии.[131]
Аммиак важен для нормального кислотно-щелочного баланса животных. После образования аммония из глутамин, α-кетоглутарат может быть деградирован, чтобы произвести два бикарбонат ионы, которые затем доступны в качестве буферов для пищевых кислот. Аммоний выводится с мочой, что приводит к чистой потере кислоты. Аммиак может сам диффундировать по почечным канальцам, соединяться с ионом водорода и, таким образом, способствовать дальнейшему выведению кислоты.[132]
Экскреция
Ионы аммония - это токсичный отходы метаболизм в животные. У рыб и водных беспозвоночных он выделяется непосредственно в воду. У млекопитающих, акул и амфибий он превращается в цикл мочевины к мочевина, потому что он менее токсичен и может храниться более эффективно. У птиц, рептилий и наземных улиток метаболический аммоний превращается в мочевая кислота, который является твердым и поэтому может выводиться с минимальной потерей воды.[133]
В астрономии
Аммиак обнаружен в атмосферах планеты-гиганты, включая Юпитер, наряду с другими газами, такими как метан, водород и гелий. Внутри Сатурна могут быть замороженные кристаллы аммиака.[134] Естественно встречается на Деймос и Фобос - два спутники Марса.
Межзвездное пространство
Аммиак был впервые обнаружен в межзвездном пространстве в 1968 году по данным микроволновая печь выбросы со стороны галактическое ядро.[135] Это был первый многоатомный Чувствительность молекулы к широкому диапазону возбуждений и легкость, с которой ее можно наблюдать в ряде областей, сделали аммиак одной из наиболее важных молекул для изучения молекулярные облака.[136] Относительная интенсивность линий аммиака может использоваться для измерения температуры излучающей среды.
Обнаружены следующие изотопные формы аммиака:
Обнаружение тройного дейтерированный аммиак считался неожиданностью, так как дейтерия относительно мало. Считается, что низкие температуры позволяют этой молекуле выживать и накапливаться.[137]
С момента своего межзвездного открытия NH3 оказался бесценным спектроскопическим инструментом при изучении межзвездной среды. Благодаря большому количеству переходов, чувствительных к широкому диапазону условий возбуждения, NH3 был широко обнаружен астрономически - о его обнаружении сообщалось в сотнях журнальных статей. Ниже приведен образец журнальных статей, в которых освещается диапазон детекторов, которые использовались для идентификации аммиака.
Изучение межзвездного аммиака было важным для ряда областей исследований в последние несколько десятилетий. Некоторые из них описаны ниже и в основном связаны с использованием аммиака в качестве межзвездного термометра.
Механизмы межзвездного образования
Межзвездное содержание аммиака было измерено в различных средах. [NH3]/[ЧАС2] оценивается в диапазоне от 10−7 в маленьких темных облаках[138] до 10−5 в плотном ядре Комплекс молекулярных облаков Ориона.[139] Хотя в общей сложности было предложено 18 производственных маршрутов,[140] основной механизм образования межзвездных NH3 это реакция:
Константа скорости, k, данной реакции зависит от температуры окружающей среды и составляет 5,2 × 10−6 при 10 К.[141] Константу скорости рассчитывали по формуле . Для реакции первичного образования а = 1.05×10−6 и B = −0.47. Предполагая NH4+ изобилие 3 × 10−7 и содержание электронов 10−7 типично для молекулярных облаков, формирование будет происходить со скоростью 1.6×10−9 см−3s−1 в молекулярном облаке полной плотности 105 см−3.[142]
Все другие предложенные реакции образования имеют константы скорости на 2-13 порядков меньше, что делает их вклад в содержание аммиака относительно незначительным.[143] В качестве примера незначительного вклада других реакций формации можно привести реакцию:
имеет константу скорости 2,2×10−15. Предполагая, что H2 плотности 105 и [NH2]/[ЧАС2] соотношение 10−7, эта реакция идет со скоростью 2.2×10−12, более чем на 3 порядка медленнее, чем указанная выше первичная реакция.
Вот некоторые из других возможных реакций образования:
Механизмы межзвездного разрушения
Всего предложено 113 реакций, ведущих к разрушению NH.3. Из них 39 были включены в обширные таблицы химического состава соединений C, N и O.[144] Обзор межзвездного аммиака приводит следующие реакции в качестве основных механизмов диссоциации:[136]
с константами скорости 4,39 × 10−9[145] и 2,2 × 10−9,[146] соответственно. Приведенные выше уравнения (1, 2) бегают со скоростью 8,8 × 10−9 и 4,4 × 10−13, соответственно. В этих расчетах предполагались заданные константы скорости и содержания [NH3]/[ЧАС2] = 10−5, [H3+]/[ЧАС2] = 2×10−5, [HCO+]/[ЧАС2] = 2×10−9, а суммарные плотности п = 105, типичный для холодных плотных молекулярных облаков.[147] Ясно, что между этими двумя первичными реакциями уравнение (1) является доминирующей реакцией разрушения со скоростью ≈10 000 раз быстрее, чем уравнение (2). Это связано с относительно высоким содержанием H3+.
Обнаружение одиночной антенны
Радионаблюдения NH3 от 100-метровый радиотелескоп Эффельсберга показывают, что линия аммиака разделена на две составляющие - фоновый гребень и неразрешенное ядро. Фон хорошо соответствует местам, ранее обнаруженным CO.[148] 25-метровый телескоп Чилболтон в Англии обнаружил радиосигналы аммиака в H II регионы, HNH2О мазеры, Объекты H-H и другие объекты, связанные со звездообразованием. Сравнение ширины эмиссионных линий показывает, что турбулентные или систематические скорости не увеличиваются в центральных ядрах молекулярных облаков.[149]
Микроволновое излучение аммиака наблюдалось у нескольких галактических объектов, включая W3 (OH), Орион А, W43, W51 и пять источников в центре Галактики. Высокая скорость обнаружения указывает на то, что это обычная молекула в межзвездной среде и что в галактике часто встречаются области с высокой плотностью.[150]
Интерферометрические исследования
VLA наблюдения NH3 в семи регионах с высокоскоростными газовыми истечениями выявлены конденсации менее 0,1 ПК в L1551, S140 и Цефей А. У Cepheus A обнаружены три отдельных сгущения, одно из которых имеет сильно вытянутую форму. Они могут сыграть важную роль в создании биполярного оттока в регионе.[151]
Изображение внегалактического аммиака было получено с помощью VLA в IC 342. Горячий газ имеет температуру выше 70 К, что было определено из соотношений линий аммиака и, по-видимому, тесно связано с самыми внутренними частями стержня ядра, видимого в CO.[152] NH3 VLA также отслеживал выборку из четырех сверхкомпактных областей HII в галактике: G9.62 + 0.19, G10.47 + 0.03, G29.96-0.02 и G31.41 + 0.31. Основываясь на диагностике температуры и плотности, можно сделать вывод, что в целом такие сгустки, вероятно, являются местами массивного звездообразования на ранней стадии эволюции до образования сверхкомпактной области HII.[153]
Инфракрасное обнаружение
Поглощение твердым аммиаком на 2,97 мкм было зарегистрировано межзвездными зернами в Объект Беклина-Нойгебауэра и, вероятно, также в NGC 2264-IR. Это обнаружение помогло объяснить физическую форму ранее плохо изученных и связанных линий поглощения льда.[154]
Спектр диска Юпитера был получен из Воздушная обсерватория Койпера, охватывающая от 100 до 300 см−1 спектральный диапазон. Анализ спектра дает информацию о глобальных средних свойствах газообразного аммиака и аммиачной ледяной дымки.[155]
Всего было исследовано 149 положений темных облаков на предмет наличия «плотных ядер» с использованием вращающейся линии инверсии (J, K) = (1,1) NH3. Как правило, сердечники не имеют сферической формы с соотношением сторон от 1,1 до 4,4. Также обнаружено, что ядра со звездами имеют более широкие линии, чем ядра без звезд.[156]
Аммиак обнаружен в Туманность Драко и в одном или, возможно, двух молекулярных облаках, которые связаны с высокоширотными галактическими облаками. инфракрасный перистый. Открытие важно, потому что они могут представлять собой места рождения звезд B-типа металличности населения I в галактическом гало, которые могли быть рождены в галактическом диске.[157]
Наблюдения за ближайшими темными облаками
Уравновешивая стимулированное излучение со спонтанным излучением, можно построить связь между температура возбуждения и плотность. Более того, поскольку переходные уровни аммиака могут быть аппроксимированы двухуровневой системой при низких температурах, этот расчет довольно прост. Это предположение может быть применено к темным облакам, регионам, предположительно имеющим чрезвычайно низкие температуры, и возможным местам будущего звездообразования. Обнаружение аммиака в темных облаках показывает очень узкие линии, указывающие не только на низкие температуры, но и на низкий уровень турбулентности внутри облака. Расчет отношения линий обеспечивает измерение температуры облака, которое не зависит от предыдущих наблюдений за CO. Наблюдения за аммиаком согласовывались с измерениями CO при температурах вращения ≈10 К. С его помощью можно определить плотности, которые, по расчетам, находятся в диапазоне от 104 и 105 см−3 в темных облаках. Картирование NH3 дает типичные размеры облаков 0,1 ПК и массами около 1 солнечной массы. Эти холодные плотные ядра - места будущего звездообразования.
UC HII регионы
Сверхкомпактные области HII являются одними из лучших индикаторов звездообразования большой массы. Плотный материал, окружающий области UCHII, вероятно, в основном молекулярный. Поскольку полное изучение массивного звездообразования обязательно включает облако, из которого образовалась звезда, аммиак является неоценимым инструментом в понимании этого окружающего молекулярного материала. Поскольку этот молекулярный материал может быть пространственно разрешен, можно ограничить источники нагрева / ионизации, температуры, массы и размеры областей. Компоненты скорости с доплеровским смещением позволяют разделить отдельные области молекулярного газа, которые могут отслеживать истечения и горячие ядра, возникающие из формирующихся звезд.
Внегалактическое обнаружение
Аммиак обнаружен во внешних галактиках,[158][159] а измеряя одновременно несколько линий, можно непосредственно измерить температуру газа в этих галактиках. Соотношения линий означают, что температура газа теплая (≈50 К), происходящая из плотных облаков размером в десятки пк. Это изображение соответствует изображению в нашем Млечный Путь галактика - горячие плотные молекулярные ядра образуются вокруг вновь формирующихся звезд, погруженных в более крупные облака молекулярного материала в масштабе нескольких сотен пк (гигантские молекулярные облака; GMC).
Смотрите также
- Аммиак (страница данных)
- Аммиачный фонтан - Вид химической демонстрации
- Производство аммиака
- Раствор аммиака - Химическое соединение
- Стоимость электроэнергии по источникам - Сравнение затрат на разные источники производства электроэнергии
- Формовочный газ - Смесь водорода и азота
- Процесс Габера - Основной процесс производства аммиака
- Гидразин - Бесцветная легковоспламеняющаяся жидкость с запахом аммиака.
- Очистка воды - процесс удаления из воды нежелательных химикатов, биологических загрязнителей, взвешенных веществ
Примечания
- ^ Водород, необходимый для синтеза аммиака, чаще всего получают газификация углеродсодержащего материала, в основном природного газа, но другие потенциальные источники углерода включают уголь, нефть, торф, биомассу или отходы. По состоянию на 2012 год мировое производство аммиака, произведенного из природного газа с использованием процесса парового риформинга, составляло 72 процента.[122] Водород также можно производить из воды и электричества, используя электролиз: в свое время большая часть аммиака в Европе производилась на заводе Hydro в Веморк. Другие возможности включают производство биологического водорода или же фотолиз, но в настоящее время паровой риформинг природного газа является наиболее экономичным средством массового производства водорода.
Рекомендации
- ^ "НОМЕНКЛАТУРА НЕОРГАНИЧЕСКОЙ ХИМИИ Рекомендации ИЮПАК 2005 г." (PDF).
- ^ «Газы - Плотности». Получено 3 марта 2016.
- ^ Йост, Дон М. (2007). «Аммиак и жидкие растворы аммиака». Систематическая неорганическая химия. ЧИТАТЬ КНИГИ. п. 132. ISBN 978-1-4067-7302-6.
- ^ Блюм, Александр (1975). «О кристаллическом характере прозрачного твердого аммиака». Радиационные эффекты и дефекты в твердых телах. 24 (4): 277. Дои:10.1080/00337577508240819.
- ^ Budavari, Susan, ed. (1996). Индекс Merck: энциклопедия химикатов, лекарств и биологических препаратов (12-е изд.). Merck. ISBN 978-0-911910-12-4.
- ^ Перрин, Д. Д., Константы ионизации неорганических кислот и оснований в водном растворе; 2-е изд., Pergamon Press: Oxford, 1982.
- ^ Ивасаки, Хиродзи; Такахаши, Мицуо (1968). «Исследования транспортных свойств жидкостей при высоком давлении». Обзор физической химии Японии. 38 (1).
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A22. ISBN 978-0-618-94690-7.
- ^ а б Сигма-Олдрич Ко., Аммиак. Проверено 20 июля 2013 г.
- ^ а б «Аммиак». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Карманный справочник NIOSH по химической опасности. "#0028". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «40 C.F.R .: Приложение A к Части 355 - Список особо опасных веществ и их планируемые пороговые количества» (PDF) (1 июля 2008 г. ред.). Государственная типография. Архивировано из оригинал (PDF) 25 февраля 2012 г.. Получено 29 октября 2011. Цитировать журнал требует
| журнал =(помощь) - ^ а б c d «Обзор минерального сырья за 2020 год, стр. 117 - Азот» (PDF). USGS. 2020. Получено 12 февраля 2020.
- ^ «Азот (фиксированный) - статистика аммиака». USGS. 2017. Получено 12 февраля 2020.
- ^ Р. Норрис Шрив; Джозеф Бринк (1977). Химическая промышленность (4-е изд.). п. 276. ISBN 978-0-07-057145-7. Смотрите также Газовоз и Баллонный газ.
- ^ «Физические свойства гидроксида аммония» (PDF). Архивировано из оригинал (PDF) 27 ноября 2007 г.
- ^ "Плиний Старший, Естественная история, книга XXXI, глава 39. (7.) - Различные виды соли; методы ее приготовления и средства, полученные из нее".
- ^ Гувер, Герберт (1950). Георгиус Агрикола De Re Metallica - Перевод первого латинского издания 1556 г.. Нью-Йорк: Dover Publications. п. 560. ISBN 978-0486600062.
- ^ а б c d е ж грамм Чисхолм 1911, п. 861.
- ^ Киршбаум, Б; Sica, D; Андерсон, Ф. П. (1999). «Электролиты мочи и анионно-осмолярные разрывы мочи». Журнал лабораторной и клинической медицины. 133 (6): 597–604. Дои:10.1016 / S0022-2143 (99) 90190-7. ISSN 0022-2143. PMID 10360635.
- ^ Шеннон, Фрэнсис Патрик (1938) Таблицы свойств аквааммиачных растворов. Часть 1 Термодинамики абсорбционного охлаждения. Лихайский университет учится. Серия научно-технических
- ^ Водно-аммиачная суспензия может закручиваться под ледяной поверхностью Плутона. Университет Пердью (9 ноября 2015 г.)
- ^ Hewat, A.W .; Рикель, К. (1979). «Кристаллическая структура дейтероаммиака между 2 и 180 К путем уточнения профиля нейтронного порошка». Acta Crystallographica Раздел A. 35 (4): 569. Bibcode:1979AcCrA..35..569H. Дои:10.1107 / S0567739479001340.
- ^ а б Хейнс, Уильям М., изд. (2013). CRC Справочник по химии и физике (94-е изд.). CRC Press. С. 9–26. ISBN 9781466571143.
- ^ Cleeton, C.E .; Уильямс, Н. Х. (1934). «Электромагнитные волны размером 1,1 см (0 дюймов). Длина волны и спектр поглощения аммиака». Физический обзор. 45 (4): 234. Bibcode:1934ПхРв ... 45..234С. Дои:10.1103 / PhysRev.45.234.
- ^ а б c Чисхолм 1911, п. 862.
- ^ Бейкер, Х. Б. (1894). «Влияние влаги на химическое изменение». J. Chem. Soc. 65: 611–624. Дои:10.1039 / CT8946500611.
- ^ Кобаяси, Хидеаки; Хаякава, Акихиро; Somarathne, K.D. Kunkuma A .; Окафор, Экенечукву С. (2019). «Наука и технология сжигания аммиака». Труды Института горения. 37: 109–133. Дои:10.1016 / j.proci.2018.09.029.
- ^ Хан, А.С .; Kelley, R.D .; Chapman, K.S .; Фентон, Д. (1995). Пределы воспламеняемости аммиачно-воздушных смесей. США: Управление научно-технической информации Министерства энергетики США. OSTI 215703.
- ^ Shrestha, Krishna P .; Зайдель, Ларс; Цойх, Томас; Мосс, Фабиан (7 июля 2018 г.). «Детальный кинетический механизм окисления аммиака, включая образование и восстановление оксидов азота» (PDF). Энергия и топливо. 32 (10): 10202–10217. Дои:10.1021 / acs.energyfuels.8b01056. ISSN 0887-0624.
- ^ Стерретт, К. Ф .; Карон, А. П. (1966). «Химия водородсодержащих топлив под высоким давлением». Космические лаборатории Нортропа. Архивировано из оригинал 23 августа 2011 г.. Получено 24 декабря 2009.
- ^ Лоуренс, К. и Гал, Дж.Ф. Шкалы основности и сродства Льюиса, данные и измерения, (Wiley 2010), стр. 50-51, IBSN 978-0-470-74957-9
- ^ Cramer, R.E .; Бопп, Т. Т. (1977). «Графическое отображение энтальпий образования аддуктов для кислот и оснований Льюиса». Журнал химического образования. 54: 612–613. Дои:10.1021 / ed054p612. На графиках, представленных в этом документе, использовались более старые параметры. Улучшенные параметры E&C перечислены в Модель ECW.
- ^ а б Чисхолм 1911, п. 863.
- ^ (OSHA) Источник: Сакс, Н. Ирвинг (1984). Опасные свойства промышленных материалов. 6-е изд. Ван Ностранд Рейнхольд. ISBN 0-442-28304-0.
- ^ Уртадо, Дж. Л. Мартинес; Лоу, К. Р. (2014). «Чувствительные к аммиаку фотонные структуры, изготовленные в мембранах нафиона с помощью лазерной абляции». Прикладные материалы и интерфейсы ACS. 6 (11): 8903–8908. Дои:10.1021 / am5016588. ISSN 1944-8244. PMID 24803236.
- ^ Геродот с Джорджем Роулинсоном, пер., История Геродота (Нью-Йорк, Нью-Йорк: Tandy-Thomas Co., 1909), том 2, книга 4, § 181, С. 304–305.
- ^ Земля аммонийцев упоминается в другом месте у Геродота. История И в Павсаний Описание Греции:
- Геродот с Джорджем Роулинсоном, пер., История Геродота (Нью-Йорк, Нью-Йорк: Tandy-Thomas Co., 1909), т. 1, Книга 2, § 42, п. 245, т. 2, Книга 3, § 25, п. 73, и т. 2, Книга 3, § 26, п. 74.
- Павсаний с W.H.S. Джонс, пер., Описание Греции (Лондон, Англия: William Heinemann Ltd., 1979), т. 2, книга 3, гл. 18, § 3, стр. 109 и 111 и т. 4, книга 9, гл. 16, § 1, п. 239.
- ^ Копп, Германн, Geschichte der Chemie [История химии] (Брауншвейг, (Германия): Friedrich Vieweg und Sohn, 1845), часть 3, п. 237. [на немецком]
- ^ Чисхолм 1911 цитирует Плиния Nat. Hist. xxxi. 39. См .: Плиний Старший с Джоном Бостоком и Х. Т. Райли, ред. Естественная история (Лондон, Англия: Х. Г. Бон, 1857), т. 5, Книга 31, § 39, п. 502.
- ^ «Сал-аммиак». Webmineral. Получено 7 июля 2009.
- ^ Плиний также упомянул, что когда некоторые образцы того, что якобы Натрон (Латинский: нитрум, нечистый карбонат натрия) обрабатывали известью (карбонатом кальция) и водой, Натрон будет издавать резкий запах, который, по мнению некоторых авторов, означает, что Натрон либо был хлоридом аммония, либо был загрязнен им. Видеть:
- Плиний с W.H.S. Джонс, пер., Естественная история (Лондон, Англия: William Heinemann Ltd., 1963), т. 8, книга 31, § 46, стр. 448–449. Со стр. 448–449: "Adulteratur in Aegypto calce, deprehenditur gusto. Sincerum enim statim resolvitur, Adulteratum calce pungit et asperum [или же Aspersum] reddit odorem vehementer ". (В Египте он [то есть натрон] смешан с известью, что определяется по вкусу; чистый натрон сразу тает, но фальсифицированный натрон ужалит из-за извести и испускает сильный горький запах [или: при опрыскивании [(Aspersum) с водой] издает резкий запах])
- Кидд, Джон, Очертания минералогии (Оксфорд, Англия: Н. Блисс, 1809), т. 2, п. 6.
- Мур, Натаниэль Фиш, Древняя минералогия: Или, запрос о минеральных веществах, упомянутых древними: ... (Нью-Йорк, Нью-Йорк: G. & C. Carvill & Co., 1834), С. 96–97.
- ^ Видеть:
- Форбс, Р.Дж., Исследования в области древних технологий, т. 5, 2-е изд. (Лейден, Нидерланды: E.J. Brill, 1966), стр. 19, 48, и 65.
- Мёллер, Уолтер О., Торговля шерстью древних Помпей (Лейден, Нидерланды: E.J. Brill, 1976), п. 20.
- Фабер, Г.А. (псевдоним: Goldschmidt, Günther) (май 1938 г.) «Крашение и дубление в классической античности». Обзор Ciba, 9 : 277–312. Доступны на: Елизаветинский костюм
- Смит, Уильям, Словарь греческих и римских древностей (Лондон, Англия: Джон Мюррей, 1875 г.), статья: «Фулло» (т. Е. Разносчики или отмыватели), С. 551–553.
- Руссе, Анри (31 марта 1917) «Прачечные Древних», Дополнение Scientific American, 83 (2152) : 197.
- Бонд, Сара Э., Торговля и табу: дурные профессии в римском Средиземноморье (Анн-Арбор, Мичиган: University of Michigan Press, 2016), п. 112.
- Бинц, Артур (1936) «Altes und Neues über die technische Verwendung des Harnes» (Древняя и современная [информация] о технологическом использовании мочи), Zeitschrift für Angewandte Chemie, 49 (23): 355–360. [на немецком]
- Витти, Майкл (декабрь 2016 г.) «Древнеримская химия мочи», Acta Archaeologica, 87 (1): 179–191. Уитти предполагает, что римляне получали аммиак в концентрированной форме, добавляя древесную золу (нечистая карбонат калия) в мочу, ферментированную в течение нескольких часов. Струвит (фосфат магния-аммония) при этом осаждается, и выход струвита может быть увеличен путем последующей обработки раствора выпь, богатый магнием раствор, который является побочным продуктом производства соли из морской воды. При обжаривании струвита выделяются пары аммиака.
- ^ Хак, Сайед Номанул (1995). Имена, природа и вещи: алхимик Джабир ибн Хайян и его Китаб аль-Ахджар (Книга камней). Springer. ISBN 978-0-7923-3254-1.
- ^ Spiritus salis urin (спирт соли мочи, то есть карбонат аммония), очевидно, был произведен до Валентина, хотя он представил новый, более простой метод его приготовления в своей книге: Валентин, Василий, Vier Tractätlein Fr. Базилий Валентини ... [Четыре эссе брата Василия Валентайна ...] (Франкфурт-на-Майне, (Германия): Лука Йеннис, 1625), "Дополнение к зугабе" (Дополнение или приложение), стр. 80–81: "Der Weg zum Universal, damit die drei Stein zusammen kommen". (Путь к Вселенскому, чтобы три камня сошлись вместе.) С п. 81: "Der Spiritus salis Urinæ nimbt langes wesen zubereiten / dieser procß aber ist waß leichter unnd näher auß dem Salz von Armenia, ... Nun nimb sauberen schönen Armenischen Salz armoniac ohn alles sublimiren / thue ihn in ein Kolbenari / giesse ein daß es wie ein Muß oder Brey werde / vermachs baldt / dafür thu auch ein grosen vorlag / so lege sich als baldt der Spiritus Salis Urinæ im Helm an Crystallisch ... " (Дух соли мочи [то есть карбоната аммония] требует длительного метода [то есть процедуры] для приготовления; этот [то есть процесс Валентайна] [начинается] с соли из Армении [т.е. хлорида аммония], однако, немного проще и короче ... Теперь возьмите чистую хорошую армянскую соль, не сублимируя всю [ее]; положите ее в [дистилляционную] колбу; налейте масло винного камня [т.е. карбонат калия, который растворился только в воде, которую он имеет абсорбируется из воздуха] на нем, [так] что он [т.е. смесь] становится похожим на кашицу или пасту; соберите его [т.е. перегонный аппарат (перегонный куб)] быстро; для этого подключите большую приемную колбу; затем вскоре спирт из соли мочи осаждается в виде кристаллов в «шлеме» [то есть в выпускном отверстии для паров, которое находится наверху перегонной колбы] ...)
Смотрите также: Копп, Германн, Geschichte der Chemie [История химии] (Брауншвейг, (Германия): Friedrich Vieweg und Sohn, 1845), часть 3, п. 243. [на немецком] - ^ Морис П. Кросланд (2004). Исторические исследования на языке химии. Courier Dover Publications. п. 72. ISBN 978-0-486-43802-3.
- ^ Блэк, Джозеф (1893) [1755]. Эксперименты с белой магнезией, негашеной известью и другими щелочными веществами. Эдинбург: W.F. Глина.
- ^ Джейкобсон, Марк З. (23 апреля 2012 г.). Загрязнение воздуха и глобальное потепление: история, наука и решения. Издательство Кембриджского университета. ISBN 9781107691155.
- ^ "Бутылка Вульфа". Мир химии. Получено 1 июля 2017.
- ^ Вулф, Питер (1 января 1767 г.). «Эксперименты по дистилляции кислот, летучих щелочей и т. Д., Показывающие, как они могут быть сконденсированы без потерь и как с их помощью избежать неприятных и ядовитых паров: в письме г-на Питера Вулфа, FRS, Джону Эллису, эсквайру; FRS " Философские труды. 57: 517–536. Bibcode:1767РСПТ ... 57..517Вт. Дои:10.1098 / рстл.1767.0052. ISSN 0261-0523.
- ^ Живописная история жизни химика-аптекаря Карла Вильгельма Шееле. Американский институт истории фармации. 1942 г. HDL:1811/28946 / Изображение% 20Life% 20History_Scheele.pdf.
- ^ Видеть:
- Пристли, Джозеф (1773) "Extrait d'une lettre de M. Priestley, en date du 14 октября 1773" (Отрывок из письма мистера Пристли от 14 октября 1773 г.), Наблюдения за телосложением ..., 2 : 389.
- Пристли, Джозеф, Эксперименты и наблюдения на разных видах воздуха, т. 1, 2 изд. (Лондон, Англия: 1775 г.), Часть 2, § 1: Наблюдения в щелочном воздухе, стр. 163–177.
- Шофилд, Роберт Э., Просветленный Джозеф Пристли: исследование его жизни и творчества с 1773 по 1804 год (Университетский парк, Пенсильвания: издательство Пенсильванского государственного университета, 2004 г.), С. 93–94.
- К 1775 году Пристли обнаружил, что электричество может разлагать аммиак («щелочной воздух»), давая горючий газ (водород). См .: Пристли, Джозеф, Эксперименты и наблюдения на разных видах воздуха, т. 2 (Лондон, Англия: Дж. Джонсон, 1775 г.), С. 239–240.
- ^ Бертолле (1785) "Анализируйте летучие щелочи" (Анализ летучих щелочей), Mémoires de l'Académie Royale des Sciences, 316–326.
- ^ а б Макс Аппл (2006). «Аммиак». Аммиак, в Энциклопедии промышленной химии Ульмана.. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a02_143.pub2. ISBN 978-3527306732.
- ^ Смит, Роланд (2001). Завоевание химии. Сидней: Макгроу-Хилл. ISBN 978-0-07-470146-1.
- ^ Лассалетта, Луис; Биллен, Жиль; Гризетти, Бруна; Англад, Джульетта; Гарнье, Жозетт (2014). «50-летние тенденции эффективности использования азота в мировых системах земледелия: взаимосвязь между урожайностью и внесением азота в пахотные земли». Письма об экологических исследованиях. 9 (10): 105011. Bibcode:2014ERL ..... 9j5011L. Дои:10.1088/1748-9326/9/10/105011. ISSN 1748-9326.
- ^ Дэвид Браун (18 апреля 2013 г.). «Безводное аммиачное удобрение: много, важно, опасно». Вашингтон Пост. Получено 23 апреля 2013.
- ^ Холлеман, А. Ф .; Виберг, Э. (2001). Неорганическая химия. Сан-Диего: Academic Press. ISBN 978-0-12-352651-9.
- ^ "Факты об аммиаке". www.health.ny.gov. Получено 6 апреля 2018.
- ^ «Стандарт оповещения об опасностях OSHA: паспорта безопасности» (PDF). OSHA.
- ^ Сэмюэл Ридил (1895). Дезинфекция и дезинфицирующие средства: введение в изучение. Лондон: Чарльз Гриффин и компания. п.109.
- ^ Тайкарими, Мехрдад; Riemann, H.P .; Hajmeer, M.N .; Gomez, E. L .; Разавилар, В .; Cliver, D. O .; и другие. (2008). «Аммиачная дезинфекция кормов для животных - Лабораторное исследование». Международный журнал пищевой микробиологии. 122 (1–2): 23–28. Дои:10.1016 / j.ijfoodmicro.2007.11.040. PMID 18155794.
- ^ Kim, JS; Ли, YY; Ким, TH (январь 2016 г.). «Обзор технологии щелочной предварительной обработки для биоконверсии лигноцеллюлозной биомассы». Биоресурсные технологии. 199: 42–48. Дои:10.1016 / j.biortech.2015.08.085. PMID 26341010.
- ^ "Оценка методов лечения для уменьшения количества бактерий в текстурированной говядине", Дженсен, Жан Л. и другие., Американское общество сельскохозяйственных и биологических инженеров Ежегодное собрание 2009 г.
- ^ Справочный документ: Противомикробные меры для говядины, Дауна Винклер и Керри Б. Харрис, Центр безопасности пищевых продуктов, Департамент зоотехники, Техасский университет A&M, Май 2009 г., стр. 12
- ^ Мосс, Майкл (3 октября 2009 г.). "Бургер, разрушивший ее жизнь". Нью-Йорк Таймс.
- ^ Мосс, Майкл (31 декабря 2009 г.). «Безопасность метода переработки говядины под вопросом». Нью-Йорк Таймс.
- ^ Райт, Джерри (13 апреля 2015 г.). «Система охлаждения делает космическую станцию безопасной и продуктивной». НАСА. Получено 1 июля 2017.
- ^ "Система охлаждения Международной космической станции: как она работает (инфографика)". Space.com. Получено 1 июля 2017.
- ^ «Снижение использования и выбросов гидрофторуглеродов (ГФУ) в федеральном секторе с помощью SNAP» (PDF). Получено 2 декабря 2018.
- ^ "Дизель: экологичнее, чем вы думаете". Получено 7 июля 2009.
- ^ «Фосген: Руководство по охране здоровья и безопасности». Международная программа химической безопасности. 1998.
- ^ а б c Лан, Ронг; Тао, Шаньвэнь (28 августа 2014 г.). «Аммиак как подходящее топливо для топливных элементов». Границы энергетических исследований. 2: 35. Дои:10.3389 / fenrg.2014.00035.
- ^ Гиддей, С .; Badwal, S.P.S .; Munnings, C .; Долан, М. (10 октября 2017 г.). «Аммиак как средство транспортировки возобновляемой энергии». ACS Устойчивая химия и инженерия. 5 (11): 10231–10239. Дои:10.1021 / acssuschemeng.7b02219.
- ^ Дэвид, Уильям I. Ф .; Мейкпис, Джошуа В .; Callear, Samantha K .; Хантер, Хейзел М. А .; Тейлор, Джеймс Д .; Вуд, Томас Дж .; Джонс, Мартин О. (24 сентября 2014 г.). «Производство водорода из аммиака с использованием амида натрия». Журнал Американского химического общества. 136 (38): 13082–13085. Дои:10.1021 / ja5042836. ISSN 0002-7863. PMID 24972299.
- ^ Дуглас Селф (1 октября 2007 г.). "Аммиачные моторы". Получено 28 ноября 2010.
- ^ Луи С. Хенник; Элбридж Харпер Чарльтон (1965). Трамваи Нового Орлеана. Пеликан Паблишинг. С. 14–16. ISBN 9781455612598.
- ^ а б «Аммиак как транспортное топливо IV» (PDF). Норм Олсон - Энергетический центр Айовы. 15–16 октября 2007 г. Архивировано с оригинал (PDF) 7 февраля 2012 г.
- ^ Ли, Донгеун; Мин, Хёнгын; Пак, Хёнхо; Сон, Хан Хо (1 ноября 2017 г.). «Разработка новой стратегии сгорания для двигателя внутреннего сгорания, работающего на чистом аммиаке» (PDF). Сеульский национальный университет, факультет машиностроения. Получено 29 января 2019.
- ^ Брохи, Эмтиаз Али (2014). «Аммиак как топливо для двигателей внутреннего сгорания?» (PDF). Технологический университет Чалмерса. Получено 29 января 2019.
- ^ «Аммиак». chm.bris.ac.uk. Получено 3 марта 2016.
- ^ Захаракис-Юц, Джордж; Конг, Song-Charng (2013). «Характеристики двигателя с прямым впрыском аммиака» (PDF). Кафедра машиностроения, Государственный университет Айовы. Получено 29 января 2019.
- ^ «Аммиак: безуглеродные удобрения, запас топлива и энергии».
- ^ Аммиачный автомобиль на YouTube
- ^ "Наблюдайте" за аммиачным топливом'". Грег Везина. Получено 7 июля 2009.
- ^ «Добро пожаловать в NH3 Car». NH3Car.com.
- ^ Линдзон, Джаред (27 февраля 2019 г.). «Он создает новое топливо из разреженного воздуха - по 85 центов за галлон». ОЗИ. Получено 26 апреля 2019.
- ^ «Безуглеродное топливо»: австралийский прорыв в производстве водородных автомобилей может стать глобальным, Лекси Гамильтон-Смит, Новости ABC Online, 2018-08-08
- ^ «Саудовская Аравия впервые в мире отправляет голубой аммиак в Японию». Bloomberg.com. 27 сентября 2020 г.. Получено 28 сентября 2020.
- ^ ServiceJul. 12, Роберт Ф .; 2018; Вечер, 14:00 (12 июля 2018). «Аммиак - возобновляемое топливо, получаемое из солнца, воздуха и воды - может обеспечить энергию земного шара без углерода». Наука | AAAS. Получено 28 сентября 2020.CS1 maint: числовые имена: список авторов (связь)
- ^ «Будет ли Саудовская Аравия строить крупнейший в мире завод по производству экологически чистого водорода и аммиака?». energypost.eu. 17 сентября 2020 г.. Получено 9 октября 2020.
- ^ "DSME получает LR AIP для контейнеровоза на аммиачном топливе 23 000 TEU". Оффшорная энергия. 6 октября 2020 г.. Получено 9 октября 2020.
- ^ The Gazette Staff (6 октября 2009 г.). «Замки резервуаров для безводного аммиака имеют недостатки». Cedar Rapids Gazette.
- ^ "Генеральный прокурор Иллинойса | Основы понимания метамфетамина". Illinoisattorneygeneral.gov. Архивировано из оригинал 10 сентября 2010 г.. Получено 21 мая 2011.
- ^ Гринберг, Майкл И. (1 января 2003 г.). Профессиональная, промышленная и экологическая токсикология. Elsevier Health Sciences. ISBN 978-0323013406.
- ^ Włochowicz, A .; Стельмасяк, Э. (1983). «Изменение термических свойств шерсти после обработки нашатырным спиртом». Журнал термического анализа и калориметрии. 26 (1): 17. Дои:10.1007 / BF01914084. S2CID 96930751.
- ^ Дымящийся белый дуб. woodweb.com
- ^ Годовая книга полезных ископаемых, т. 3
- ^ а б "Часто задаваемые вопросы о токсичных веществах по аммиаку" (PDF). Агентство регистрации токсичных веществ и заболеваний (ATSDR). Сентябрь 2004 г.
- ^ Аммиак, Документация IDLH
- ^ Охватывается ли безводный аммиак Программой разрешений на использование опасных материалов? с сайта Министерство транспорта США (ТОЧКА)
- ^ Берг, JM; Тимочко, JL; Страйер, L (2002). «23.4: Ионы аммония превращаются в мочевину у большинства наземных позвоночных». Биохимия (5-е изд.).
- ^ Талхаут, Рейнскье; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхёйзен, Антун (2011). «Опасные соединения в табачном дыме». Международный журнал экологических исследований и общественного здравоохранения. 8 (12): 613–628. Дои:10.3390 / ijerph8020613. ISSN 1660-4601. ЧВК 3084482. PMID 21556207.
- ^ «Передовые решения для повторного использования сточных вод коксования, соответствующие стандартам циркуляционных систем охлаждения». www.wateronline.com. Получено 16 января 2016.
- ^ Васудеван Раджарам; Субиджой Датта; Кришна Парамешваран (30 июня 2005 г.). Устойчивые методы добычи полезных ископаемых: глобальная перспектива. CRC Press. п. 113. ISBN 978-1-4398-3423-7.
- ^ а б c Орам, Брайан. «Аммиак в подземных водах, стоке и ручьях». Водный центр. Получено 3 декабря 2014.
- ^ Hargreaves, J.A .; Такер, К.С. (2004). Управление аммиаком в рыбоводных прудах. Южный региональный центр аквакультуры.
- ^ а б c Сержант, Крис (5 февраля 2014 г.). «Управление уровнями аммиака в аквакультурной среде». Вода / сточные воды. Получено 3 декабря 2014.
- ^ Электронный кодекс федеральных правил: В архиве 4 ноября 2011 г. Wayback Machine. Ecfr.gpoaccess.gov. Проверено 22 декабря 2011 г.
- ^ https://ammoniatanks.com/
- ^ Ризк-Уайни, Розетта; Ферриоль, Мишель; Gazet, Josette; Согье-Коэн Адад; Мария Тереза (2006). Реакция окисления аммиака гипохлоритом натрия. Реакции производства и разложения хлораминов. Bulletin de la Société Chimique de France. 4. п. 512. Дои:10.1002 / 14356007.a02_143.pub2. ISBN 978-3527306732.
- ^ «Нобелевская премия по химии (1918 г.) - процесс Габера-Боша». Получено 7 июля 2009.
- ^ «Химия элементов группы 2 - Be, Mg, Ca, Sr, Ba, Ra». BBC.co.uk. Получено 7 июля 2009.
- ^ Видеть (Чисхолм 1911), стр.861.
- ^ Аткинс, P.W .; Overton, T.L .; Rourke, J.P .; Веллер, М. и Армстронг, Ф.А. (2010) Неорганическая химия Шрайвера и Аткинса. 5-е издание. В. Х. Фриман и компания, Нью-Йорк. п. 383. ISBN 978-1-42-921820-7
- ^ Видеть (Кларк 2013): «Прямая реакция (производство аммиака) является экзотермической. Согласно принципу Ле Шателье, это будет благоприятно, если вы понизите температуру. Система будет реагировать, перемещая положение равновесия, чтобы противодействовать этому - другими словами, производя больше тепла. Чтобы получить как можно больше аммиака в равновесной смеси, вам нужна как можно более низкая температура ».
- ^ Видеть (Кларк 2013): «Обратите внимание, что в левой части уравнения есть 4 молекулы, а в правой - только 2. Согласно принципу Ле-Шателье, если вы увеличите давление, система отреагирует, отдавая предпочтение реакции, которая производит меньше молекул. Это приведет к тому, что давление снова упадет. Чтобы получить как можно больше аммиака в равновесной смеси, вам потребуется как можно более высокое давление. 200 атмосфер - это высокое давление, но не слишком высокое ».
- ^ Видеть (Кларк 2013): «Однако 400–450 ° C - это не низкая температура! Соображения по скорости: чем ниже температура, которую вы используете, тем медленнее становится реакция. Производитель пытается производить как можно больше аммиака в день. Это не дает имеет смысл попытаться достичь равновесной смеси, которая содержит очень высокую долю аммиака, если реакция достигает этого равновесия в течение нескольких лет ».
- ^ Видеть (Кларк 2013): "Соображения по скорости: увеличение давления сближает молекулы. В данном конкретном случае это увеличит их шансы на попадание и прилипание к поверхности катализатора, где они могут реагировать. Чем выше давление, тем лучше с точки зрения скорость реакции газа. Экономические соображения: очень высокие давления очень дороги для производства по двум причинам. Вы должны построить чрезвычайно прочные трубы и защитные сосуды, чтобы выдерживать очень высокое давление. Это увеличивает ваши капитальные затраты при строительстве завода ".
- ^ «Химия азота». Соединения. Chem.LibreTexts.org. 5 июн 2019. Получено 7 июля 2019.
- ^ Видеть (Кларк 2013): «При каждом прохождении газов через реактор только около 15% азота и водорода превращается в аммиак. (Этот показатель также варьируется от завода к предприятию.) При непрерывной рециркуляции непрореагировавших азота и водорода общее преобразование составляет около 98% ».
- ^ «Аммиак». Технологии и меры промышленной эффективности. 30 апреля 2013 г.. Получено 6 апреля 2018.
- ^ Лихайский университет (9 июля 2018 г.). «Электрохимически произведенный аммиак может произвести революцию в производстве продуктов питания». Получено 15 декабря 2018.
Производство аммиака потребляет от 1 до 2% всей энергии в мире и является причиной примерно 3% глобальных выбросов двуокиси углерода.
- ^ Песня, Ян; Хенсли, Дейл; Боннесен, Питер; Лян, Лянго; Хуанг, Цзинсонг; Баддорф, Артур; Чаплинский, Тимоти; Энгл, Нэнси; Ву, Зили; Каллен, Дэвид; Мейер, Гарри III; Самптер, Бобби; Рондиноне, Адам (2 мая 2018 г.). «Физический катализатор электролиза азота до аммиака». Достижения науки. Национальная лаборатория Ок-Ридж. 4 (4): e1700336. Bibcode:2018SciA .... 4E0336S. Дои:10.1126 / sciadv.1700336. ЧВК 5922794. PMID 29719860. Получено 15 декабря 2018.
На синтез аммиака уходит от 3 до 5% мирового природного газа, что делает его значительным источником выбросов парниковых газов.
- ^ Neufeld, R .; Michel, R .; Herbst-Irmer, R .; Schöne, R .; Сталке, Д. (2016). «Введение донора водородной связи в слабонуклеофильное основание Бренстеда: гексаметилдисилазиды щелочных металлов (MHMDS, M = Li, Na, K, Rb и Cs) с аммиаком». Chem. Евро. Дж. 22 (35): 12340–12346. Дои:10.1002 / chem.201600833. PMID 27457218.
- ^ Эдвин М. Кайзер (2001). «Кальций – Аммиак». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rc003. ISBN 978-0471936237.
- ^ Комбеллас, C; Кануфи, Ф; Тьебо, А (2001). «Растворы сольватированных электронов в жидком аммиаке». Журнал электроаналитической химии. 499: 144–151. Дои:10.1016 / S0022-0728 (00) 00504-0.
- ^ Рот, Карл С. "eMedicine Specialities> Метаболические заболевания> Гипераммонемия". Получено 7 июля 2009.
- ^ Adjei, M. B .; Quesenberry, K. H .; Чамблис, К. Г. (июнь 2002 г.). «Азотфиксация и инокуляция кормовых бобовых культур». Расширение МФСА Флоридского университета. Архивировано из оригинал 20 мая 2007 г.
- ^ Игараси, Роберт Й .; Ларюхин, Михаил; Душ Сантуш, Патрисия К .; Ли, Хон-Ин; Дин, Деннис Р .; Seefeldt, Lance C .; Хоффман, Брайан М. (май 2005 г.). «Улавливание H-связанного активного сайта нитрогеназы FeMo-кофактора во время эволюции H2: характеристика с помощью ENDOR-спектроскопии». Журнал Американского химического общества. 127 (17): 6231–6241. Дои:10.1021 / ja043596p. PMID 15853328.
- ^ Zschocke, Йоханнес; Хоффман, Георг (2004). Vademecum Метаболизм. Schattauer Verlag. ISBN 978-3794523856.
- ^ Роуз, Бертон; Хельмут Реннке (1994). Почечная патофизиология. Балтимор: Уильямс и Уилкинс. ISBN 978-0-683-07354-6.
- ^ Кэмпбелл, Нил А.; Джейн Б. Рис (2002). "44". Биология (6-е изд.). Сан-Франциско: Pearson Education, Inc., стр.937–938. ISBN 978-0-8053-6624-2.
- ^ Отредактировал Кирк Манселл. Изображение предоставлено Лунным и планетарным институтом. НАСА. "NASA's Solar Exploration: Мультимедиа: Галерея: Интерьер газовых гигантов В архиве 20 февраля 2006 г. Wayback Machine". Проверено 26 апреля 2006 года.
- ^ Cheung, A.C .; Ранг, Д. М .; Townes, C.H .; Thornton, D. D .; Уэлч, У. Дж. (1968). "Обнаружение NH3 молекулы в межзвездной среде своим микроволновым излучением ». Phys. Rev. Lett. 21 (25): 1701. Bibcode:1968ПхРвЛ..21.1701С. Дои:10.1103 / PhysRevLett.21.1701.
- ^ а б Ho, P. T. P .; Таунс, К. Х. (1983). «Межзвездный аммиак». Анну. Rev. Astron. Астрофизики. 21 (1): 239–70. Bibcode:1983ARA & A..21..239H. Дои:10.1146 / annurev.aa.21.090183.001323.
- ^ Миллар, Т. Дж. (2003). «Фракционирование дейтерия в межзвездных облаках». Обзоры космической науки. 106 (1): 73–86. Bibcode:2003ССРв..106 ... 73М. Дои:10.1023 / А: 1024677318645. S2CID 189793190.
- ^ Ungerechts, H .; Walmsley, C.M .; Винньюиссер, Г. (1980). "Наблюдения за аммиаком и цианоацетиленом в высокоплотной активной зоне L-183 (L-134-N)". Astron. Астрофизики. 88: 259. Bibcode:1980A&A .... 88..259U.
- ^ Genzel, R .; Downes, D .; Хо, П. Т. П. (1982). "NH3 в Орион-КЛ - Новая интерпретация ». Астрофизический журнал. 259: L103. Bibcode:1982ApJ ... 259L.103G. Дои:10.1086/183856.
- ^ «Данные UMIST для астрохимии». Получено 7 июля 2009.
- ^ Викор, Л .; Аль-Халили, А .; Данаред, H .; Djuric, N .; Dunn, G.H .; Larsson, M .; Le Padellec, A .; Rosaen, S .; Аф Угглас, М. (1999). «Ветвящиеся фракции диссоциативной рекомбинации молекулярных ионов NH4 + и NH2 +». Астрономия и астрофизика. 344: 1027. Bibcode:1999А и А ... 344.1027В.
- ^ van Dishoeck, E. F .; Блэк, Дж. Х. (1986). «Комплексные модели диффузных межзвездных облаков - Физические условия и молекулярное содержание» (PDF). Astrophys. J. Suppl. Сер. 62: 109–145. Bibcode:1986ApJS ... 62..109V. Дои:10.1086/191135. HDL:1887/1980.
- ^ "astrochemistry.net". astrochemistry.net. Получено 21 мая 2011.
- ^ Prasad, S. S .; Охотница, В. Т. (1980). «Модель газовой химии в межзвездных облаках». Серия дополнений к астрофизическому журналу. 43: 1. Bibcode:1980ApJS ... 43 .... 1П. Дои:10.1086/190665.
- ^ Lininger, W .; Albritton, D. L .; Fehsenfeld, F.C .; Schmeltekopf, A. L .; Фергюсон, Э. Э. (1975). «Измерение зависимости кинетической энергии некоторых констант скорости экзотермического переноса протона». J. Chem. Phys. 62 (9): 3549. Bibcode:1975ЖЧФ..62.3549Л. Дои:10.1063/1.430946.
- ^ Smith, D .; Адамс, Н. Г. (1977). «Реакции CH+п ИОНЫ с аммиаком при 300 К ". Письма по химической физике. 47 (1): 145. Bibcode:1977CPL .... 47..145S. Дои:10.1016/0009-2614(77)85326-8.
- ^ Wooten, A .; Бозян, Э.П .; Гарретт, Д. Б. (1980). "Обнаружение C2H в холодных темных облаках ». Астрофизический журнал. 239: 844. Bibcode:1980ApJ ... 239..844Вт. Дои:10.1086/158168.
- ^ Wilson, T. L .; Downes, D .; Бигинг, Дж. (1979). «Аммиак в Орионе». Астрономия и астрофизика. 71 (3): 275. Bibcode:1979A&A .... 71..275 Вт.
- ^ MacDonald, G.H .; Литтл, Л. Т .; Браун, А. Т .; Riley, P.W .; Matheson, D. N .; Фелли, М. (1981). «Обнаружение новых источников аммиака». MNRAS. 195 (2): 387. Bibcode:1981МНРАС.195..387М. Дои:10.1093 / mnras / 195.2.387.
- ^ Morris, M .; Цукерман, Б .; Palmer, P .; Тернер, Б. Э. (1973). «Межзвездный аммиак». Астрофизический журнал. 186: 501. Bibcode:1973ApJ ... 186..501M. Дои:10.1086/152515.
- ^ Torrelles, J.M .; Ho, P. T. P .; Родригес, Л. Ф .; Канто, Дж. (1985). «VLA-наблюдения за аммиаком и сплошной средой в регионах с высокоскоростными истечениями газов». Астрофизический журнал. 288: 595. Bibcode:1985ApJ ... 288..595T. Дои:10.1086/162825.
- ^ Ho, P. T. P .; Martin, R. N .; Тернер, Дж. Л .; Джексон, Дж. М. (1990). "Визуализация внегалактического аммиака с помощью VLA - горячего газа в ядре IC 342". Письма в астрофизический журнал. 355: L19. Bibcode:1990ApJ ... 355L..19H. Дои:10.1086/185728.
- ^ Cesaroni, R .; Churchwell, E .; Hofner, P .; Walmsley, C.M .; Курц, С. (1994). «Горячий аммиак в сторону компактных областей HII». Астрономия и астрофизика. 288: 903. Bibcode:1994A & A ... 288..903C.
- ^ Knacke, R. F .; McCorkle, S .; Puetter, R.C .; Эриксон, Э. Ф .; Kraetschmer, W. (1982). «Наблюдение за межзвездным аммиачным льдом». Астрофизический журнал. 260: 141. Bibcode:1982ApJ ... 260..141K. Дои:10.1086/160241.
- ^ Ортон, Г. С .; Aumann, H.H .; Мартончик, Дж. В .; Эпплби, Дж. Ф. (1982). «Авиационная спектроскопия Юпитера в диапазоне 100–300 см.−1 регион: Глобальные свойства газообразного аммиака и ледяной дымки ». Икар. 52 (1): 81. Bibcode:1982 Icar ... 52 ... 81O. Дои:10.1016/0019-1035(82)90170-1.
- ^ Benson, P.J .; Майерс, П. (1989). «Обзор плотных ядер в темных облаках». Серия дополнений к астрофизическому журналу. 71: 89. Bibcode:1989ApJS ... 71 ... 89B. Дои:10.1086/191365.
- ^ Мебольд, У .; Heithausen, A .; Рейф, К. (1987). «Аммиак в галактическом гало и инфракрасных перистых облаках». Астрономия и астрофизика. 180: 213. Bibcode:1987 A&A ... 180..213M.
- ^ Martin, R. N .; Хо, П. Т. П. (1979). «Обнаружение внегалактического аммиака». Астрономия и астрофизика. 74 (1): L7. Bibcode:1979A&A .... 74L ... 7M.
- ^ Takano, S .; Nakai, N .; Кавагути, К. (1 апреля 2002 г.). «Наблюдения за аммиаком во внешних галактиках I. NGC 253 и M 82». Публикации Астрономического общества Японии. 54 (2): 195–207. Bibcode:2002PASJ ... 54..195T. Дои:10.1093 / pasj / 54.2.195.
Процитированные работы
- «Аква Аммиак». airgasspecialtyproducts.com. Архивировано из оригинал 19 ноября 2010 г.. Получено 28 ноября 2010.
 В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911). "Аммиак". Британская энциклопедия. 1 (11-е изд.). Издательство Кембриджского университета. С. 861–863.
В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911). "Аммиак". Британская энциклопедия. 1 (11-е изд.). Издательство Кембриджского университета. С. 861–863.- Кларк, Джим (апрель 2013 г.) [2002]. "ХАБЕРОВСКИЙ ПРОЦЕСС". Получено 15 декабря 2018.
дальнейшее чтение
- Бретерик, Л., изд. (1986). Опасности в химической лаборатории (4-е изд.). Лондон: Королевское химическое общество. ISBN 978-0-85186-489-1. OCLC 16985764.
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Housecroft, C.E .; Шарп, А. Г. (2000). Неорганическая химия (1-е изд.). Нью-Йорк: Прентис-Холл. ISBN 978-0-582-31080-3.
- Weast, R.C., ed. (1972). Справочник по химии и физике (53-е изд.). Кливленд, Огайо: Chemical Rubber Co.
внешняя ссылка
| Викискладе есть медиафайлы по теме Аммиак. |
- Международная карта химической безопасности 0414 (безводный аммиак), ilo.org.
- Международная карта химической безопасности 0215 (водные растворы), ilo.org.
- CID 222 из PubChem
- «Водный аммиак и другие растворы» (На французском). Institut National de Recherche et de Sécurité. Архивировано из оригинал 11 декабря 2010 г.
- Аварийное реагирование на выбросы (разливы) аммиачных удобрений для Министерства сельского хозяйства Миннесоты. ammoniaspills.org
- Национальный институт охраны труда и здоровья - Страница аммиака, cdc.gov
- Карманный справочник NIOSH по химической опасности - Аммиак, cdc.gov
- Аммиак, видео
| NH3 N2ЧАС4 | Курицы2)11 | ||||||||||||||||
| Ли3N | Быть3N2 | BN | β-C3N4 g-C3N4 CИксNу | N2 | NИксОу | NF3 | Ne | ||||||||||
| Na3N | Mg3N2 | AlN | Si3N4 | PN п3N5 | SИксNу SN S4N4 | NCl3 | Ar | ||||||||||
| K | Ca3N2 | ScN | Банка | VN | CrN Cr2N | MnИксNу | FeИксNу | Против | Ni3N | CuN | Zn3N2 | GaN | Ge3N4 | В качестве | Se | NBr3 | Kr |
| Руб. | Sr3N2 | YN | ZrN | NbN | β-Mo2N | Tc | RU | Rh | PdN | Ag3N | CdN | Гостиница | Sn | Sb | Te | NI3 | Xe |
| CS | Ба3N2 | Hf3N4 | TaN | WN | Re | Операционные системы | Ir | Pt | Au | Hg3N2 | TlN | Pb | BiN | По | В | Rn | |
| Пт | Ра3N2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла | CeN | Pr | Nd | Вечера | См | Европа | GdN | Tb | Dy | Хо | Э | Тм | Yb | Лу | |||
| Ac | Чт | Па | ООН | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||